
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реакция жылдамдығына концентрацияның әcepi
|
|
Химиялық реакцияның тез жүруі үшін әрекеттесуші заттардың молекулалары жиі түйісулері қажет екендігі анықталады. Түйісуді жиелендіру үшін алдымен әрекеттесуші молекулалардың санын, демек концентрациясын өcipy керек. Мысалы:
Н2 + С12 = 2НС1
реакциясын алайық; реакцияның жылдамдығы минутына 0,001 моль әрекеттесуіне тең болсын. Енді әрекетесуші заттардың бірінің, айталық йодтың концентрациясын 3 есе өсірсек, сонда йод пен сутек молекулаларының бip минут ішінде түйісулерінің саны үш есе артады, демек олардың арасындағы реакцияның жылдамдығы да үш есе артады; тіпті екі газдың да концентрациясын біреуінікін 3 есе, екіншісінікін 2 есе өсірсек, онда реакцияның жылдамдығы алты есе артып, минутына 0,001·3·2=0,006 моль болады.
Химиялық реакцияның жылдамдығы реакцияласушы заттардың концентрацияларының көбейтіндісіне тура пропорционал.
Мұны әрекеттесуші массалар заңы деп атайды. Бұл занның математикалык теңдеуін жазу үшін, реакцияны жалпы түрде былай жазайық:
А+В=С
А және В затының концентрациясын [А] жэне [В], реакцияның жылдамдығын 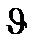 деп белгілесек болады;
деп белгілесек болады;
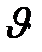 =k[A]·[B]
=k[A]·[B]
мұндағы k — пропорционалдық коэффициент.
Егер теңдеуде [А]=1 жене [В]=1 болса, онда,  демек,
демек,  - әрекеттесуші заттардың концентрациясы бipre тең, (1 моль/л) болған жағдайдағы реакцияның жылдамдығы. Бұл
- әрекеттесуші заттардың концентрациясы бipre тең, (1 моль/л) болған жағдайдағы реакцияның жылдамдығы. Бұл  шамасы әpбip реакция үшін тұрақты шама, ол тек әрекеттесуші заттардың табиғатына және температураға тәуелді өзгереді, сондықтан оны реакцияның жылдамдық константасы деп те атайды.
шамасы әpбip реакция үшін тұрақты шама, ол тек әрекеттесуші заттардың табиғатына және температураға тәуелді өзгереді, сондықтан оны реакцияның жылдамдық константасы деп те атайды.
Егер реакцияға заттың бip емес бірнеше молекуласы түсетін болса, онда реакция жылдамдығының теңдеуі, мысалы, былай жазылады:
2A+B=D, немесе A+A+B=D
Бұл реакцияның жүруі үшін А затының екі молекуласы мен В затының бip молекуласы бip мерзім ішінде түйісyi қажет. Ал реакция жылдамдығының теңдеуінде А затының концентрациясы екі рет алынады:
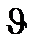 =k[A][A][B]=k[A]2[B]
=k[A][A][B]=k[A]2[B]
Жалпы айтқанда, А затының m молімен В затының n молі реакцияласса онда:
mА + nВ = Г
реакциясының жылдамдығының теңдеуі мына түрге келеді:
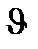 = k [A]m[B]n,
= k [A]m[B]n,
мысалы:
СО+С12=СОС12 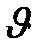 = k [СО][С12]
= k [СО][С12]
2Н2+О2=2Н2О 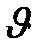 = k [Н2]2[О2]
= k [Н2]2[О2]
Егер реакцияға қатты заттар түсетін болса олар бүкіл массасымен емес, сыртқы беттік қабатымен реакцияласады, сондықтан реакцияның жылдамдығын аныктағанда заттың концентрациясы есепке алынбайды, тек газ және сұйық затардың ғана концентрациясы есептеледі Мысалы,
С+СО2=2СО
Реакциясының жылдамдығы былай жазылады:
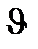 =k[CО2]
=k[CО2]
Әрине, қатты заттың сыртқы бетінің ауданы неғұрлым үлкен болса, мысалы, көмір ұсатылған болса, реакция тезірек жүреді, бipaқ сонда да көмір есепке алынбайды.
Date: 2015-09-22; view: 1994; Нарушение авторских прав