
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Коррозия железа
|
|
Стандартный электродный потенциал железа j0Fe2+/ Fe = -0,44 В и j0Fe3+/Fe = -0,037 В. Поэтому при коррозии в раствор переходят ионы Fe2+.
В водопроводной воде в присутствии кислорода воздуха стационарный потенциал железа jFe = -0,40 В, а в 3 % - ном растворе хлорида натрия достигает значения до jFe = -0,50 В. По этому железо может коррозировать с кислородной и с водородной деполяризацией.
При повышении концентрации кислорода в воде скорость кор-розии железа (малоуглеродистых сталей) сначала увеличивается, достигая максимума при содержании кислорода 16 см3/л, а затем уменьшается. Это связано с пассивацией железа кислородом из-за образования адсорбционной пассивной или оксидной плёнки.
В нейтральных растворах хлоридов и сульфатов с повышением концентрации соли скорость коррозии железа возрастает, а затем несколько уменьшается. Максимальная коррозия в 3 % - ном растворе NaCl, что связано с увеличением содержания ионов Cl- и уменьшением растворимости кислорода. При малой концентрации NaCl сказывается эффект активации анодного процесса ионами Cl-, а при большой ─ уменьшением растворимости кислорода.
В присутствии анионов 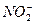 ,
, 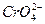 и др. скорость коррозии железа понижается и может быть сведена к нулю. Ингибирующее действие этих анионов связано с торможением анодного процесса.
и др. скорость коррозии железа понижается и может быть сведена к нулю. Ингибирующее действие этих анионов связано с торможением анодного процесса.
На коррозию железа влияет рН раствора. В кислых средах при повышении рН до 4 скорость коррозии закономерно уменьшается, а при рН = 4… 9,5 ─ остается постоянной из-за коррозии с кислородной деполяризацией. При этом образуется гидроксид желез (II), насы-щенный раствор которого имеет рН = 9,5. При рН > 9,5 у пограничного слоя раствора рН также увеличивается, в результате железо пассивируется и скорость коррозии уменьшается.
При большой концентрации щелочи и повышенной температуре скорость коррозии железа увеличивается. Процесс протекает с образованием аниона диоксоферрата(II) 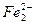 и выделением водорода.
и выделением водорода.
В неокислительных кислотах - соляной, разбавленной серной и др. коррозия железа происходит с водородной деполяризацией.
При повышении концентрации H2SO4 скорость коррозии железа сначала увеличивается и достигает максимума в 50% водном растворе, а затем уменьшается. В 70 ─ 100 %─ных растворах H2SO4 железо пассивируется и коррозия не происходит. На его поверхности образуется плотная плёнка сернокислого железа FeSO4.
В соляной кислоте при увеличении её концентрации скорость коррозии железа повышается. Следует отметить, что в растворе соляной кислоты скорость коррозии железа меньше, чем в растворе серной кислоты той же концентрации.
При повышении концентрации азотной кислоты скорость кор-розии железа сначала повышается, а затем уменьшается, и при содержании около 50 % HNO3 железо пассивируется.
Введение в раствор серной кислоты анионов Cl- , Br-, I- приводит к уменьшению скорости коррозии из-за их адсорбции на поверхности железа. При этом тормозятся катодный и анодный процессы.
Date: 2015-09-27; view: 2334; Нарушение авторских прав