
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Т с(окисл. )
|
|
еr = е0r + 2·10-4 · lg, где
Z С(восстан.)
е0r - нормальный редокс – потенциал системы, равный 0,36 В.
С(окисл.) – концентрация окисленной формы K3[Fe(CN)6];
С(восстан.) – концентрация восстановленной формы K4[Fe(CN)6]
z – число электронов, которое приобретает одна молекула окисленной формы при переходе в восстановленную.
По расчетным значениям также построить график зависимости в указанных координатах и сравнить две графические зависимости.
КИНЕТИКА
Учебно-целевые задачи:
§ Уметь описывать протекание реакций во времени с помощью кинетических кривых и уравнений.
§ Знать соотношения между основными понятиями кинетики: механизм реакции, скорость реакции, константа скорости реакции, энергия активации реакций.
§ Уметь прогнозировать влияние на скорость реакций концентрации реагентов, температуры.
§ Знать кинетические особенности сложных реакций.
ЗНАЧЕНИЕ ДЛЯ МЕДИЦИНЫ И ФАРМАЦИИ
Достаточно привести цитату Д.В.С. Холдена, чтобы понять значимость изучаемого материала для медицины «Ключ к познанию ферментов лежит в изучении скоростей реакций, а не равновесий.»
Действие лекарственных веществ обусловливается в значительной степени скоростью реакций,проходящих в организме.При хранении лекарственных препаратов могут протекать различные реакции, скорость которых определяется сроком годности лекарств.
Скорость химических процессов обычно увеличивается с ростом температуры, и это увеличение практически ничем не лимитируется, в то время как биологические процессы имеют температурные границы, за которыми наступает резкое уменьшение их скорости и даже полное прекращение - смерть. Знание законов кинетики позволяет управлять химическими процессами и продлевать жизнь.
ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К ЗАНЯТИЮ
1. Что называется скоростью химической реакции? В каких единицах выражается скорость химической реакции?
2. Может ли скорость быть отрицательной величиной? Что означает запись: 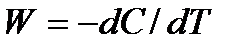 для реакции А→ В?
для реакции А→ В?
3. Как формулируется основной постулат химической кинетики? Какой физический смысл константы скорости реакции?
4. Что называется порядком реакции по веществу и общим кинетическим порядком реакции?
5. Может ли порядок реакции быть нулевым, дробным, отрицательным?
6. Что подразумевается под термином «псевдопорядок» реакции?
7. От каких факторов зависит порядок данный реакции?
8. Укажите размерность констант скоростей реакций нулевого, первого и второго порядков.
9. В чем различия понятий «порядок» и «молекулярность» химической реакции?
10. Может ли молекулярность быть больше или меньше порядка реакции? Для каких реакций порядок и молекулярность всегда совпадают?
11. Какими уравнениями описываются зависимости концентраций реагирующих веществ от времени в случае необратимых реакций первого и второго порядков?
12. Что называется периодом полураспада и как он зависит от начальной концентрации реагирующих веществ для реакций первого и второго порядков?
13. Какие методы определения порядка реакции вам известны и на чем они основаны?
14. Какие реакции называются сложными? Какие типы сложных реакций вам известны?
15. Исходя из каких положений определяют скорость сложной химической реакции?
16. В каком случае реакция кинетически обратима? Как записать в общем случае выражение для скорости обратимой реакции первого порядка типа A↔B?
17. Запишите химическое уравнение для мономолекулярных параллельных реакций типа
(к 1) 
A → B
(к 2)
A→C
18. Чему равно отношение констант скорости параллельных реакций первого порядка?
19. Нарисуйте кривые зависимости концентраций веществ А, В, С, от времени для параллельной необратимой реакции
(к 1)
А→В
(к 2) (к 1> к 2)
А→С
20. Какие реакции называются последовательными? Приведите примеры.
21. Какова функциональная зависимость изменения концентрации реагирующих веществ со временем в последовательной реакции А→В→С?
22. Изобразите графически изменение концентрации со временем участников последовательной реакции
(к 1) (к 2)
А → В → С
22. Какие реакции называются фотохимическими? Каким законам они подчиняются? Что такое квантовый выход? Почему он для некоторых реакций равен или меньше единицы, а для других он значительно больше единицы?
23. Каковы особенности гетерогенных реакций?
24. Как влияет температура на скорость химических реакций? Изменение каких величин надо рассматривать при этом?
25. Как формулируется правило Вант-Гоффа о температурной зависимости скорости реакции?
26. На основании каких соображений и кем была впервые получена количественная зависимость константы к = f (T)?
27. Каков физический смысл энергии активации?
28. В чем состоит гипотеза активных столкновений?
29. Что такое стерический фактор, чем обусловливается его возникновение?
30. На основании каких данных рассчитывается энергия активации химических реакций аналитически и графически?
31. В чем заключается основные положения теории переходного состояния (активированного комплекса)?
32. От каких факторов, согласно теории активированного комплекса, зависит стерический множитель?
Date: 2015-09-17; view: 850; Нарушение авторских прав