
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Результаты оценки точности новой температурной зависимости
|
|
Предложенный выше для расчетов экспериментальный материал охвативает практически весь температурный интервал, включает неорганические и органические вещества, отличающиеся не только элементным составом и строением, но и агрегатным состоянием. По этим данным находили оценки коэффициентов а, b, c, уравнения, связывающего упругость паров с температурой, обеспечивающие наименьшее остаточное, среднее квадратическое отклонение S.
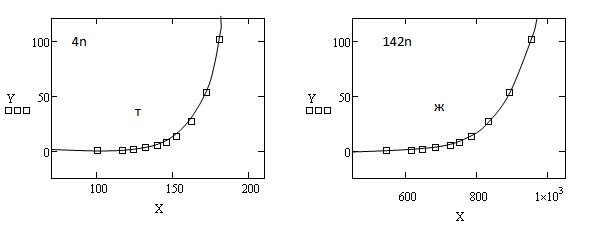
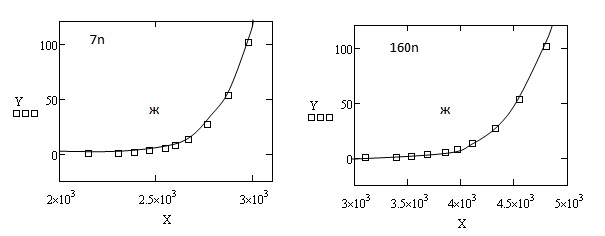
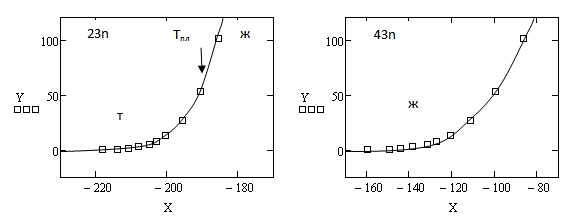
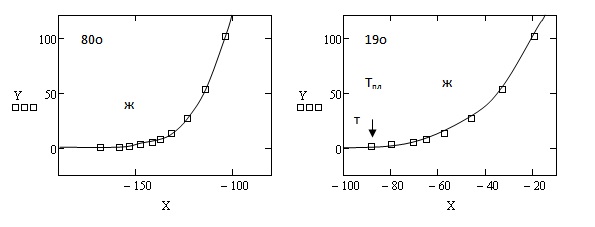
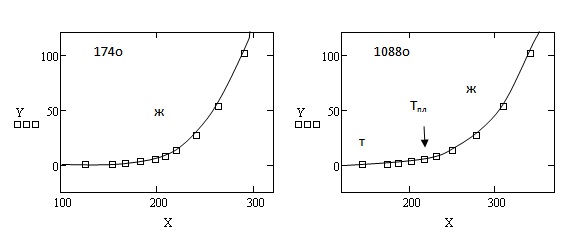
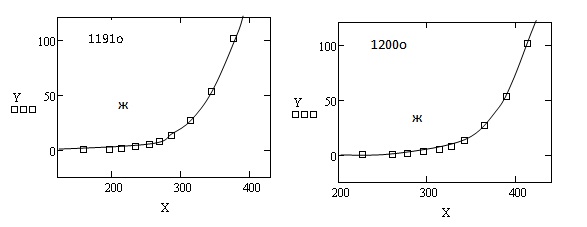
Полученные в ходе расчетов результаты представлены в виде графиков на рис. 1 и 2.
a = 6.233Е-006 b = 8.374Е+000 a = 1.173Е-015 b=6.098Е+000
c = -1.377Е-002 S=5.613Е-001 c = -1.924Е-002 S = 5.151Е-001 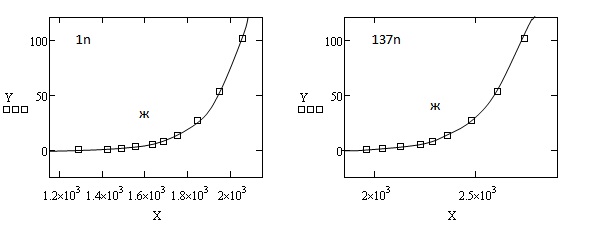 а= 1.04Е-015 b=2.387Е+001 b = -1.770Е-002 a = 1.051Е-015
а= 1.04Е-015 b=2.387Е+001 b = -1.770Е-002 a = 1.051Е-015
c = 1.614Е+001 S = 4.955Е-001 c = -1.683Е-002 S = 5.519Е-001
a = 1.11Е-015 b = -1.357Е-002 a = 1.009Е-015 b=3.903Е+001
c = 3.580Е+001 S = 3.885Е-001 c = -1.741Е-002 S = 8.229Е-001
а = 3,604Е+008 b = 2,111Е+001 a = 1,762Е+003 b = 4,438Е+001
c = - 4,738Е-002 S = 1,736Е+000 c = -1,618Е-001 S = 7,940Е-001
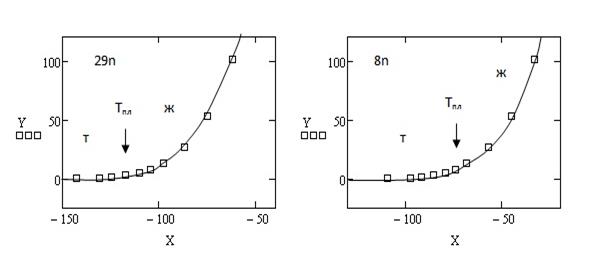
Таблица 2 - Парциальное давление и температура насыщеных паров неоргпнических веществ ( 101.325 кПа).
101.325 кПа).
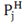 ,кПа ,кПа
| 23n | 43n | 29n | 8n | 2n | 3n | 4n | 142n | 1 n | 137n | 7n | 160n | 58n | 285n |
| 0.1333 | -218.2 | -159.7 | -142.6 | -109.1 | … | 81.3 | ||||||||
| 0,6666 | -213.9 | -149.5 | -130.8 | -97.5 | -52.2 | 103.8 | 116.4 | |||||||
| 1,3332 | -210.9 | -144.3 | -124.7 | -91.9 | -42.9 | 118.0 | 123.8 | |||||||
| 2,6664 | -207.9 | -138.5 | -117.7 | -85.8 | -32.5 | 134.0 | 131.8 | |||||||
| 5.3320 | -204.9 | -131.6 | -110.2 | -79.2 | -20.9 | 150.6 | 139.9 | |||||||
| 7.9990 | -202.9 | -127.2 | -104.8 | -74.3 | -13.4 | 161.7 | 145.4 | |||||||
| 13.3300 | -200.5 | -120.9 | -98.0 | -68.4 | -3.9 | 176.1 | 152.0 | |||||||
| 26.6600 | -195.6 | -111.2 | -87.2 | -57.0 | 11.2 | 199.8 | 161.8 | |||||||
| 53.3380 | -190.6 | -99.6 | -75.2 | -45.4 | 28.1 | 227.0 | 171.6 | |||||||
| 101.3250 | -185.6 | -86.5 | -62.1 | -33.6 | 45.9 | 256.3 | 180.2 |
а = 8,575Е+002 b = 3,875Е+001 a = 4,438Е+002 b = 2,623Е+001
с = - 1,557Е-001 S = 1,155Е-001 c = - 1,044Е-001 S = 4,877Е-001

а = 1,596Е+001 b = 2,127Е+001 a = 1,147Е-004 b = 1,171Е+000
c = - 7,675Е-002 S = 2,597Е-001 c = - 4,505Е-002 S =1,902Е-001
a = 1.122Е-015 b = 6.316Е+001 a = 1.136Е-015 b = 5.628Е+001
c = -1.252Е-002 S = 1.317Е+000 c = -1.612Е-002 S = 5.298Е-001
Рис. 1. Зависимость упругости паров неорганических веществ от температуры при 0  Р
Р  101.325 кПа
101.325 кПа
Результаты расчётов по данным для органических соединений приведены ниже.
a = 4.5Е+003 b = 4.466Е+001 a = 2.206Е+002 b = 2.738Е+001
c = -1.252Е-002 S = 1.317Е+000 c = -1.216Е-001 S = 2.640Е-001

a = 3.142Е+000 b = 1.607Е+001 a = 1.515Е-000 b = 1.413Е+001
c = -8.736Е-002 S = 4.712Е-001 c = -5.773Е-002 S = 1.824Е-0
a = 1.23Е-014 b = 1.438Е+000 a = 1.845Е-007 b = 5.306Е+000
|
a = 1.822Е-014 b = 1.975Е+000 a = 1.537Е-014 b = 3.280Е+000
c = -2.233Е-002 S = 3.931Е-001 c = -1.950Е-002 S = 3.734Е-001
Рисунок 2 - Зависимость упругости паров органических веществ от температуры
при 0  Р
Р  101.325 кПа
101.325 кПа
На рис. 1 и 2:
Т и Ж – твердое и жидкое состояния, соответственно;
Х – температура, 0С;
Y – давление, кПа;
Тпл – температура плавления, 0С.
Анализ полученных результатов показывает, что при Р  101,325 кПа:
101,325 кПа:
1.Уравнение (2) имеет закономерный характер во всей доступной для экспериментальных измерений области температур, общий для веществ разного элементного состава, химического строения, разных свойств и агрегатного состояния.
2. Остаточное среднее квадратическое отклонение S определяется величиной случайных ошибок1 экспериментальных измерений, приводящим к абсолютным значениям 0,10  S
S  0,65 кПа. Поетому значения давления паров в области PH
0,65 кПа. Поетому значения давления паров в области PH 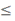 0,65 кПа следует считать мало надёжными.
0,65 кПа следует считать мало надёжными.
3. Для веществ с высокой и низкой температурой плавления значение коэффициента αj оказываются, соответственно исключительно малыми (αj 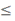 10-15) и очень большими (αj
10-15) и очень большими (αj 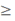 1010) и могут быть оценены только в расчётах с учётом большого числа знаков.
1010) и могут быть оценены только в расчётах с учётом большого числа знаков.
4. Закономерный характер уравнения (2) позволяет обнаружить в выборке опытных данных по давлениям насыщенных паров «грубые» измерения [ 7 ], связанные с ошибками определения температуры. Например корректировка температур углерода 45160С и 46600С в пределах 100С и 200С, соответственно, привела к уменьшению S в 5,41 раза.
Учитывая ограниченный объем статьи, ниже приводим результаты анализа данных из области PH 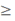 101.325 кПа только для 2-ух веществ (аргона и бензола),
101.325 кПа только для 2-ух веществ (аргона и бензола),

1 Систематические отклонения по данным из таблицы Сталла обнаружить нельзя, т. к. они не содержат результатов измерений упругости паров одного и того же вещества разными методами.
представляющих неорганические и органические вещества в температурных интервалах, соответственно, -185,6 0С 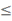 t
t 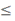 -124,9 0С и 80,10С
-124,9 0С и 80,10С  t
t  290,3 0С (см. табл.3).
290,3 0С (см. табл.3).
Таблица3 - Парцыальные давления насыщеных паров (в кПа) в зависимости от температуры (в 0С)
| № | Давление | Температура | ||
| (23n, 298n)2 | (420о, 1289о)2 | |||
| 0.1333 | -218.2 | -36.7 | ||
| 0.6666 | -213.9 | -19.6 | ||
| 1.3332 | -210.9 | -11.5 | ||
| 2.6664 | -207.9 | 2.6 | ||
| 5.3329 | -204.9 | 7.6 | ||
| 7.9993 | -202.9 | 15.4 | ||
| 13.3322 | -200.5 | 26.1 | ||
| 26.6645 | -195.6 | 42.2 | ||
| 53.3289 | -190.6 | 60.6 | ||
| 101.3250 | -185.6 | 80.1 | ||
| 202.6500 | -179.0 | 103.8 | ||
| 506.6250 | -166.7 | 144.5 | ||
| 1013.2500 | -154.9 | 178.8 | ||
| 2026.5000 | -141.3 | 221.5 | ||
| 3039.5730 | -132.0 | 249.5 | ||
| 4053.0000 | -124.9 | 272.3 | ||
| 5066.2500 | -120.0 | 290.3 | ||
| Плавление | 101.325 | -189.2 | 5.5 | |
| Критическая точка | 4263.60 Аргон | 5076.38 Бензол | -122.0 | 290.5 |
2Числа в скобках соответствуют номерам веществ в таблицах Сталла [ 3 ].
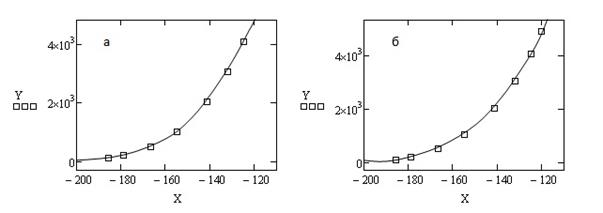
На рис. 3а представлена кривая, полученная по данным о давлении аргона с использованием уравнения (2).
Полагая, что критическая точка должна лежать на этой кривой, в число опытных данных включили соответствующие значения tкр и Ркр (см. табл. 3).
Результаты расчёта (S = 93,46 кПа) показали, что критические параметры определены с "грубыми" ошибками.
а = 6,901Е+004 b = 7,458Е+001 a = 6,863Е+004 b = 7,495Е+001
c = - 2,445Е-001 S = 1,117Е+001 c = -2,467Е-001 S = 9,909Е+000
Рисунок 3 - Зависимость упругости паров аргона от температуры (298n)
а) без критической точки
б) с критической точкой при tкр = -120 0С
Из уравнения (2) получили зависимость температуры от давления в виде:
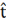 кр =
кр = 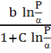 (10)
(10)
Подставив в (10) значения коэффициентов, приведенных на рис. 3а, получили  кр = 119.9967
кр = 119.9967 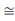 120 0С. При этом значении выборка, содержащая критическую точку, даёт результаты, приведенные на рис. 3б: увеличение tкр на 2 0С (-122 0С
120 0С. При этом значении выборка, содержащая критическую точку, даёт результаты, приведенные на рис. 3б: увеличение tкр на 2 0С (-122 0С  -120 0С) снижает остаточное квадратическое отклонение в 9,43 раза.
-120 0С) снижает остаточное квадратическое отклонение в 9,43 раза.
На рис. 4а приведены результаты экспериментальной оценки температурной зависимости давления паров бензола при PH 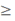 101.325 кПа. Кривая, полученная по (2), описывает эти данные с остаточным отклонением S = 11,4354 кПа.
101.325 кПа. Кривая, полученная по (2), описывает эти данные с остаточным отклонением S = 11,4354 кПа.
Используя (10) и значения коэффициентов, приведенные на рис. 4а, нашли, что при 
 5076,38 кПа критическая температура должна быть равной 290,62 0С.
5076,38 кПа критическая температура должна быть равной 290,62 0С.
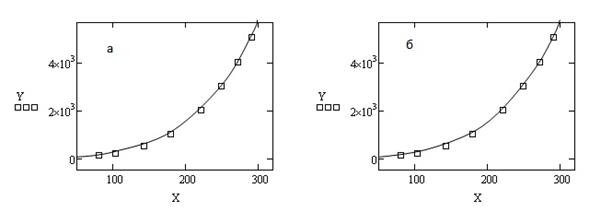
а = 6,134Е+000 b = 2,188Е+001 a = 6,213Е+000 b = 2,198Е+001
c = - 7,353Е-002 S = 1,143Е+001 c = -7,347Е-002 S = 1,060Е+001
Рисунок 4 - Зависимость упругости паров бензола от температуры (1298о)
а) без критической точки
б) с критической точкой
Практическое совпадение расчетного и экспериментального значений (t = 290,50 0С) говорит о том, что все использованные экспериментальные данные по бензолу соответствует теоретической зависимости (2) (см. рис. 4б).
Попытка оценить уравнение (2) на обобщённой выборке данных по бензолу (420о + 1289о + крит. точка) представлена на рис. 5. Видно, что объединение экспериментальных данных из разных температурных областей не увеличило остаточное квадратичное отклонение, что говорит об общем характере уравнения (2).
Вместе с тем, наблюдается резкое снижение оценки РН при t = 0 0С, которая приближается к значениям αj в интервале PH  101,325 кПа.
101,325 кПа.
Кроме того, относя квадратичное отклонение к абсолютным значениям давления на концах интервала, охватившего все данные, обнаруживаем экспоненциальные различия величин относительных отклонений (7500% и 0,20%, соответственно).
Оценку коэффициентов уравнение (2) целесообразно осуществлять по данным из относительно узких интервалов температуры и давления.
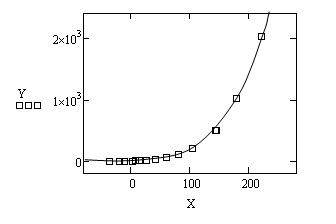
а = 3,753Е+000
b = 1,878Е+001
c = -7,404Е-002
S = 9,091Е+000
Рисунок 5 - Зависимость упругости паров бензола от температуры (420о + 1289о + Кр.точка)
ЛИТЕРАТУРА
1. Барский В.Д. Давление пара: новая зависимость давления от температуры / Барский В. Д., Кравченко А. В., Рудницкий А. Г., Гуревина Н. Л. // Вопросы химии и химической технологии. – 2013. - № 4. – с. 46 – 53.
2. Харлашин П. С. Вопросы современной металлургии / монография том III / Харлащин П. С., Гуляев В. М., Барский В. Д., Гладкий В. Н. – ГВУЗ "ПГТУ". – 2013. – 740 с.
3. Бретшнайдер Ст.. Свойства газов и жидкостей / Ст.Брегшнайдер. – М.: "Химия", 1966. – 536 с.
4. Бесков С. Д. Термохимические расчеты / Бесков С. Д. – М.: "Высшая школа", 1966. – 520 с.
5. Х. Кухлинг. Справочник по физике / Х. Кухлинг. – М.: "Мир", 1983. – 519 с.
6. Сталл Д. Р. Таблицы давления паров индивидуальных веществ / Сталл Д. Р. – М.: Изд – во Иностр. Лит – ры. – 1949. – 71 с.
7.Барский В.Д., Коган Л.А. Практический математико – статистический анализ в коксохимии / Барский В.Д., Когал Л.А. – М: "Металлургия".- 1975.-185с.
1)Рассчитать материальный баланс в процессе горения газовой смеси состава: объемная доля Н2=65%, объемная доля СН4=35%. На горение подается сухой воздух при температуре 35 ̊С и давлении Р=110 кПа с относительной влажностью Ψ=0,5. Поток горючего газа Wгг=7500 м3/час. Реакции горения идут со степенью превращения Хн2=0,85 и Хсн4=0,809. Смесь горючих газов с кислородом стехиометрическая. Определить состав продуктов горения во всех единицах измерения, полагая, что Z=1.
Н2+1/2О2=Н2О
СН4+О2=2Н2О+СО
Решение
1) Определяю потоки компонентов в газовой смеси
Wн2=Wгг*0,65=7500*0,65=4875 м3/час
Wсн4=Wгг*0,35=7500*0,35=2625 м3/час
2) Нахожу мольный объем
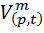 =
= 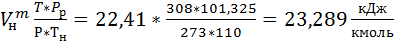
3) Определяю количество каждого компонента из поступающей газовой смеси
Wн2= 
Wсн4= 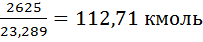
4) Составляю материальный баланс
Vi=Wa*Vi/Va*Xa
| Приход | Расход | |||||
| Расчёт | V, кмоль | q, % | Расчёт | V, кмоль | q, % | |
| Н2 | 1/1*209,33*0,85 | 177,93 | 231,3 | |||
| СН4 | 1/1*112,71*0,809 | 91,18 | 118,53 | |||
| О2 | (0,5/1*209,33*0,85 +2/1*112,71*0,809) *0,5 | 135,66 | 220,8 | |||
| N2 | 0,21/0,79*135,66 | 36,06 | 46,88 | |||
| H2O св | 177,93+182,36 | 360,29 | 468,38 | 177,93+182,36 | 360,29 | 468,38 |
| Н2О хр1 | 1/1*209,33*0,85 | 177,93 | 231,31 | |||
| Н2О хр2 | 2/1*112,71*0,809 | 182,36 | 237,1 | |||
| СО | 1/1*112,71*0,809 | 91,18 | 118,05 | |||
| Ʃ | ё | 801,12 | 811,76 |
δ= 
М(Н2)=2 кг/кмоль
М(О2)=32 кг/кмоль
М(Н2О)=18 кг/кмоль
М(СН4)=16 кг/кмоль
М(СО)= 28 кг/кмоль
М(N2)=28 кг/кмоль
5) Нахожу мольную долю компонента
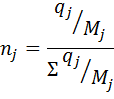
 =
= 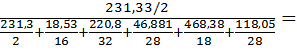 0.74
0.74
 =
=  =0.00748
=0.00748
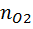 =
= 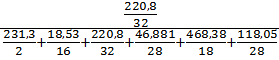 =0.044
=0.044
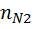 =
= 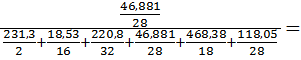 0.011
0.011
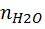 =
= 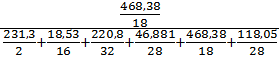 =0.168
=0.168
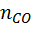 =
= 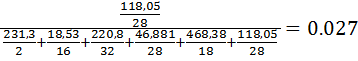
6) Объемная доля компонента при Z=1
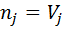
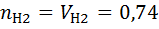
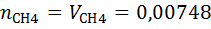
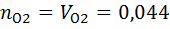
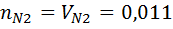

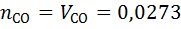
7) Нахожу мольно-объемную концентрацию компонента
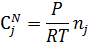
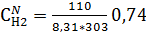 =0,032
=0,032 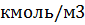
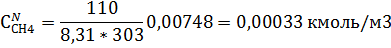
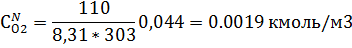
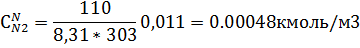

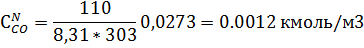
8) Нахожу мольно-объемную концентрацию компонента
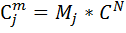

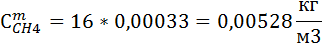
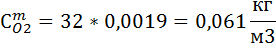
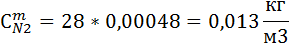
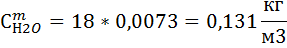
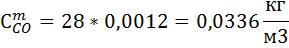
| H2 | CH4 | O2 | N2 | H2O | CO | |
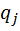
| 231,43 | 18,53 | 220,8 | 46,881 | 468,38 | 118,05 |
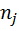
| 0.74 | 0.00748 | 0.044 | 0.011 | 0.168 | 0.0273 |
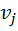
| 0.74 | 0.00748 | 0.044 | 0.011 | 0.168 | 0.0273 |
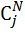
| 0.035 | 0.00033 | 0.0019 | 0.00048 | 0.0073 | 0.0012 |
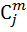
| 0.064 | 0.00528 | 0,061 | 0,013 | 0.131 | 0.0336 |
| а | 0,8* 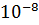
| 0,8* 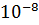
| 0,81* 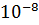
| 0,82* 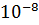
| 5,52 | 0,81* 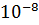
| 0,79* 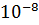
| 0,81* 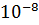
| 0,81* 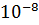
| 0,8* 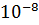
| 0.5796 | 0.7986 |
| в | 30,809 | 21,246 | 12.969 | 50,965 | 18,64 | 4,3620 | 4,108 | 4,294 | 4,678 | 149,154 | 16.183 | 14.861 |
| с | -0,0187 | -0,0247 | -0.555 | -0,021 | -0.0796 | -0,0321 | -0,0313 | -0.0296 | -0,031 | -0,134 | 0.0448 | -0.0581 |
| S | 1.651 | 1.0044 | 1.027 | 1,85 | 0,063 | 1,56 | 0,33 | 2.,3 | 1,089 | 1,688 | 1.6288 | 2.44 |
151. FeS
152. S
153. C
154. O2
155. CO2
156. IN
157. CH4
158. H2O
159. H2
160. N
289. Н2О
336. NO2
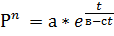
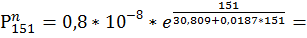 713*
713* 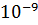 кПа
кПа
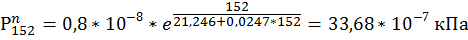
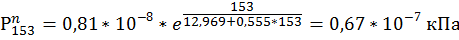
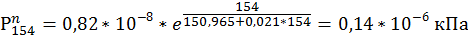
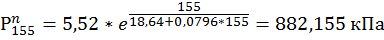
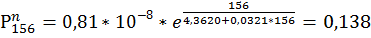 кПа
кПа
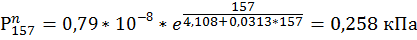
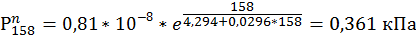
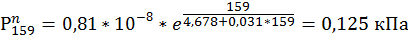


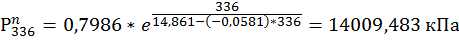
Date: 2015-09-17; view: 470; Нарушение авторских прав
