
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Состояние вещества
|
|
Современна химическая технология использует газообразные, твердые и жидкие материалы в качестве как исходные веществ, так и продуктов химических реакций и физико-химических превращений. Поэтому оборудование и режимы его работы должно определятся с учетом состояния вещества. Из за этого общие закономерности, определяющие различные состояния вещества рассматривают как теоретически, так и практически. Если частицы (молекулы) вещества находятся на очень большом расстоянии друг от друга, силы межмолекулярного взаимодействия практически себя не проявляют, так что молекулы могут двигается независимо друг от друга поступательно, по прямолинейным траекториям.
Взаимовлияние молекул проявляется только в следствии упругих столкновений, после которых поступательные, прямолинейные движений молекул осуществляется по новому направлению, поскольку столкновение происходит совершенно случайно, молекулы в любой момент равномерно заполняют объем, занимаемый веществом.
Это состояние вещества называется газообразным и его особенностью является то, что вещество в этом случае легко занимает любой объем и принимает форму любого сосуда. Говорят, что в газообразном состоянии вещество слабо сопротивляется изменению формы и объема (не затрачивается энергия).
Если молекулы вещества находятся на относительно небольших расстояниях друг от друга, начинают проявляться силы межмолекулярного взаимодействия. В связи с этим, молекулы теряют способность двигаться независимо друг от друга и удалятся одна от другой на большие расстояния. Это состояние называется жидким и характеризуется тем, что вещество легко принимает форму любого сосуда, но сильно сопротивляется изменению его объема.
Если молекулы вещества находятся очень близко друг к другу—силы взаимного отталкивания и притяжения уравновешивается, молекулы полностью теряют способность двигаться по прямолинейным траекториям, так что их движение сводится к колебаниям около некоторых точек в объеме вещества называются центрами кристаллической решётки. Это твердое состояние вещества. Важнейшей особенностью в котором является то, что вещество сильно сопротивляется не только изменению объема, но и формы.
Основным фактором, определяющим различные состояния вещества является расстояние между молекулами, в зависимости от которого реализуются силы межмолекулярного взаимодействия. По скольку расстояние и величина сил межмолекулярных взаимодействий являются величинами непрерывными, непрерывным оказывается и состояние вещества. Поэтому разделение на жидкое, твердое и газообразное является усредненным.
Наличие одного фактора, определяющего весь спектр возможных состояний вещества позволяет ожидать, что физико-химические параметры состояния этого вещества (t, P, V) должны быть связаны между собою. В наиболее общем виде эту связь представил Ван-дер-Ваальс уравнением вида:
(Р+ 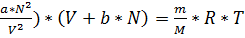 (1)
(1)
В формуле (1):
Р-внутренее давление, кПа
V- объем, занимаемый веществом, м3
m-масса вещества, кг
M-молекулярная масса вещества, кг/кмоль
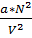 -давление, связанное с межмолекулярным взаимодействием
-давление, связанное с межмолекулярным взаимодействием
bN-суммарный собственный объем молекул, м3
Если молекулы находятся на очень большом расстоянии друг от друга, силами межмолекулярного взаимодействия можно пренебречь, так что
 (2)
(2)
Кроме того, в этом случае объем, занимаемый веществом становится несоизмеримо большим по отношению к суммарному собственному объему молекулы вещества. Это позволяет записать
b*N=0. (3)
Подставляя (2)и (3) в (1) получаем:
P*V=N*R*T (4)
По скольку (2) и (3) являются допущениями—уравнение (4) называют уравнением состояния вещества.
На практике, идеальным считают газ, который не конденсируется при охлаждении до очень низких температур. По отношению к этим температурам, нормальная температура достаточно высока, поэтому в нормальных условиях молекулы находятся на очень больших расстояниях друг от друга и их считают идеальными газами. При температурах и давлениях далеких от критических, практически все вещества обладают свойствами, близкими к идеальным, т.е. могут описываться уравнением (4).
В реальном производстве такие условия сегодня встречаются не часто и поэтому приходится работать с уравнением (1)и вводить понятие пара-вещества. Пар может быть ненасыщенным насыщенным. Ненасыщенный пар образуется, когда жидкости недостаточно чтобы вещество оказалось в состоянии равновесия между жидкостью и паром при анной температуре.
Насыщенный образуется тогда, когда жидкости достаточно для установления равновесий между жидким и газообразным состоянием вещества.
Содержание j-вещества в насыщенном состоянии равно парциальному давлению j-вещества в состоянии насыщения (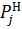 ).
).
Фактически парциальное давление j-компонента:
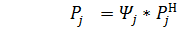 (5)
(5)
 -относительное содержание этого компонента в газовой фазе.
-относительное содержание этого компонента в газовой фазе.
Благодаря зависимости 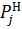 от Т значения парциального давления основном табулированы.
от Т значения парциального давления основном табулированы.
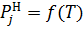 (6)
(6)
Потоки компонентов и реакционных смесей
Поток—это совокупность элементов некоторой субстанции, перемещающийся в пространстве с постоянной или переменной скоростью, в зависимости от физической природы этой субстанции. Любой вещественный поток несет на себе энергию и называется техническим потоком.
Технические потоки характеризуют величину компонентным составом тепло-физическими и физико-химическими свойствами. Обычно в производстве вещественного технологического потока задают единицами измерения объема жидкости или газа, проходящего через сечение трубопровода, аппарата или реактора за определенное время.
Для потоков твердых веществ чаще используют единицы массы, отнесенные ко времени. Из за необходимости использования в расчетах ХТП химических реакций массовые объемные потоки приходится переводить в мольные. Все величины потоков совпадают со скоростью этих потоков.
Будем различать качественный и количественный состав реакционной смеси. Качественный состав задается перечислениями названий компонентов. Количественно компонентный состав потока задается в абсолютных и относительных единицах измерения.
Величины потоков
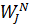 -мольный поток j-вещества, кмоль/час
-мольный поток j-вещества, кмоль/час
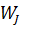 -объемный поток j-вещества, м3/час
-объемный поток j-вещества, м3/час
 -массовый поток j-вещества, кг/час.
-массовый поток j-вещества, кг/час.
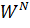 -суммарный мольный поток j-вещества, кмоль/час
-суммарный мольный поток j-вещества, кмоль/час
 -суммарный объемный поток j-вещества, м3/час
-суммарный объемный поток j-вещества, м3/час
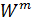 -суммарный массовый поток j-вещества, кг/час.
-суммарный массовый поток j-вещества, кг/час.
Относительный состав суммарного потока
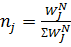 мольная доля j-компонента.
мольная доля j-компонента.
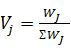 объемная доля j-компонента.
объемная доля j-компонента.
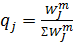 массовая доля j-компонента.
массовая доля j-компонента.
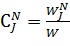 мольно-объемная концентрация j-компонента
мольно-объемная концентрация j-компонента
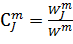 массово-объемная концентрация j-компонента
массово-объемная концентрация j-компонента
По скольку выше приведенный формулы описывают один и тот же состав, очевидно что между ними должна наблюдатся связь. Эта связь должна учитывать состояние вещества, т.е. учитывать уравнение состояния. Ситуация осложняется тем, что в реальных условиях мы можем иметь дело как с идеальною, так и с реальною системою, т.е. использовать уравнение (4).
Видно, что уравнение (1) требует знание величин а, б и кроме того оно представляет собою уравнение 3й степени по V. Для упрощения задачи заменяем в (1) давление, связанное с межмолекулярным взаимодействием и суммарный собственный объем молекул величиной  —коэффициент сжимаемости j-компонента.
—коэффициент сжимаемости j-компонента.
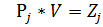 *N*R*T (7)
*N*R*T (7)
Вычисление коэффициента сжимаемости
Коэффициент сжимаемости определяется с использованием специального для каждого вещества значений критической температуры и критического давления, которым соответствует значение критического объема.
Алгоритм определения коэффициента сжимаемости
1. По таблице 2 находим критические значения Ткр и Ркр
2. Используя фактические температуру и давление и найденные критические параметры, находим приведенные температуру и давление

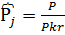
3. По диакраммам по найденным приведенным температуре и давлению находим 
Содержание паров в паро-газовых потоках
На поверхности жидких и твердых веществ всегда присутствуют пары этих веществ. Для определения количества этого пара используем систему уравнений для двухкомпонентной смеси
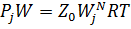
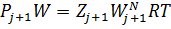
Разделив эти уравнения сторонами легко получаем уравнение (1) из которого (2)
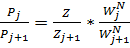 (1)
(1)
 (2)
(2)
Из уравнения (2) следует, что отношение мольных потоков компонентов парогазовой смеси прямо пропорционально отношению их парциальных давлений и обратно пропорционально отношению их коэффициентов сжимаемости.
 (3)
(3)

 (4)
(4)
Выражение (3) и (4) позволяют по известному мольному потоку одного компонента смеси определить величину потока второго компонента.
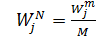 (5)
(5)
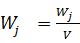 (6)
(6)
На практике задают не мольные, а объемные и массовые потоки, а объемные или массовые потоки, поэтому приходится переводить в мольные потоки и массовые по формуле (5).
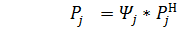 (7)
(7)
Коэффициент сжимаемости, входящий (3) и (4) находим по приведенному ранее алгоритму.
При оценке парциальных давлений, учитываем что, фактическое парциальное давление j-компонента находим по формуле (7). Парциальное давление 2го компонента находим используя условие
 (8)
(8)
С учетом (7) получаем (9)
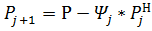 (9)
(9)
Подставляем (5), (6), (7), (9) в (3) и (4) получаем рабочее уравнение для расчета величины объемного или массового потоков компонентов, при этом 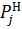 —парциальное давление компонентов в состоянии насыщения. Определяется как функция температуры процесса.
—парциальное давление компонентов в состоянии насыщения. Определяется как функция температуры процесса.

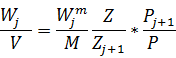
Задача 1.1
Смешиваются потоки О2 и N2 с 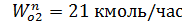 и
и  . Температура 100 К и давление 48800 кПа. Определить состав смеси во всех единицах измерения и представить результаты в виде таблицы.
. Температура 100 К и давление 48800 кПа. Определить состав смеси во всех единицах измерения и представить результаты в виде таблицы.
Задача 1.2
В условиях задачи 1.1 считать что 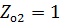
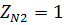
Решение
Для реального газа
1) Мольная доля
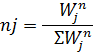

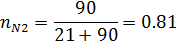
2) Коэффициент сжимаемости





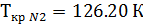
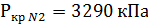
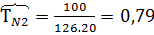

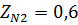
3) Объемная доля

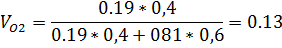

4) Массовая доля



5) Мольно-объемная концентрация


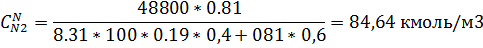
6) Массово-объемная концентрация


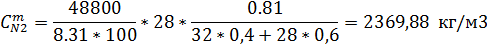
Идеальный газ
7) Мольная доля
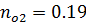
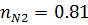
8) Объемная доля


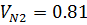
9) Массовая доля
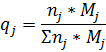


10) Мольно-объемная концентрация
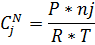
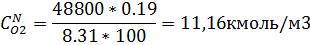
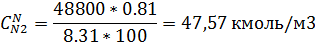
11) Массово-объемная концентрация
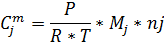

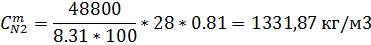
| O2 | N2 | |||
| Р. Г. | И. Г. | Р. Г. | И. Г. | |
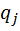
| 0,21 | 0,79 | 0,21 | 0,79 |
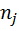
| 0,19 | 0,19 | 0,81 | 0,81 |
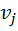
| 0,19 | 0,19 | 0,81 | 0,81 |
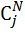
| 19,85 | 11,16 | 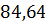
| 47,57 |
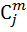
| 
| 357,87 | 2369,88 | 1331,87 |
Задача 2.1
Смешиваются паро-газовые потоки бензола и толуола с 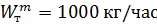 и
и  кг/час. В системе Т=828 К и Р=38620 кПа. Определить состав смеси во всех единицах измерения и результаты представить в табличном виде.
кг/час. В системе Т=828 К и Р=38620 кПа. Определить состав смеси во всех единицах измерения и результаты представить в табличном виде.
2.2 В условиях задачи 2.1 считать что 
Решение
Для реального газа
1) Массовая доля
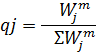
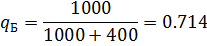
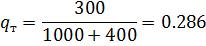
2) Коэффициент сжимаемости
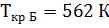
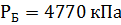
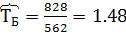

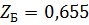


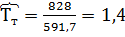

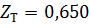
3) Мольная доля
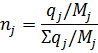
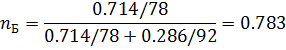
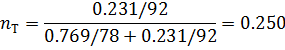
4) Объемная доля

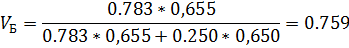
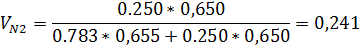
5) Мольно-объемная концентрация

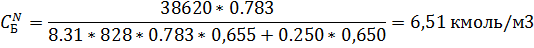

6) Массово-объемная концентрация

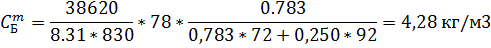

Идеальный газ
7) Массовая доля
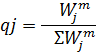
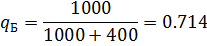
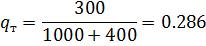
8) Мольная доля
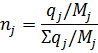
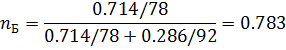

9) Объемная доля

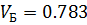
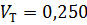
10) Мольно-объемная концентрация
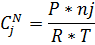
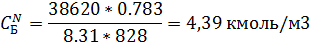
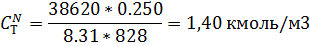
11) Массово-объемная концентрация
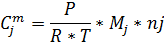
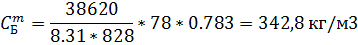

| Бензол | Толуол | |||
| Р. Г. | И. Г. | Р. Г. | И. Г. | |
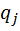
| 0,714 | 0,714 | 0,286 | 0,286 |
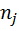
| 0,783 | 0,783 | 0,250 | 0,250 |
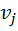
| 0,759 | 0,783 | 0,271 | 0,250 |
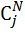
| 6,51 | 4,39 | 2,08 | 1,40 |
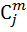
| 4,28 | 342,8 | 1.63 | 129,09 |
Задача 3.1
Смешиваются объемные потоки Н2, СН4, СО2, Н2S с 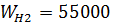 м3/час,
м3/час, 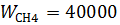 м3/час,
м3/час, 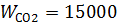 м3/час,
м3/час, 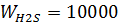 м3/час. В системе Т=772 К и Р=49900 кПа. Определить состав смеси во всех единицах измерения и результаты представить в табличном виде.
м3/час. В системе Т=772 К и Р=49900 кПа. Определить состав смеси во всех единицах измерения и результаты представить в табличном виде.
Задача 3.2
В условиях задачи 3.1 считать что 
Для реального газа
1) Объемная доля

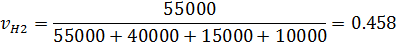



2) Коэффициент сжимаемости
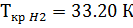



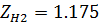
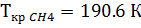
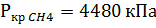
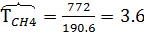
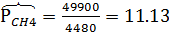
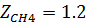

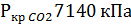
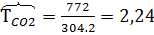
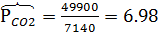



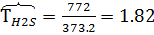


3) Мольная доля

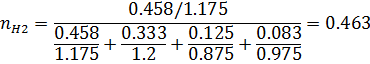

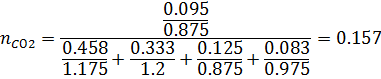

4) Массовая доля

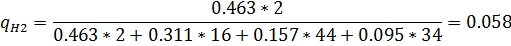
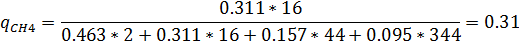
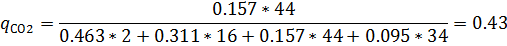

5) Мольно-объемная концентрация

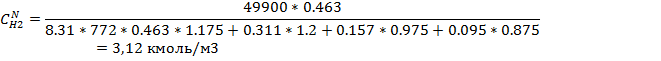



6) Массово-объемная концентрация




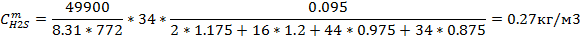
Идеальный газ
7) Объемная доля

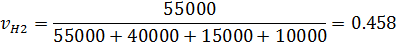



8) Мольная доля

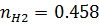
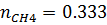
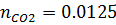
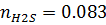
9) Массовая доля

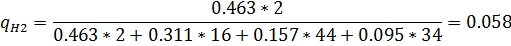
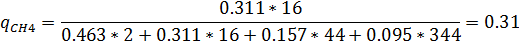
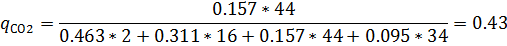

Мольно-объемная концентрация
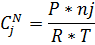
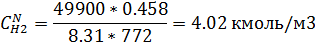


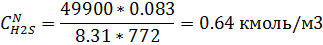
10) Массово-объемная концентрация
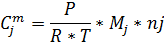


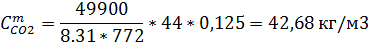
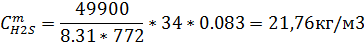
| H2 | CH4 | CO2 | H2S | |||||
| Р. Г. | И.Г. | Р. Г. | И. Г. | Р.Г. | И. Г. | Р. Г. | И. Г. | |
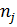
| 0,463 | 0,458 | 0,311 | 0,333 | 0,157 | 0,125 | 0,095 | 0,083 |

| 0,458 | 0,458 | 0,333 | 0,333 | 0,125 | 0,125 | 0,083 | 0,083 |
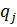
| 0,058 | 0,062 | 0,31 | 0,31 | 0,43 | 0,43 | 0,2 | 0,2 |
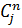
| 3.12 | 4.02 | 2.098 | 2,59 | 1,06 | 0,97 | 0,641 | 0,64 |
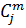
| 0,076 | 70.99 | 0,14 | 41,44 | 1,13 | 42,68 | 0,27 | 21,76 |
Задача 4.1
Поток смеси характеризуется составом  кмоль/м3 и
кмоль/м3 и  кмоль/м3. Т=1600 К и Р=48800 кПа. Определить состав смеси во всех единицах измерения.
кмоль/м3. Т=1600 К и Р=48800 кПа. Определить состав смеси во всех единицах измерения.
Задача 4.2
В условиях задачи 4.1 считать что 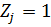
Для реального газа
1) Мольная доля
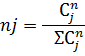
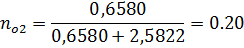

2) Коэффициент сжимаемости




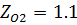
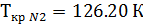
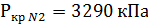
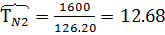

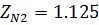
3) Объемная доля

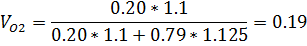
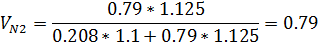
4) Массовая доля
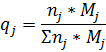
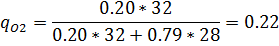
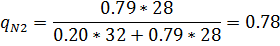
5) Массово-объемная концентрация


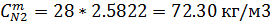
Идеальный газ
6) Мольная доля
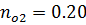
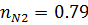
7) Объемная доля
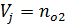
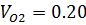

8) Массовая доля
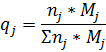
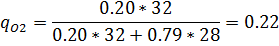
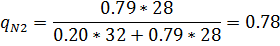
9) Массово-объемная концентрация
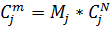
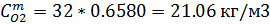
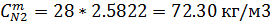
| O2 | N2 | |||
| Р. Г. | И. Г. | Р. Г. | И. Г. | |
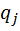
| 0,22 | 0,22 | 0,78 | 0,78 |
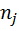
| 0,20 | 0,20 | 0,79 | 0,79 |
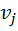
| 0,19 | 0,20 | 0,79 | 0,79 |
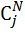
| 0,6580 | 0,6580 | 2,5882 | 2,5882 |
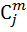
| 21.06 | 21.06 | 72.30 | 72.30 |
Задача 5.1
Поток смеси характеризуется составом 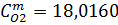 кг/м3 и
кг/м3 и 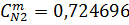 кг/м3. Т=1600 К и Р=48800 кПа. Определить состав смеси.
кг/м3. Т=1600 К и Р=48800 кПа. Определить состав смеси.
Задача 5.2
В условиях задачи 5.1 считать что 
Для реального газа
1) Мaccовая доля
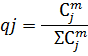


2) Коэффициент сжимаемости




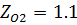
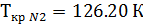
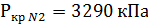
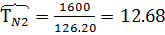

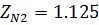
3) Мольная доля
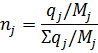
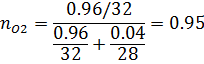

4) Объёмная доля

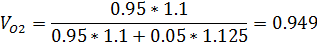

5) Мольно-объемная концентрация



Идеальный газ
6) Мольно-объемная концентрация



7) Мaccовая доля
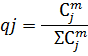


8) Мольная доля
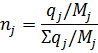
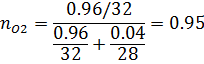

9) Объемная доля
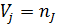
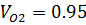
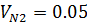
| O2 | N2 | |||
| Р. Г. | И. Г. | Р. Г. | И. Г. | |
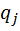
| 0,96 | 0,96 | 0,04 | 0, 04 |
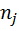
| 0,95 | 0,95 | 0,05 | 0,05 |
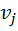
| 0,949 | 0,95 | 0,051 | 0,05 |
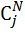
| 0,563 | 0,563 | 25,88 | 25,88 |
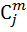
| 18.016 | 18.016 | 0,724696 | 0,724696 |
Задача 6.1
Найти объем 1 кмоля О2 и 1 кмоля N2 при Р=48800 кПа и Т=1600К
Решение
Р* 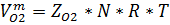
Коэффициент сжимаемости


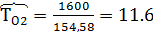

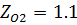
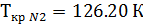
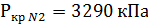
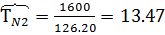
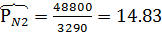



Задача 6.2
Найти объем 1 кмоля О2 и 1 кмоля N2 в нормальных условиях
Решение


Задача 7.1
Определить величину потока сухого воздуха, необходимого для испарения 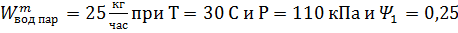 ,
, 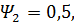
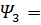 0,75,
0,75, 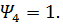 Результаты представить в виде графика
Результаты представить в виде графика
Решение
а=0,7986 в=14,8589 с=-0,05806
1) Нахожу давление смеси в состоянии насыщения
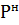 =а*
=а* 
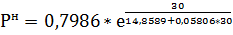 =4,866 кПа
=4,866 кПа
2) Нахожу мольный объем
 =22,41*
=22,41* 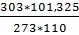 =29,91 кДж/кмоль
=29,91 кДж/кмоль
3) Нахожу молярню масу потока смеси воздуха
М=0,21*32+0,79*28=29,324 кг/кмоль
4) 
W= 
Пусть 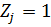 , тогда
, тогда
W= 
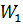 =
= 
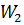 =
= 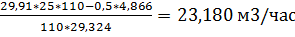
 =
= 
 =
= 
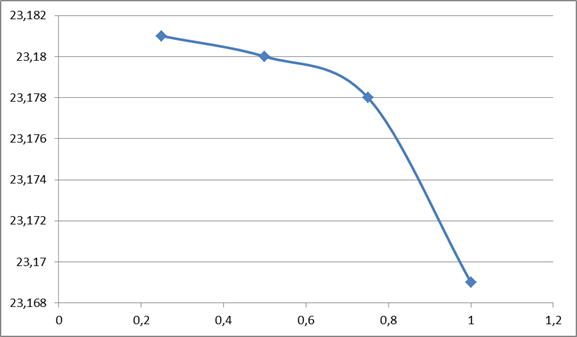
Задача 7.2
Определить массовый поток воды, которая придет в виде пара с объемным потоком сухого воздуха W=20000 м3/час при Т=30 С и Р=110 кПа и относительной влажности 0,5
Решение
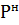 =а*
=а* 
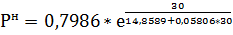 =4,866 кПа
=4,866 кПа
 =22,41*
=22,41* 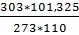 =29,91 кДж/кмоль
=29,91 кДж/кмоль
М=0,21*32+0,79*28=29,324 кг/кмоль
 =
= 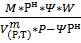 =
= 
Date: 2015-09-17; view: 585; Нарушение авторских прав