
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Органические вещества
|
|
Органические соединения составляют в среднем 20–30 % массы клетки живого организма. К ним относятся биологические полимеры — белки, нуклеиновые кислоты и полисахариды, а также жиры и ряд низкомолекулярных органических веществ — аминокислоты, простые сахара, нуклеотиды и т.д. Различные типы клеток содержат разное количество органических соединений. Так, растительные клетки богаты углеводами, а животные — белками (40–50 % в животной, 20–35 % в растительной). Каждая из групп органических веществ в клетках любого типа выполняет сходные функции.
Белки
Из органических веществ клетки по количеству и значению на первом месте стоят белки. Белки, или протеины (от греч. протос — первый, главный), — высокомолекулярные органические вещества, характеризующиеся строго определенным элементарным составом и распадающиеся при гидролизе до аминокислот.
В состав белков входят (в %): углерод — 50-55, водород -6,5-7,3, азот — 15-18, кислород — 21-24, сера — до 2,4 и зола — до 5,5. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: молекулярная масса альбумина (одного из белков яйца) — 36000, гемоглобина — 152000, миозина (одного из белков мышц) — 500000. Один из белков — глобулин молока — имеет молекулярную массу 42000. Его формула С1864Н3012О576N468S21. Существуют белки, молекулярная масса которых в 10 и даже в 100 раз больше. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
| Аминокислотный состав белков |
Белки являются полимерами, то есть состоят из нескольких структурных единиц — мономеров. Белки представляют собой непериодичные полимеры, мономерами которых являются аминокислоты.
В клетках и тканях обнаружено свыше 170 различных аминокислот, но в состав белков входит лишь 26. Причем 6 из них являются нестандартными. Они образуются в результате модификации стандартных аминокислот уже после их включения в полипептидную цепь. Поэтому обычными компонентами белков можно считать лишь 20 аминокислот.
В зависимости от того, могут ли аминокислоты синтезироваться в организме, различают:
© заменимые аминокислоты — десять аминокислот, синтезируемых в организме;
© незаменимые аминокислоты — аминокислоты, которые в организме не синтезируются.
Растения способны синтезировать все необходимые им аминокислоты, а животные же — лишь половину. Незаменимые аминокислоты должны поступать в организм вместе с пищей.
В зависимости от аминокислотного состава, белки бывают:
© полноценными, если содержат весь набор аминокислот;
© неполноценными, если какие-то аминокислоты в их составе отсутствуют.
Основная масса аминокислот, входящих в состав молекулы белка, яв-
|
В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают:
© нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу;
© основные аминокислоты, имеющие более одной аминогруппы;
© кислые аминокислоты, имеющие более одной карбоксильной группы.
Свойства аминокислот зависят не столько от количества аминогрупп и карбоксильных групп, сколько от их радикалов. Радикалы могут быть простыми и сложными, небольшими по размерам и громоздкими, гидрофильными и гидрофобными, химически инертными и высокоактивными, полярными и неполярными, заряженными положительно и отрицательно и т.д. Особенности радикалов, их число и расположение оказывают существенное влияние на структуру, химические и физические свойства полипептидов.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах. Это зависит от рН раствора и от того, какая аминокислота: нейтральная, кислая или основная.
| Пептиды |
Пептиды — органические вещества, состоящие из остатков аминокислот[10], соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот (рис. 256). При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой, между ними возникает ковалентная азот-углеродная связь, которую называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пепти-
|
На одном конце молекулы находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).
В широком смысле пептиды и белки — одно и то же. В более узком
— пептидами называют олигопептиды, содержащие до 10 остатков аминокислот, белками же называют полипептиды, состоящие из более чем 10 остатков.
| Структура белковой молекулы |
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул. Кроме того, клетке энергетически невыгодно держать белки в развернутой форме — в виде цепочки. Поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Образование компактных конформаций возможно благодаря возникновению внутримолекулярных и межмолекулярных связей (прежде всего водородных), возникающих между различными группировками аминокислотных остатков полипептидных цепей, а также в результате гидрофобных взаимодействий между неполярными радикалами. Выделяют 4 уровня пространственной организации белков (рис. 257).
| Первичная структура |
Под первичной структурой белка понимают последовательность расположения аминокислотных остатков в одной или нескольких полипептидных цепях, составляющих молекулу белка.
Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин. Исследования проводились в Кембриджском университете Ф.Сэнгером с 1944 по 1954 год. Было выявлено, что молекула инсулина состоит из двух полипептидных цепей (21 и 30 аминокислотных остатков), удерживаемых около друг друга дисульфидными мостиками. За свой кропотливый труд Ф.Сэнгер был удостоен Нобелевской премии.
|
|
| Вторичная структура |
Лишь незначительное количество белков имеет строго линейную структуру. Основная масса белков подвергается дальнейшей укладке, что приводит к образованию вторичной структуры белковой молекулы.
Вторичной структурой называют упорядоченное свертывание полипептидной цепи. Основным вариантом вторичной структуры является a-спираль, имеющая вид растянутой пружины. Она образована одной полипептидной цепью в результате возникновения внутримолекулярных водородных связей между
карбоксильными группами и аминогруппами, расположенными на соседних витках спирали (рис. 258). Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость.
| Третичная структура |
Большинство полипептидных цепей приобретает вид компактной глобулы. Третичная структура — это способ укладки полипептидных цепей глобулярных белков, возникающий в результате образования изгибов, приводящих к наложению одних участков спирали на другие, и определенных взаимодействий между этими участками. При образовании третичной структуры происходит сшивание участков в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между боковыми цепями аминокислотных остатков.
|
У некоторых белков третичная структура стабилизируется ди-
сульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. Третичная структура специфична для каждого белка.
| Четвертичная структура |
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. В одних белках субъединицы одинаковы или имеют сходное строение, в других различны. Однако они всегда образуют единое целое и располагаются в молекуле симметрично.
Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи.
Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя a-субъединицами (141 аминокислотный остаток) и двумя b-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
| Классификация белков |
Обычно белки классифицируют по отдельно взятым признакам.
По химическому составу различают:
© простые — белки, состоящие только из аминокислот (фибрин, трипсин);
© сложные — белки, содержащие помимо аминокислот еще и небелковую — простетическую группу, которая может быть представлена ионами металлов (металлопротеины — гемоглобин), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
По форме молекулы различают:
© Глобулярные — белки, имеющие сферическую форму — форму компактной глобулы (инсулин, белки крови, ферменты). Для них наиболее важна третичная структура. Хорошо растворимы в воде, в разбавленных водных растворах кислот, оснований и солей.
© Фибриллярные — белки, имеющие вытянутую форму молекул, обычно собранных в пучки, образующие волокна (кератин ногтей, волос, перьев, паутины, шелка, коллаген сухожилий). Для них наиболее важна вторичная структура. Нерастворимы в воде. Отличаются большой механической прочностью.
| Денатурация и ренатурация белков |
Внешние факторы (изменение температуры, солевого состава среды, рН, радиация) могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией (рис. 260). Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Причем первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Вместе с тем, денатурация не сопровождается разрушением полипептидной цепи. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций.
|
Денатурация может быть:
© Обратимой, если возможно восстановление свойственной белку структуры. Такой денатурации подвергаются, например, рецепторные белки мембраны.
© Необратимой, если восстановление пространственной конфигурации белка невозможно. Обычно это происходит при разрыве большого количества связей, например, при варке яиц.
Если белок подвергся обратимой денатурации, то при восстановлении нормальных условий среды он способен полностью восстановить свою структуру и, соответственно, свои свойства и функции. Процесс восстановления структуры белка после денатурации называется ренатурацией.
| Функции белков |
Благодаря сложности, разнообразию форм и состава, белки играют важную роль в жизнедеятельности клетки и организма в целом. Функции их разнообразны.
| Строительная (структурная) функция |
Одна из важнейших — строительная. Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран, шерсти, волос, сухожилий, стенок сосудов и т.д.
| Транспортная функция |
Некоторые белки способны присоединять различные вещества и переносить их к различным тканям и органам тела, из одного места клетки в другое. Например, белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно.
| Регуляторная функция |
Большая группа белков организма принимает участие в регуляции процессов обмена веществ. Такими белками являются гормоны — биологически активные вещества, выделяющиеся в кровь железами внутренней секреции. Они влияют на активность ферментов, тем самым, замедляя или ускоряя обменные процессы, изменяют проницаемость клеточных мембран, поддерживают постоянство концентрации веществ в крови и клетках, участвуют в процессах роста, размножения и т.д. Например, гормон инсулин регулирует уровень сахара в крови путем повышения проницаемости клеточных мембран для глюкозы, способствует синтезу гликогена, увеличивает образование жиров из углеводов.
| Защитная функция |
В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Синтез этих белков, называемых иммуноглобулинами, происходит в лимфоцитах. Причем, практически на любой антиген, с которым клетка и организм никогда не встречались, лимфоциты способны синтезировать антитела. Фибрин, образующийся из фибриногена, способствует остановке кровотечений.
| Двигательная функция |
Особые сократительные белки участвуют во всех видах движения клетки и организма: образовании псевдоподий, мерцании ресничек и биении жгутиков у простейших, сокращении мышц у многоклеточных животных, движении листьев у растений и др.
| Сигнальная функция |
Весьма важна для жизни клетки сигнальная функция белков. В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача команд в клетку.
| Запасающая функция |
Благодаря белкам в организме могут откладываться про запас некоторые вещества. Например, при распаде гемоглобина железо не выводится из организма, а сохраняется в селезенке, образуя комплекс с белком ферритином. К запасным белкам относятся белки яйца, белки молока.
| Энергетическая функция |
Белки являются одним из источников энергии в клетке. При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются тогда, когда другие (углеводы и жиры) израсходованы.
| Каталитическая функция |
Одна из важнейших функций белков. В состав клеток входит большое количество веществ, химически мало активных. Тем не менее, все биохимические реакции протекают с огромной скоростью, благодаря участию в них биокатализаторов — ферментов — веществ белковой природы.
| Общая характеристика ферментов |
Как отмечалось ранее, большинство химических реакций в организме протекает с участием катализаторов — ферментов. Ферменты [11] — специфические белки, присутствующие во всех живых клетках и играющие роль биологических катализаторов.
Сходство ферментов и неорганических катализаторов заключается в том, что они:
© снижают энергию активации[12];
© не изменяют направления реакции, а лишь изменяют скорость ее протекания;
© в катализируемой реакции всегда затрачивается меньше энергии, чем в некатализируемой.
Но, поскольку ферменты являются белками, это придает им особые свойства:
© если неорганический катализатор может использоваться в разных типах реакций, то ферменты катализируют только одну реакцию или один вид реакции;
© большинство неорганических катализаторов ускоряют химические реакции при очень высоких температурах, имеют максимальную эффективность в сильнокислой или сильнощелочной среде, при высоких давлениях, а большинство ферментов активны при температурах 35-45˚С, физиологических значениях кислотности раствора и при нормальном атмосферном давлении;
© скорость ферментативных реакций в десятки тысяч (а иногда и в миллионы раз) выше скорости реакций, идущих с участием неорганических катализаторов. Например, пероксид водорода без катализаторов разлагается медленно: 2Н202 → 2Н20 + 02. В присутствии солей железа (катализатора) эта реакция идет несколько быстрее. Фермент каталаза за 1 сек. расщепляет 100 тыс. молекул Н202.
Известно более 2000 различных ферментов, представленных белками с высокой молекулярной массой, например каталаза (М=252000).
| Строение ферментов |
Несмотря на большое количество и разнообразие ферментов, все их по особенностям строения молекул можно разделить на две группы:
©
|
© двухкомпонентные — сложные белки.
У двухкомпонентных ферментов, помимо белковой части, имеется добавочная группа небелковой природы — кофактор, например многие витамины.
В молекуле ферментов выделяют особую часть, представляющую собой уникальное сочетание нескольких аминокислотных остатков, располагающихся в определенной части белковой молекулы. Ее называют активным центром фермента. Именно эта часть фермента вступает в контакт с субстратом. Поскольку аминокислотные остатки, образующие каталитический центр, расположены в различных участках полипептидной цепи, он возникает только тогда, когда белковая молекула приобретает характерную для нее третич-
ную структуру (рис. 261). Если под влиянием каких-либо факторов происходит изменение третичной структуры фермента, то, как правило, это приводит к деформации каталитического центра и изменению ферментативной активности.
| Свойства ферментов |
Ферменты как биологические катализаторы белковой природы обладают рядом важных свойств:
© все ферменты — глобулярные белки;
© ферменты обладают строгой специфичностью, каждый фермент катализирует только одну реакцию (или тип реакции);
© высокая активность, обеспечивающая протекание ферментативных реакций с большой скоростью;
© активность ферментов зависит от условий, в которых протекает реакция.
| Механизм действия ферментов |
Ферментативные реакции протекают в несколько этапов:
© На первом этапе происходит образование фермент-субстратного комплекса за счет возникновения связей субстратного центра фермента с субстратом (или субстратами).
|
В 1959 году Д. Кошланд выдвинул гипотезу,
по которой пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу называют гипотезой "руки и перчатки" (гипотезой индуцированного соответствия) (рис. 262).
© На следующем этапе происходит сама химическая реакция и образуется продукт (продукты) этой реакции.
© На конечном этапе фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции.
Поскольку все ферменты являются белками, их активность наиболее высока при физиологически нормальных условиях:
© Большинство ферментов наиболее активно работает только при определенной температуре. При повышении температуры до некоторого значения (в среднем до 5О°С) каталитическая активность растет (на каждые 10°С скорость реакции повышается примерно в 2 раза). При температуре выше 50°С белок подвергается денатурации и активность фермента падает.
© Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность.
| Фермент | Характер катализируемой реакции | рН |
| Пепсин | Гидролиз белка | 1,5-2,5 |
| Липаза | Гидролиз жиров | 4,7-5,0 |
Большинство ферментов имеет максимальную активность в зоне рН поблизости от нейтральной точки. В резко кислой или резко щелочной среде хорошо работают лишь некоторые ферменты.
© При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента.
© Так же на скорость реакции влияет увеличение концентрации фермента, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Date: 2015-09-05; view: 623; Нарушение авторских прав
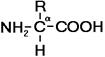 Рис. 255. Общая формула аминокислот.
Рис. 255. Общая формула аминокислот.
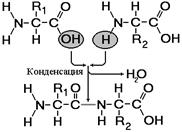 Рис. 256. Образование дипептида.
Рис. 256. Образование дипептида.
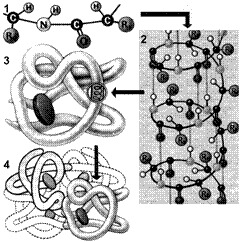 Рис. 257. Структура белковой молекулы:
1 — первичная; 2 — вторичная; 3 — третичная; 4 — четвертичная структуры.
Рис. 257. Структура белковой молекулы:
1 — первичная; 2 — вторичная; 3 — третичная; 4 — четвертичная структуры.
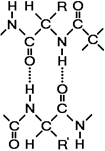 Рис. 258. Водородные связи.
Рис. 258. Водородные связи.
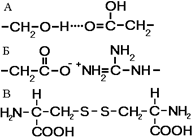 Рис. 259. Связи, стабилизирующие третичную структуру:
А — водородные, Б — ионные, В — дисульфидные.
Рис. 259. Связи, стабилизирующие третичную структуру:
А — водородные, Б — ионные, В — дисульфидные.
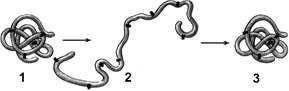 Рис. 260. Денатурация и ренатурация белка:
1 — молекула белка третичной структуры; 2 — денатурированный белок; 3 — восстановление третичной структуры в процессе ренатурации.
Рис. 260. Денатурация и ренатурация белка:
1 — молекула белка третичной структуры; 2 — денатурированный белок; 3 — восстановление третичной структуры в процессе ренатурации.
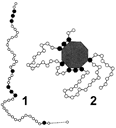 Рис. 261. Строение фермента:
1 — первичная структура молекулы ферментного белка (черным цветом обозначены аминокислоты, входящие в состав активного центра фермента); 2 — схематическое изображение фермент-субстратного комплекса.
Рис. 261. Строение фермента:
1 — первичная структура молекулы ферментного белка (черным цветом обозначены аминокислоты, входящие в состав активного центра фермента); 2 — схематическое изображение фермент-субстратного комплекса.
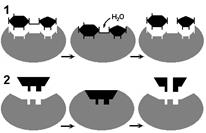 Рис. 262. Соответствие фермента и субстрата:
1 — гипотеза "ключа и замка"; 2 — гипотеза "руки и перчатки".
Рис. 262. Соответствие фермента и субстрата:
1 — гипотеза "ключа и замка"; 2 — гипотеза "руки и перчатки".