
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Расчет горения топлива (состав исходного газа, состав и калориметрическая температура продуктов горения)
Пересчет сухую массу на влажную, в исходном топливе появляется H2O(сумма каждой составляющей = 100%)
Таблица №1
| Наименование топлива | Состав сухого топлива в объемных, % | Влажность W г/м3 | ||||||||
| CH4 | C2H4 | С2H6 | C3H8 | C4H10 | C5H12 | CO2 | N2 | Всего | ||
| Природный газ Туймазинского м/р. | 42,70 | 0,00 | 20,00 | 19,50 | 9,50 | 2,90 | 0,20 | 5,20 | ||
| Состав влажного топлива в объемных, % | ||||||||||
| Природный газ Туймазинского м/р. | 41,67 | 0,00 | 19,52 | 19,03 | 9,27 | 2,83 | 0,19 | 5,07 |
Дано: n=1,12; Tв=300 оС
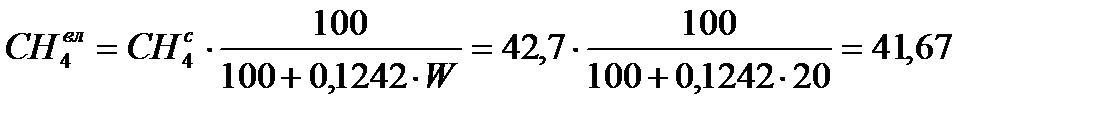
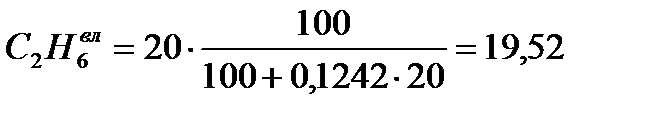
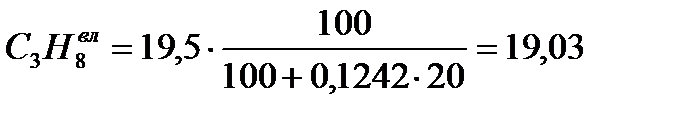
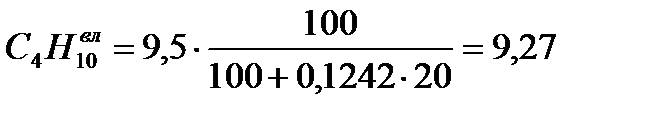
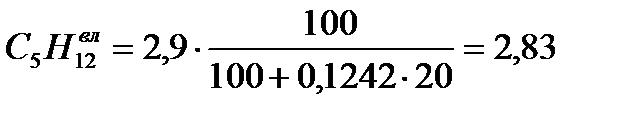
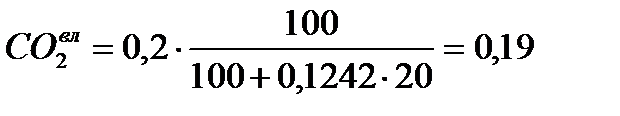
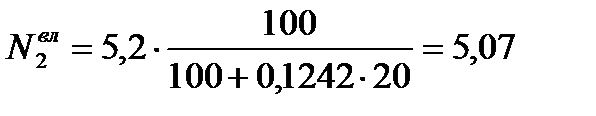
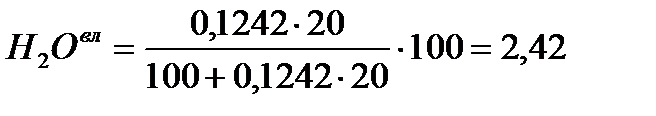
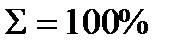
а) Определим теплоту сгорания природного газа, пользуясь табличными значениями тепловых эффектов горения горючих компонентов топлива.
o 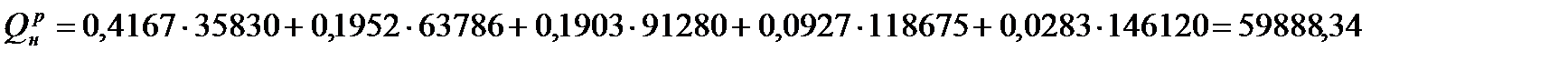 кДж/м3
кДж/м3
б) Определение расхода воздуха необходимого для горения количества и состава продуктов сгорания ведется на 100 м3 исходного топлива, а вычисления делаются в табличной форме.
Реакция окисления горючих компонентов топлива:
CH4+2O2=CO2+2H2O(пар)
С2H4+3O2=2CO2+2H2O(пар)
C2H6+7/2O2=2CO2+3H2O(пар)
C3H8+5O2=3CO2+4H2O(пар)
C4H10+13/2O2=4CO2+5H2O(пар)
C5H12+8O2=5CO2+6H2O(пар)
Таблица №2.
| Топливо | Воздух, м3 | Образуется продуктов сгорания, м3 | |||||||
| Состав | Содержание, м3, % | O2 | N2 | Всего | CO2 | H2O | O2 | N2 | Всего |
| CH4 | 41,67 | 83,34 | 41,67 | 83,34 | |||||
| C2H6 | 19,52 | 68,32 | 39,04 | 39,04 | |||||
| C3H8 | 19,03 | 95,15 | 57,09 | 76,12 | |||||
| C4H10 | 9,27 | 60,255 | 37,08 | 46,35 | |||||
| C5H12 | 2,83 | 22,64 | 14,15 | 16,98 | |||||
| CO2 | 0,19 | --- | 0,19 | ||||||
| N2 | 5,07 | --- | 5,07 | ||||||
| H2O | 2,42 | --- | 2,42 | ||||||
| n=1 | 329,70 | 1240,35 | 1570,055 | 189,22 | 264,25 | 1245,42 | 1698,89 | ||
| % | |||||||||
| n=1,12 | 369,27 | 1389,19 | 1758,46 | 189,22 | 264,25 | 39,565 | 1394,26 | 1887,295 | |
| % | 10,03 | 2,096 | 73,88 |
в) Находим плотность компонентов газа и продуктов сгорания топлива.
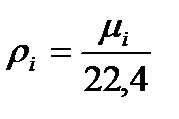 , кг/м3
, кг/м3
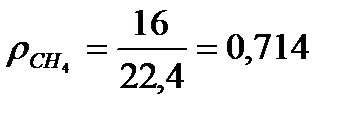
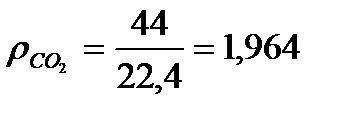
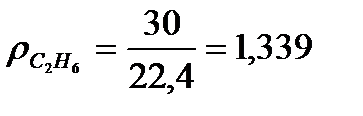
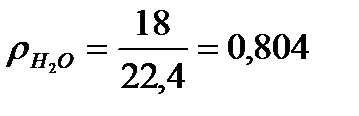
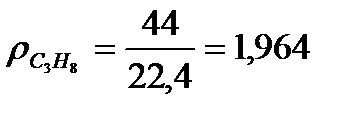

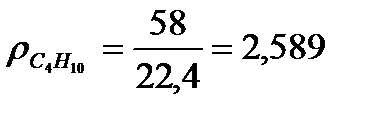
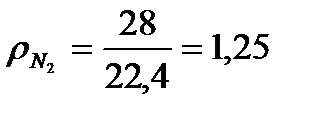
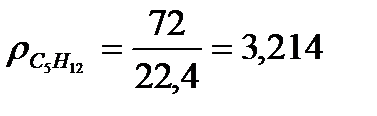
г) Составим материальный баланс горения.
Поступило:
100 м3 топлива, в том числе:
CH4=> 47,67∙0,714=29,75 кг
C2H6=> 19,52∙1,339=26,14 кг
C3H8=> 19,03∙1,964=37,37 кг
C4H10=> 9,27∙2,589=24,00 кг
C5H12=> 2,83∙3,214=9,1 кг
CO2=> 0,19∙1,964=0,37 кг
N2=> 5,07∙1,25=6,34 кг
H2O=> 2,42∙0,804=1,95 кг
Всего топлива: 135,02 кг
Воздуха 1758,46 м3 , в том числе:
О2 => 369,27 ∙ 1,429=527,59 кг N2=> 1389,19∙1,25=1736,49 кг
Всего воздуха: 2264,18 кг
Итого: топлив + воздух = 135,03+2264,18=2399,2 кг
Получено продуктов сгорания 1887,295 м3, в то числе:
CO2=> 189,22∙1,964=371,63 кг
H2O=> 264,25∙0,804=212,46 кг
О2=> 39,565∙1,429=56,54 кг
N2=> 1394,26∙1,25=1742,83 кг
Всего: 2383,46 кг
Невязка баланса:

е) Определение колориметрической температуры горения топлива методом последовательных приближений.
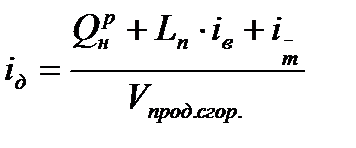 , где
, где 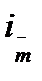 =0
=0
- в таблице энтальпий, энтальпия зависит от T
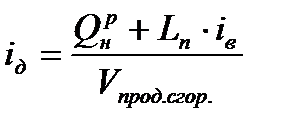
при температуре Tв=300 оС => Cв=1,318 кДж/(м3К) =>
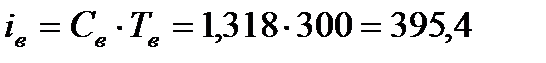 кДж/м3
кДж/м3
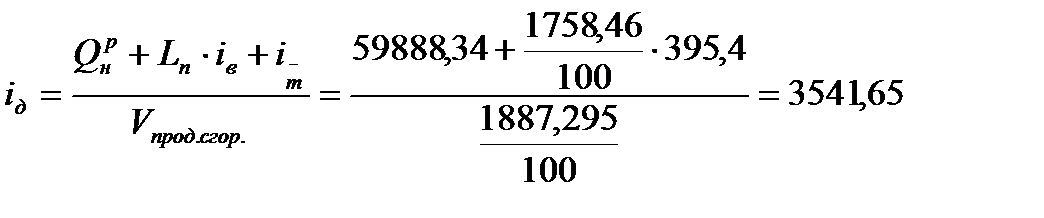 кДж/м3
кДж/м3
Задаемся Т1=2100 оС
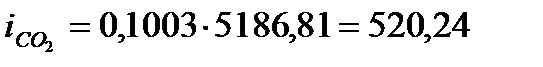 кДж/м3
кДж/м3
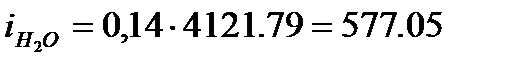 кДж/м3
кДж/м3
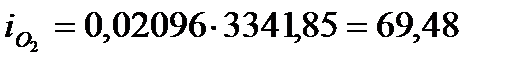 кДж/м3
кДж/м3
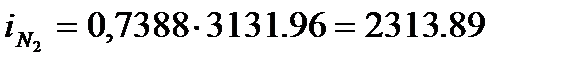 кДж/м3
кДж/м3
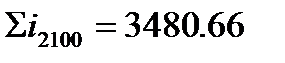 кДж/м3
кДж/м3
Т2=2200 оС
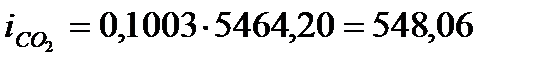 кДж/м3
кДж/м3
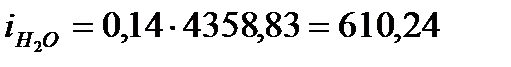 кДж/м3
кДж/м3
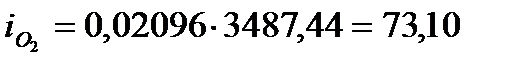 кДж/м3
кДж/м3
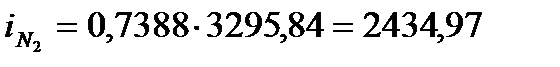 кДж/м3
кДж/м3
 кДж/м3
кДж/м3
Date: 2015-09-18; view: 559; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |