
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Краткая теория. Находясь в непрерывном тепловом движении, молекулы газа часто сталкиваются друг с другом
|
|
Находясь в непрерывном тепловом движении, молекулы газа часто сталкиваются друг с другом. Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d. За время между двумя последовательными столкновениями молекула в среднем проходит путь l, который называется средней длиной свободного пробега молекулы.
За счет участия в хаотическом тепловом движении и наличии неоднородностей плотности, температуры, скорости движения слоев молекулы переходят из одних точек пространства в другие, перенося присущие им массу, энергию, импульс. Это обуславливает существование в газе явлений переноса: диффузии, теплопроводности, внутреннего трения.
Явление внутреннего трения проявляется в том, что если скорость u потока газа меняется от слоя к слою, то на границе между двумя слоями, действует сила
 (4.1)
(4.1)
где 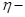 коэффициент внутреннего трения;
коэффициент внутреннего трения;
 градиент скорости – изменение скорости в направлении z, перпендикулярном к поверхности раздела слоев;
градиент скорости – изменение скорости в направлении z, перпендикулярном к поверхности раздела слоев;
S – площадь поверхности раздела слоев.
Средняя длина свободного пробега молекул l в соответствии с молекулярно-кинетической теорией (МКТ) равна
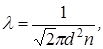 (4.2)
(4.2)
где n – концентрация молекул газа.
Коэффициент внутреннего трения по МКТ равен
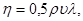 (4.3)
(4.3)
где  - плотность газа;
- плотность газа;
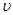 - средняя скорость теплового движения молекул:
- средняя скорость теплового движения молекул:
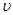 =
= 

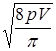 , (4.4)
, (4.4)
где R – универсальная газовая постоянная;
Т – абсолютная температура;
M - молярная масса;
p – давление;
V – объем газа.
Объем газа V, прошедший через капилляр в единицу времени t, найдем из формулы Пуазейля:

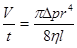 (4.5)
(4.5)
где  - разность давлений на концах капилляра,
- разность давлений на концах капилляра,
r – радиус капилляра;
 - длина капилляра.
- длина капилляра.
Плотность газа найдем из уравнения Менделеева-Клайперона:
 . (4.6)
. (4.6)
Тогда из уравнения (4.3) с учетом (4.4)- (4.6) найдем длину свободного пробега молекул газа:
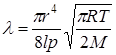
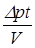
или  (4.7)
(4.7)
где 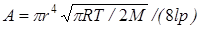 - константа эксперимента.
- константа эксперимента.
Для нахождения эффективного диаметра молекул из формулы (4.2) концентрацию молекул найдем из формулы:
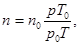 (4.8)
(4.8)
где 
 - давление и температура при нормальных условиях;
- давление и температура при нормальных условиях;
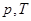 - давление и температура в момент эксперимента;
- давление и температура в момент эксперимента;
 - число Лошмидта, равное концентрации молекул в нормальных условиях.
- число Лошмидта, равное концентрации молекул в нормальных условиях.
Тогда из (4.2) с учетом (4.8) получаем
 . (4.9)
. (4.9)
Date: 2015-08-24; view: 571; Нарушение авторских прав