
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Фазы и структура металлических сплавов
|
|
Чистые металлы обычно имеют низкую прочность и невысокие технологические свойства. В технике обычно применяются сплавы. Сплавами обычно называют сложные вещества, полученные сплавлением нескольких элементов.
Элементы или химические соединения, образующие сплав, называют компонентами. Компонентами металлических сплавов могут быть не только металлы, но и неметаллы. В зависимости от числа компонентов сплавы могут быть двойные, тройные и т. д. В зависимости от физико-химического взаимодействия компонентов в сплавах образуются фазы, число и тип которых характеризуют состояние сплава.
Фазой называют однородную часть сплава, характеризующуюся определенным составом, свойствами, типом кристаллической решетки и отделенную от других частей сплава поверхностью раздела. Под структурой понимают форму, размеры и характер взаимного расположения фаз в сплаве. Фазовый состав и структура, определяющие свойства сплава, зависят от состава и технологии его обработки.
В сплавах возможно образование следующих фаз: 1) жидких растворов; 2) твердых чистых металлов; 3) твердых растворов; 4) химических соединений. В зависимости от количества фаз сплавы могут быть одно, двух- и многофазными.
В жидком состоянии компоненты сплава обычно неограниченно растворяются друг в друге, образуя жидкие растворы. В твердом состоянии компоненты могут образовывать: 1) механические смеси, представляющие собой смесь двух или нескольких фаз; 2) химические соединения, когда компоненты вступают в химические взаимодействия; 3) твердые растворы, когда один компонент растворяется в другом, который называется растворителем.
Если элементы, входящие в состав сплава, при затвердевании из жидкого состояния не растворяются друг в друге и не взаимодействуют, то образуется механическая смесь. Механические смеси образуются при кристаллизации многих сплавов, например Рb - Sb, Al - Cu. По структуре смесь представляет собой неоднородное тело. При метало-графическом анализе на шлифе видны кристаллиты разных компонентов, образующих механическую смесь. Химический анализ определяет также разные элементы. Рентгено-структурный анализ определяет два типа кристаллических решеток образующих такую смесь.
Если же элементы, составляющие сплав, взаи-модействуют друг с другом, то образуются химические соединения. По структуре они представляют собой однородные твердые тела. Свойства химических соединений отличаются от свойств образующих их элементов. Они имеют постоянную температуру плавления (диссоциации). Рентгеноструктурный анализ показывает различие кристаллических решеток химического соединения и исходных элементов. В химическом соединении сохраняется определенное соотношение атомов элементов, позволяющее выразить их состав стехиометрической пропорцией в виде простой формулы An Bm, где А и В - соответствующие элементы, а п и т - целые числа. Составы этих соединений на диаграммах «состав - свойство» характеризуются особыми сингулярными точками.
Различают химические соединения двух типов: металл - неметалл и металл - металл.
К химическим соединениям металлов с неметаллами относят фазы с ионным типом связи и фазы внедрения.
Фазы с ионным типом связи образуются в тех случаях, когда атом металла отдает валентные электроны и становится положительным ионом, а атом неметалла (например, кислорода, серы) принимает их на свою внешнюю оболочку и становится отрицательным ионом. В такой кристаллической решетке элементы удерживаются электростатическими силами. Хими-ческие соединения этой группы имеют строго стехио-метрический состав, их формулы определяются валентностью составляющих элементов. В структуре сплавов они находятся в виде неметаллических включений сульфидов, оксидов, фосфидов и т. д. Например, оксид марганца МnО, карбид железа Fе3С и др.
Фазы внедрения образуются в результате взаимодействия железа, марганца, хрома, вольфрама, молибдена и других метал-лов с неметаллами с малым атомным диаметром - углеродом, азотом, бором и водородом. К этим фазам относятся карбиды, нитриды, бориды и гидриды. Условием образования фаз внед-рения является отношение атомных диаметров у неметалла и ме-талла меньше 0,59. Атомы металла размещаются в узлах ре-шетки, а атомы неметалла - в ее октаэдрических или тетра-эдрических порах. Из-за меньших объемов тетраэдрических пор в них могут разместиться только атомы водорода.
Фазы внедрения имеют простую химическую формулу Ме4 Х (Fе4 N, Мn4 N), Ме 2Х (Fе 2N, Мо 2С), МеХ (карбиды VС, ТiС, NbC и нитриды FеN, VN, ТiN), где Ме - металл, X – не-металл. Такие фазы внедрения, как карбиды и нитриды, обла-дают высокой твердостью. На базе фаз внедрения с избытком металлических атомов могут образовываться твердые растворы.
К системе металл - металл относятся электронные соединения (фазы Юм-Розери), фазы Лавеса и σ-фазы.
Электронные соединения образуются между одновалентными (Си, Аg, Li) металлами или металлами переходных групп (Fе, Мп, Со), с одной стороны, и металлами с валентностью от 2 до 5 (А1, Ве, Мg, Zn) - с другой стороны. Электронные соединения являются фазами переменного состава. Соединения этого типа имеют определенную электронную концентрацию, т. е. определенное отношение числа валентных электронов к числу атомов: 3/2, 21/13, 7/4. Фазы с такими значениями электронной концентрации принято обозначать соответственно β -, γ - и ε - фазами.
К β - соединениям с электронной концентрацией N1 = 3/2, обычно имеющим ОЦК решетку, относятся соединения СuZn, СuВе, Сu3Аl и др. Например, для соединения СuZn N1 = (1 ∙ 1 + 2∙1) / (1 +1) = 3/2.
К γ - соединениям с электронной концентрацией 21/13 и сложной кубической решеткой относятся Сu5Zn8, Со5Zn21. Для соединения Сu5 Zn8 N2 = (1 ∙ 5 + 2 ∙ 8) /(5 + 8) = 21/13.
Электронная концентрация 7/4 с гексагональной решеткой характерна для ε-соединений СuZn3, Сu3Sn, Сu3Si. Для соединения СuSn3 с гексагональной ε-решеткой N3 = (1 ∙ 1 + 2 ∙ 3) /(1 + 3) = 7/4.
Электронные соединения характерны для сплавов на медной основе (латуней и бронз), где они являются упрочняющими фазами.
Фазы Лавеса имеют формулу АВ2. Они образуются между компонентами А и В при отношении их атомных диаметров от 1,1 до 1,6, обычно 1,2. К фазам Лавеса относятся соединения ТiFe2, ТiCr2, МоFе2, NbFе2, ТiСо2, присутствующие в ряде жаропрочных сплавов и способствующие их упрочнению. Они имеют гексагональную плотноупакованную или гранецентрированную кубическую решетку.
Сигма-фаза, образующаяся на базе металлов с близкими атомными диаметрами (как, например, σ - фаза в системе Fе - Сг), появляется в структуре высокохромистых сплавов при их очень медленном охлаждении или изотермической выдержке при 600-800 °С. Образование кристаллов σ - фазы сопровождается увеличением твердости и резким охрупчиванием коррозионностойких сталей.
Твердыми растворами называют фазы, в которых один из компонентов (растворитель) сохраняет свою кристаллическую решетку, а атомы других (растворяемых) компонентов располагаются в его решетке, искажая ее.
Химический анализ твердого раствора показывает несколько элементов, а металлографический и рентгеноструктурный - однородные зерна и один тип решетки, как у металла - растворителя.
Если атомы растворимого компонента замещают в узлах решетки атомы компонента-растворителя, то образующийся раствор называется твердым раствором замещения (рис. 2.1, а). Такие растворы образуют компоненты с аналогичными типами кристаллических решеток при небольшой разнице их параметров.
Если растворимый компонент имеет очень малый атомный диаметр, то образуется твердый раствор внедрения (рис. 2.1, 6). В этом случае энергозатраты на образование раствора оказываются меньшими, так как атомы растворимого компонента (например, углерода в железе) размещаются в междоузлии ячейки кристаллической решетки растворителя, не вытесняя атомов растворителя из узлов решетки.
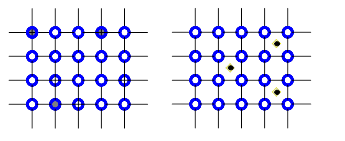
а б
Рис. 2.1. Виды твердых растворов: а - замещения; б - внедрения
В связи с различием в размерах атомов, при замещении атомов одного компонента атомами другого компонента происходит искажение кристаллической решетки. Это искажение тем больше, чем больше разница в размерах атомов и строении их кристаллических решеток. При чрезмерном искажении решетки дальнейшая растворимость становится невозможной. Наступает предельная растворимость, при которой дополнительно вводимые атомы не могут войти в решетку и образуют самостоятельную фазу. Если же оба компонента имеют однотипные кристаллические решетки, а атомные диаметры различаются не более чем на 8-15 %, то возможна неограниченная растворимость.
Твердый раствор внедрения образуется путем внедрения атомов растворенного компонента в междоузлия (пустоты) кри-сталлической решетки (рис. 2.1, б). В решетке ГЦК такая пус-тота находится в центре куба и образует сферу диаметром 0,4D, где D - диаметр атомов растворителя. В решетке ОЦК пустота находится в центре грани и образует сферу диаметром 0,29D.
Образование твердых растворов внедрения, как правило, сопровождается увеличением параметров кристаллической решетки и ее искажением.
В отличие от химических соединений твердые растворы внедрения имеют кристаллическую решетку металла-растворителя, в то время как химические соединения образуют решетку, отличающуюся от решетки металла.
Date: 2015-09-02; view: 3371; Нарушение авторских прав