
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторна робота № 14
|
|
Окисно-відновні реакції.
Мета роботи – ознайомитися з окисно-відновними властивостями металів, неметалів та їх сполук. Засвоїти методику складання рівнянь окисно-відновних процесів.
Прилади та реактиви: Штатив із набором пробірок, тигель, мікрошпатель. Магній, залізо, мідь, цинк металічні. Кристалічний дихромат амонію. Розчини: сірчаної кислоти, гідроксиду калію, перманганату калію, сульфіту натрію, дихромату калію, бромної води, аміак. Дистильована вода.,
Дослід 1. Відновні властивості металів.
До трьох пробірок налити декілька мілілітрів 0,1М розчину сірчаної кислоти. В першу пробірку внести шматочок цинку, в другу – феруму, в третю – купруму.
Завдання. Скласти електронні рівняння процесів окислення і відновлення, визначити окислювач і відновник.
Дослід 2. Вплив середовища на перебіг окисно-відновних реакцій.
В три пробірки внести 3-4 краплі розчину перманганату калію та додати до першої – 2-3 краплі розчину сірчаної кислоти, до другої – таку ж кількість води, до третьої – 5-6 крапель розчину гідроксиду калію. До всіх трьох пробірок додавати розчин сульфіту натрію до зникнення фіолетово-малинового забарвлення.
Завдання. Скласти рівняння окисно-відновних реакції та визначити окисник і відновник. Зробити висновок про характер відновлення перманганату калію в залежності від реакції середовища.
Дослід 3. Окисні властивості елементів у вищому ступені окислення.
До розчину дихромату калію додати 2-3 краплі розчину сірчаної кислоти та по краплям приливати сульфіт натрію до зміни забарвлення розчину.
Завдання. Скласти рівняння окисно-відновної реакції, якщо утворюється сульфат натрію та хрому (ІІІ). Зробити висновок про окисно-відновні властивості дихроматів.
Дослід 4. Відновні властивості елементів у нижчому ступені окислення.
В три пробірки внести розрізнено 3-4 краплі розчинів: а) бромної води, б) перманганату калію, в) біхромату калію. До кожної пробірки додати 3-5 крапель 25%-го розчину аміаку та підігріти.
Завдання. Написати рівняння відповідних реакцій, враховуючи, що аміак в основному окислюється до вільного нітрогену, перманганат калію відновлюється до оксиду мангану (ІV), біхромат калію до оксиду хрому (ІІІ). Відмітити зміну забарвлення розчинів.
Дослід 5. Внутримолекулярні редокс процеси.
До фарфорового тиглю помістити гіркою декілька мікрошпателів біхромату амонію. До вершини гірки вставити маленький шматочок магнію і підпалити його. Через декілька секунд спостерігати бурхливе розкладення солі.
Завдання. Написати рівняння внутримолекулярної окисно-відновної реакції, враховуючи, що утворюється оксид хрому (ІІІ), нітроген та пари води. Встановити атоми окисники та відновники в молекулі.
КОНТРОЛЬНІ ПИТАННЯ
1. Чим відрізняються реакції окисно-відновні від інших хімічних реакцій і в чому їх суть?
2. Що називається окисленням і відновленням? Які речовини називаються окислювачами, а які відновниками?
3. Назвіть найбільш активні відновники та окислювачі в залежності від їхнього знаходження в періодичній системі Д.І.Менделєєва.
4. Чому всі метали виявляють тільки відновні властивості, а багато неметалів можуть бути і окислювачами, і відновниками?
5. Методи складання окисно-відновних реакцій.
6. Як впливає середовище на перебіг окисно-відновних реакції?
ЗАДАЧІ
1. Яка ступень окислювання елементів у сполуках: K2MnO4, КСІО4, K2Cr2O7, Н2О2, СаН2?
2. Які з перерахованих іонів можуть бути відновниками, а які не можуть і чому: Fe+3, Sn+2, I-1, CrO4-2, Al+3, S+6.
3. Які з наступних реакцій відносяться до окисно-відновних?
H2 + Br2 = 2HBr
NH4Cl = NH3 + HCl
NH4NO3 = N2O + 2H2O
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
H3BO3 + 4HF = HBF4 + 3H2O
Fe + S = FeS
4. Визначите окислювач і відновник, підберіть коефіцієнти в реакціях:
Na2SO3 + I2 + H2O = Na2SO4 + HI
AsH3 + HNO3 = H3AsO4 + NO2 + H2O
ТЕМА: ГАЛЬВАНІЧНІ ПРОЦЕСИ.
Кристалічна решітка металу складається з іонів цього металу та вільних електронів. Якщо покласти метал у вакуум, електрони почнуть виходити з кристалічної решітки. В результаті вакуум біля поверхні металу заряджається негативно, а метал від надлишку іонів – позитивно при цьому на межі метал-вакуум утворюється подвійний електронний шар або стрибок потенціалу.
1. Якщо занурити металічну пластинку у воду, вона починає розчинятися, посилаючи свої гідратовані іони у розчин. Внаслідок цього найближче коло розчину заряджається позитивно. І в цьому випадку також утворюється стрибок потенціалу.
Різниця електростатичних потенціалів на межі „метал-розчин” називається електродним потенціалом.
2. При зануренні металічної пластинки у розчин своєї солі з концентрацією іонів металу в цій солі такий, яку пластинка надавала б при розчиненні, тобто в момент занурення з металу буде виходить стільки ж іонів, скільки і повертатися. В цьому випадку потенціал металу буде дорівнювати нулю.
Електродний потенціал, який відповідає стану рівноваги, при якому швидкість перебігу іонів у розчин дорівнює швидкості зворотного їх осадження, називається рівноважним потенціалом.
3. Якщо занурити металічну пластинку у насичений розчин своєї солі, то при цьому іони металу з розчину будуть “осаджуватися” на пластинку, заряджую її позитивно, а надлишок кислотного залишку зарядить розчин негативно. На межі „метал-розчин” утворюється різниця потенціалів або електродний потенціал.
Величина електродного потенціалу залежить від активності металу, концентрації його іонів у розчині та температури.
Якщо метал занурений у розчин, концентрації якого більш або менш 1г-іон/л, тоді обчислення потенціалу електрода проводиться за формулою Нернста:
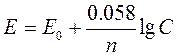 ,
,
де Е0 – стандартний електродний потенціал метала;
n – валентність іонів метала у розчині;
С – концентрація іонів металу в розчині (в г-іон/л).
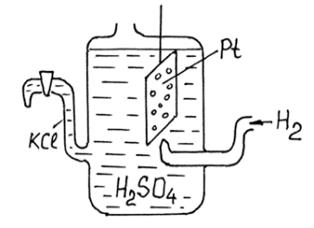 Абсолютні значення потенціалів металів виміряти не вдається, тому вимірюють їх відносно водневого електроду (див. рис.).
Абсолютні значення потенціалів металів виміряти не вдається, тому вимірюють їх відносно водневого електроду (див. рис.).
Водневий електрод складається з платинової пластини, яка вкрита губчастою платиною. Електрод занурюють у розчин сірчаної кислоти, з концентрацією йонів гідрогену 1 г-йон/л. знизу електрод омивається потоком газоподібного гідрогену під тиском 1 ат. Величину потенціалу такого електроду приймають за нуль.
Різниця потенціалів між металом зануреним у розчин своєї солі з концентрацією йонів металу 1 г-йон/л і водневим електродом, називається стандартним або нормальним електродним потенціалом металу.
При розташуванні металів в ряд за алгебраїчною величиною їх нормальних електродних потенціалів, отримали так званий “ електрохімічний ряд напруг металів”. Ряд напруг металів дає можливість зробити дуже важливі висновки:
-чим менша алгебраїчна величина стандартного електродного потенціалу, тим більша його хімічна активність;
-метали, які мають негативну величину стандартного електродного потенціалу, можуть видаляти гідроген з кислот;
-метал з меншою величиною стандартного електродного потенціалу здатний витискати з розчину солей метал з більшою алгебраїчною величиною стандартного електродного потенціалу;
-у гальванічному елементі анодом зветься більш активний метал, тобто стандартний електродний потенціал якого має меншу алгебраїчну величину.
Гальванічні елементи – це прилади, в яких хімічна енергія окисно-відновної реакції перетворюється в електричну.
Перший такий прилад був створено італійським фізіком-хіміком Вольта, потім вдосконалений російськими вченими Даніелем і Якобі. Їх гальванічний елемент складається з мідної та цинкової пластинок занурених у розчини своїх солей. Розчини розділені напівпроникною перетинкою. Якщо у зовнішній ланцюг увімкнути вольтметр, тоді можливо виміряти різницю електродних потенціалів або електрорушійну силу елемента.
ЕРС = Е0окисл. – Евідновн.
Схематично мідно-цинковий гальванічний елемент можна записати таким чином: (-) Zn / ZnSO4 // CuSO4 /Cu (+).

Date: 2015-09-02; view: 673; Нарушение авторских прав