
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Аминокислоты
|
|
Все 20 аминокислот, входящих в структуру белков организма человека, должны присутствовать в достаточном количестве. Это требование прежде всего относится к незаменимым (т.е. не синтезирующимся в организме) аминокислотам, так как недостаточное снабжение клетки хотя бы одной незаменимой аминокислотой приводит к снижению, а иногда и полной остановке синтеза белка на кодоне, требующем включения этой аминокислоты в белок.
мРНК. Содержит информацию о структуре синтезируемого белка и используется в качестве матрицы.
тРНК. У человека около 50 различных тРНК обеспечивают включение аминокислот в белок. тРНК называют " адапторные молекулы", так как к акцепторному концу этих молекул может быть присоединена определённая аминокислота, а с помощью антикодона они узнают специфический кодон на мРНК. В процессе синтеза белка на рибосоме связывание антикодонов тРНК с кодонами мРНК происходит по принципу комплементарности и антипараллельности.
| Антикодон тРНКАрг | (3')-G-С-С-(5') |
| Кодоны Apr: | (5')-C-G-G-(3') |
Однако оказалось, что число тРНК для каждой аминокислоты не совпадает с числом кодирующих её кодонов в мРНК, и, следовательно, некоторые тРНК способны связываться больше чем с одним кодоном.
Исследование этого вопроса позволило установить следующее:
- первые два основания кодона и последние два основания антикодона образуют обычные прочные пары (гуанинцитозин и аденинурацил) и вносят наибольший вклад в специфичность декодирования;
- связывание третьего основания кодона с первым основанием антикодона происходит слабее, чем с первыми двумя, и это позволяет некоторым тРНК прочитывать больше чем один кодон.
Гипотеза, объясняющая характер кодонан-тикодонового взаимодействия, получила название "гипотезы качания" (т.е. третье основание большинства кодонов имеет определённую степень свободы при образовании пары с соответствующим антикодоном и как бы "качается").
Так, например, одна из аргининовых тРНК имеет антикодон 5'-I-C-G-3', который может узнавать 3 разных аргининовых кодона:
| Антикодон | (3')-G-C-I-(5') | (3')-G-C-I- | (3')-G-C-I- |
| Кодоны | (3)-С-G-А-(3') | (5')-C-G-U- | (5')-C-G-C- |
Аминоацил-тРНК синтетазы (аминоацил-тРНК лигазы)
В цитозоле клеток 20 различных аминокислот присоединяются α-карбоксильной группой к 3'-гидроксильному акцепторному концу соответствующих тРНК с образованием сложноэфирной связи. Эти реакции катализирует семейство ферментов, носящее название аминоацил-тРНК синтетаз (аа-тРНК-синтетаз). Каждый член этого семейства узнаёт только одну определённую аминокислоту и те тРНК, которые способны связываться с этой аминокислотой. Из этого следует, что в группу тРНК синтетаз входит 20 различных ферментов. Они осуществляют активацию аминокислот в 2 стадии: на первой стадии аминокислота присоединяется к ферменту и реагирует с АТФ с образованием богатого энергией промежуточного соединения - аминоацил-АМФ. На второй стадии аминоацильный остаток аминоациладенилата, оставаясь связанным с ферментом, взаимодействует с молекулой соответствующей тРНК с образованием аминоацил-тРНК (рис).
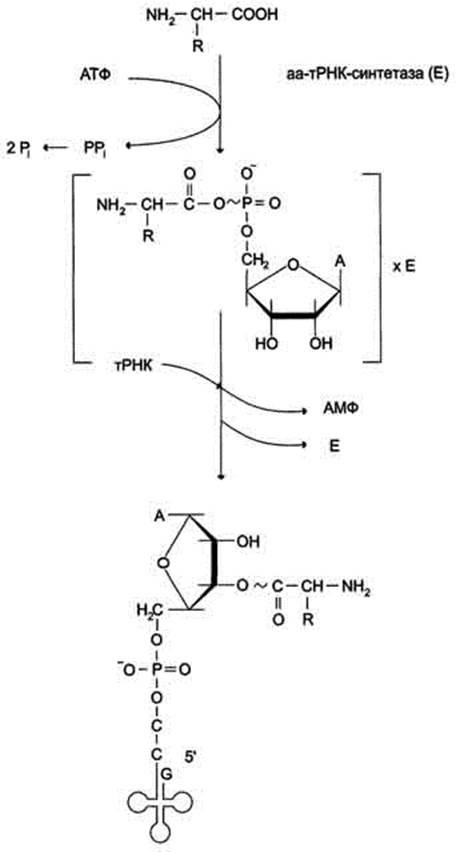
Рис. Образование аминоацил-тРНК. Аминокислота взаимодействует с АТФ и активируется, образуя аминоациладенилат, который, не освобождаясь из связи с ферментом (Е), отдаёт активированную аминокислоту тРНК с образованием аминоацил-тРНК (аа-тРНК).
Суммарную реакцию, катализируемую аминоацил-тРНК синтетазами в присутствии ионов Mg2+, можно представить следующим образом:
Аминокислота +тРНК + АТФ -" аминоацил - тРНК + АМФ + PPi.
Для каждой аминокислоты существует свой фермент - своя аминоацил тРНК синтетаза: для глутамата - глутамил-тРНК синтетаза, гистидина - гистидил-тРНК синтетаза и т.д.
Аминокислоты присоединяются к 3'- или 2'-ОН группам рибозы на 3'-конце тРНК, где все тРНК имеют общую нуклеотидную последовательность -ССА.
Энергия, заключённая в макроэргической сложноэфирной связи аминоацил-тРНК, впоследствии используется на образование пептидной связи в ходе синтеза белка.
Пирофосфат, выделяющийся в ходе этой реакции, гидролитически расщепляется с образованием двух молекул ортофосфата и выделением энергии, что делает реакцию активации аминокислот необратимой.
Чрезвычайно высокая специфичность аа-тРНК синтетаз в связывании аминокислоты с соответствующими тРНК лежит в основе точности трансляции генетической информации. В активном центре этих ферментов есть 4 специфических участка для узнавания: аминокислоты, тРНК, АТФ и четвёртый - для присоединения молекулы Н2О, которая участвует в гидролизе неправильных аминоациладенилатов. За счёт существования в активном центре этих ферментов корректирующего механизма, обеспечивающего немедленное удаление ошибочно присоединённого аминокислотного остатка, достигается поразительно высокая точность работы: на 1300 связанных с тРНК аминокислот встречается только одна ошибка.
Аминокислота, присоединяясь к тРНК, в дальнейшем не определяет специфических свойств аа-тРНК, так как её структуру не узнаёт ни рибосома, ни мРНК. Участие в синтезе белка зависит только от структуры тРНК, а точнее, от комплементарного взаимодействия антикодона аминоацил-тРНК с кодоном мРНК.
Антикодон расположен в центральной (антикодоновой) петле тРНК. Узнавание тРНК аа-тРНК синтетазами не всегда происходит по антикодоновой петле. Активный центр некоторых ферментов обнаруживает комплементарное соответствие другим участкам пространственной структуры тРНК.
Date: 2015-09-02; view: 659; Нарушение авторских прав