
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Доказательство генетической роли ДНК
|
|
Эксперименты, доказывающие большую роль ДНК в наследственности
Решающим поворотом в генетике было открытие в 1944 г. трансформирующей функции ДНК. Группа американских бактериологов - О. Эвери, Ч. Мак-Леод и М. Мак-Карти - проводила исследования вирулентности возбудителя пневмонии бактерии Diplococcus pneumoniae (Гуляев Г. В., 1971). Их опыты повторил английский бактериолог Ф. Гриффитс. В его опытах использовались два штамма пневмококков с противоположными признаками: с наличием и отсутствием капсул. Клетки капсульного штамма S были вирулентными, а бескапсульного - R - безвредными.
Ф. Гриффитс вводил суспензию данных микроорганизмов белым мышам в различных комбинациях. Животные, зараженные вирулентным штаммом S, погибали. При введении бескапсульных бактерий (R) и клеток S-штамма, убитых нагреванием, мыши выживали. Казалось бы, полученные результаты были закономерны, а их причины - очевидны. Но совершенно обескураживающие результаты были получены у последней группы белых мышей. Этим животным вводили суспензию, содержащую живые клетки бескапсульного штамма и убитые вирулентные бактерии. Через некоторое время у мышей обнаруживались клинические признаки пневмококковой инфекции и животные погибали. Проведенный бактериологический анализ показал, что в тканях погибших мышей содержатся клетки пневмококка, окруженные капсулой. Следовательно, невирулентный бескапсульный штамм пневмококков под воздействием убитых бактерий S-штамма получал новый признак - капсулу - и приобретал вирулентные свойства. Такое явление Гриффитс назвал трансформацией.
Однако природу трансформирующего агента в то время установить не удалось. Было известно, что это вещество небелкового происхождения, т. к. все белки при нагревании подвергались денатурации.
Явление трансформации наблюдалось также и в пробирке (in vitro), где смешивали живые клетки бескапсульного и мертвые бактерии вирулентного штаммов Diplococcus pneumoniаe. Через определенное время часть бескапсульных бактерий приобрели капсулу и вирулентность. Эксперименты in vitro полностью исключали участие в феномене трансформации каких-либо систем макроорганизмов.
Задача О. Эвери с сотрудниками состояла в том, чтобы выяснить, какое именно вещество способствует трансформации. Методика определения была выбрана относительно простая. Лизированные клетки капсульного штамма разделялись на различные химические составляющие. Каждый компонент испытывался на наличие трансформирующих свойств. Путем такого отбора удалось получить вещество, обладающее высокой трансформирующей активностью. Это была дезоксирибонуклеиновая кислота - ДНК.
Однако выводы группы О. Эвери о том, что посредством ДНК клетки-реципиенты получали от клеток-доноров новый генетический признак, долгое время многие ученые-генетики подвергали сомнению.
Например, существенные сомнения вызывал уровень очистки ДНК в экспериментах О. Эвери. Предполагалось, что присутствующие в препаратах нуклеиновых кислот белковые примеси и были причиной передачи нового генетического признака, что абсолютно не противоречило нуклеопротеидной теории. Стремясь проверить правильность выводов О. Эвери, Хочкисс добился такой степени очистки ДНК, что доля балластных веществ, в т. ч. и белков, в препарате составляла всего 0,02 %. Полученная таким образом чистая ДНК, тем не менее, обладала трансформирующими свойствами.
Другое возражение против генетической роли ДНК сводилось к тому, что ДНК как химическое соединение каким-то образом препятствовало биосинтезу основного вещества капсулы - полисахарида. То есть ДНК приписывалось физиологическое, а не генетическое воздействие. Чтобы опровергнуть это возражение, Гарриет Тейлор в 1949 г. получила новые данные о пневмококковой трансформации: она использовала два штамма, полностью лишенных капсул. Первый R-штамм был типичной бескапсульной бактерией, образующей шероховатые колонии. Второй, названный ей eхtremely R (ER), отличался ярко выраженными характеристиками и образовывал сильно шероховатые колонии. Выделенная из штамма R ДНК вносилась на среду с клетками ER. Через определенное время большая часть ER-бактерий превращалась в R-формы. Таким образом было показано, что наличие или отсутствие капсулы не отражается на трансформирующей роли ДНК.
В 1949 г. Хочкисс провел ряд экспериментов, которые подтвердили, что определенной зависимости между ДНК и синтезом бактериальными клетками капсулы на уровне метаболизма не существует. В его опытах трансформации подвергались бактериальные признаки, которые не имеют никакого отношения к капсулообразованию, - устойчивость микробов определенного штамма к пенициллину и стрептомицину передавалась к другому штамму бактерий.
Более наглядно роль ДНК в передаче наследственной информации была установлена в 1952 г. американскими вирусологами А. Д. Херши и М. Чейзом при изучении разложения фага Т2 (вируса бактерий). Опыт состоял в том, что белки, входящие в протеиновую оболочку вириона, были помечены радиоизотопной меткой - S 35 (сера), а ДНК - радиоактивным фосфором - Р32. В дальнейшем вирус культивировался в клетках бактерий. После этого дочерние вирионы - потомство фага - подвергались радиометрическому анализу на распределение радиоактивных меток. Исследования показали, что новое поколение фаговых частиц содержало только фосфор - Р32. Исследователи сделали справедливый вывод о том, что именно ДНК, а не белок передается от родителей к потомству.
О роли ДНК в передаче наследственной информации свидетельствует также открытие в 1952 г. Зайндером и Ледербергом явления трансдукции, заключающееся в переносе генетического материала фагами от одних бактерий к другим. Ученые при этом показали, что в процессе трансдукции активное участие принимает ДНК (Лехов А. П., 1973).
Кроме прямых доказательств об участии ДНК в процессах наследования признаков, наукой был накоплен обширный фактический материал, косвенно подтверждающий высказанные ранее предположения. В частности, об этом говорят данные относительно возникновения вызываемых химическими веществами и радиацией генетических изменений - мутаций.
Значительный вклад в изучение мутагенеза внесли отечественные ученые. Впервые в 1925 г. сотрудники Ленинградского радиевого института Г. А. Надсон и Г. С. Филиппов воспроизвели мутацию у дрожжевых грибков под влиянием лучей радия (Гулиев Г. В., 1971). В 1932 г. В. В. Сахаров получил мутацию у дрозофилы под воздействием раствора йодистого калия, в 1933 г. М. Е. Лобашев открыл мутагенное действие аммиака (Беляев Д. К., Иванов В. И., 1980). Несколько позже было показано, что мишенью для действия мутагенов является ДНК. Следовательно, изменение в структуре ДНК способствовало изменению генетической информации.
Открытия, сделанные в конце 40 - начале 50 гг. ХХ в. в области молекулярной генетики, предопределили современное направление исследований не только в изучении наследственности, но и биологии в целом. Важнейшее значение открытия явлений трансформации и трансдукции, а также расшифровки действия мутационных факторов заключается прежде всего в доказательстве генетической роли ДНК. Теперь генетики могли с уверенностью констатировать: ДНК является материальным носителем наследственности. Именно эта молекула ответственна за передачу важнейших признаков от родительских особей потомству.
6. Репликация А. Механизм действия ДНК-полимеразы. Для передачи дочерним клеткам генетической информации в процессе репликации ДНК (DNA) должна быть создана копия генома. Репликация ДНК осуществляется ДНК-зависимыми ДНК-полимеразами. Эти ферменты используют в качестве шаблона одну из цепей двойной спирали ДНК, так называемую матрицу. На матрице, начиная с короткой стартовой последовательности (праймера), ферменты синтезируют комплементарную цепь и воспроизводят в итоге исходную двухтяжевую ДНК. Субстратами ДНК-полимераз являются четыре дезоксирибонуклеотидтрифосфата: аденозин-, гуанозин-, тимидин- и цитозинтрифосфаты. При каждом шаге синтеза ДНК происходит спаривание нуклеотида с соответствующим азотистым основанием матричной цепи. Затем α-фосфатная группа связанного нуклеотида подвергается нуклеофильной атаке со стороны 3'-ОН-группы предыдущего нуклеотида. За этим следует удаление дифосфата и образование новой фосфодиэфирной связи. Эти этапы повторяются снова и снова по мере движения ДНК-полимеразы от одного основания к следующему вдоль матрицы.
Химический смысл полимеризации состоит в том, что свободная 3'-гидроксильная группа матрицы атакует α-фосфатную группу соответствующего присоединяемого нуклеозидтрифосфата (определяется природой азотистого основания затравки), при этом происходят отщепление остатка пирофосфата и образование фосфодиэфирной связи. Далее свободный 3'-гидроксил вновь присоединенного нуклеотида атакует α-фосфатную группу следующего нуклеозидтрифосфата, и таким путем продолжается процесс полимеризации, идущий в направлении 5'–>3', антипараллельно матрице, оканчивающейся 5'-фосфатом:
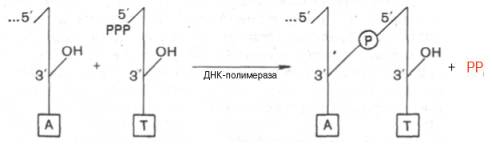
В соответствии с этим механизмом матричная цепь ДНК считывается в направлении 3'→5'. Механизм действия ДНК-полимеразы; Репликация в Е. coli; В большинстве клеток имеется несколько ДНК-полимераз. Наряду с ферментами, которые осуществляют собственно репликацию, существуют полимеразы, которые включены в процессы репарации ДНК (см. с. 252) или реплицируют митохондриальную ДНК эукариот. Большинство ДНК-полимераз построены из множества субъединиц, роль которых до конца не выяснена. К настоящему времени у эукариот, как и у бактерий (см. ранее), открыто несколько ДНК-полимераз. В репликации ДНК эукариот участвуют два главных типа полимераз – α и δ. Показано, что ДНК-полимераза α состоит из 4 субъединиц и является идентичной по структуре и свойствам во всех клетках млекопитающих, причем одна из субъединиц оказалась наделенной праймазной активностью. Самая крупная субъединица ДНК-полимеразы а (мол. масса 180000) катализирует реакцию полимеризации, преимущественно синтез отстающей цепи ДНК, являясь составной частью праймасомы. ДНК-полимераза δ состоит из 2 субъединиц и преимущественно катализирует синтез ведущей цепи ДНК (см. далее). Открыта также ДНК-полимераза ε, которая в ряде случаев заменяет δ-фермент, в частности при репарации ДНК (исправление нарушений ДНК, вызванных ошибками репликации или повреждающими агентами). Следует отметить, что в эукариотических клетках открыты два белковых фактора репликации, обозначаемых RFA и RFC. Фактор репликации А выполняет функцию белка – связывание одноцепочечной ДНК (наподобие белковых факторов связывания разъединенных цепей ДНК при репликации у Е. coli), фактор С – функцию стабилизатора всего реплика-ционного комплекса.
Б. Репликация в Е. coli В настоящее время процесс репликации у прокариот достаточно изучен, в то время как многие аспекты эукариотической репликации остаются неясными. Однако с большой долей вероятности можно утверждать, что в большинстве клеток этот процесс протекает в основном одинаково. На схеме показана простейшая схема репликации у бактерии Escherichia coli. В бактериях репликация начинается со специфической точки в кольцевой ДНК (область начала репликации) и продолжается в обоих направлениях. В результате образуются две репликативные вилки, которые продвигаются в противоположных направлениях, т. е. обе цепи реплицируются одновременно. На схеме исходная
ДНК (1) окрашена в голубой и фиолетовый цвета, а вновь синтезирующаяся — в розовый и оранжевый. В функционировании каждой вилки принимают участие множество различных белков, из которых здесь указаны наиболее важные. Каждая репликативная вилка (2) включает по крайней мере две молекулы ДНК-полимеразы III, ассоциированные с несколькими вспомогательными белками. К последним относятся ДНК-топоизомеразы (гиразы), которые раскручивают плотно свернутую двойную спираль ДНК, и хеликазы, которые расплетают двухтяжевую ДНК на две цепи. Поскольку матричная цепь всегда читается в направлении 3'→5' (см. выше), только одна из цепей может считываться непрерывно (розовая/фиолетовая; 2). Другая цепь (голубого цвета) считывается в направлении, противоположном движению репликативной вилки. В результате на матрице вначале синтезируются короткие фрагменты новой цепи ДНК (зеленый/оранжевый), так называемые фрагменты Оказаки (OF), названные так по имени их первооткрывателя. Каждый фрагмент начинается с короткой РНК-затравки (праймера, зеленого цвета), необходимой для функционирования ДНК-полимеразы. Праймер синтезируется специальной РНК-полимеразой
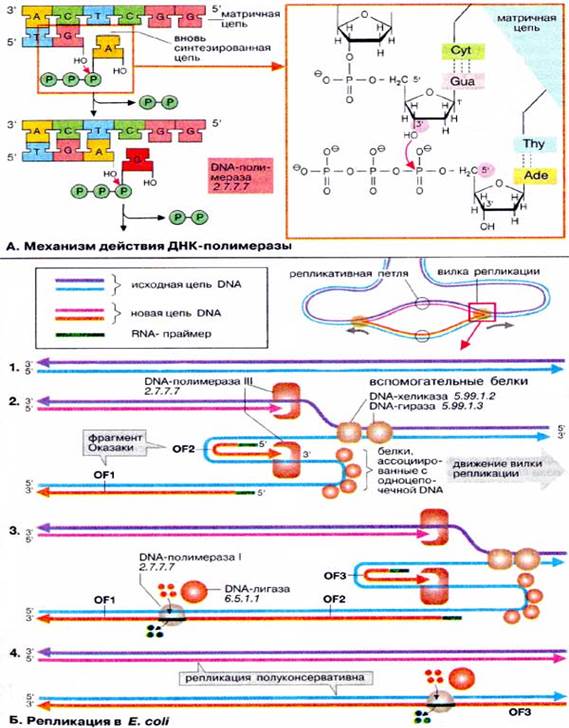
(«праймаза», на схеме не показана), ДНК-полимераза III достраивает этот праймер до фрагмента ДНК длиной 1000-2000 дезоксинуклеотидных звеньев (оранжевого цвета). Синтез этого фрагмента далее прерывается, и новый синтез начинается со следующего РНК-праймера. Индивидуальные фрагменты Оказаки первоначально не связаны друг с другом и все еще имеют РНК на 5'-концах (3). На некотором расстоянии от репликативной вилки ДНК-полимераза I начинает замещать РНК-праймер последовательностью ДНК. В завершение остающиеся одноцепочечные разрывы репарируются ДНК-лигазой. В образованной таким образом двойной спирали ДНК только одна из цепей синтезирована заново. Поэтому говорят, что репликация ДНК происходит по полуконсервативному механизму.
Особенности репликации ДНК у эукариот. Репликация ДНК у эукариот, по существу аналогичная репликации ДНК у прокариот, имеет ряд особенностей. Например, вместо одной точки репликации в ДНК эукариот имеются специфические точки «начала», так называемые автономно реплицирующие последовательности (около 300 нуклеотидных пар); в дрожжевой клетке таких элементов около 400. Кроме того, скорость движения репликационной вилки у эукариот (примерно 50 нуклеотидов в секунду) почти в 10 раз ниже, чем у E. coli. Для репликации ДНК генома человека из одной-единственной точки с подобной скоростью потребовалось бы более 500 ч; вместо этого репликация генома человека происходит в обоих направлениях и одновременно из множества точек (множество «начал» репликации), вовлекая от 30000 до 330000 пар оснований. Репликация продолжается до тех пор, пока не будут синтезированы две дочерние молекулы ДНК, в каждой из которых содержится одна родительская цепь (см. рис. 13.4). Таким образом, множественность точек «начала» репликации ДНК, вероятнее всего, является общим правилом для всех клеток эукариот.
Date: 2015-09-02; view: 1256; Нарушение авторских прав