
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Расчёт объёма воздуха, объёма и состава продуктов горения
|
|
При решении многих практических вопросов необходимо знать количество воздуха, расходуемого на горение единицы массы или объёма горючего вещества, количество образовавшихся продуктов горения и их процентный состав. Рассмотрим расчётные методы определения отдельных составляющих материального баланса процессов горения.
Методика расчёта объёма воздуха для горения зависит от состава горючего вещества, его агрегатного состояния и условий горения. По своей природе горючие вещества могут быть индивидуальными химическими соединениями и смесями сложных химических соединений. К индивидуальным химическим соединениям относятся такие вещества, которые имеют постоянное химическое строение и постоянную химическую формулу, например, бензол (С6Н6), пропанол (С3Н7ОН), уксусная кислота (СН3СООН) и др. Смеси сложных химических соединений – вещества, не имеющие определённого химического строения, и их состав одной химической формулой выразить нельзя. К этой группе веществ относятся уголь, нефть, древесина, жиры и др. Состав этих веществ выражается в процентном содержании отдельных элементов или газов (C, S, H, и др. или СО, СН4, Н2S и др.).
Различают объём воздуха, теоретически необходимый для горения (V Втеор), и объём воздуха, действительно (практически) израсходованный на горение (V Вдейств). При этом
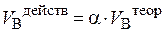 . (2)
. (2)
Множитель a называется коэффициентом избытка воздуха. Коэффициент избытка воздуха показывает, во сколько раз объём воздуха, поступивший на горение, больше теоретического объёма воздуха, необходимого для полного сгорания единицы количества вещества в стехиометрической смеси.
Разность между действительным и теоретически необходимым количеством воздуха называется избытком воздуха (DV В).
 . (3)
. (3)
Объём продуктов горения, образовавшихся при сжигании единицы горючего (1 кг, 1 м3, 1 кмоль) в теоретическом количестве воздуха, равен сумме объёмов углекислого газа, паров воды и азота:
 . (4)
. (4)
Полный, действительный объём продуктов горения рассчитывается с учётом избытка воздуха:
 (5)
(5)
Для удобства расчётов горючие вещества разделяют на следующие группы (табл. 16): индивидуальные химические соединения (в газообразном и конденсированном состоянии); вещества сложного состава (древесина, торф, нефть и т. п.); смесь газов (генераторный, попутный газы и т. п.).
Таблица 16
Расчётные формулы для определения теоретического количества воздуха, необходимого для сгорания веществ
| Группа горючих веществ | Расчётные формулы | Размер-ность |
| Индивидуальное горючее вещество в газообразном состоянии |  (6) (6)
| м3/м3 |
| Индивидуальное горючее вещество в конденсированном состоянии |  (7) (7)
| м3/кг |
| Смесь газов |  (8) (8)
| м3/м3 |
| Вещество сложного состава в конденсированном состоянии |  (9) (9)
| м3/кг |
Примечание:
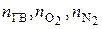 - количество горючего, кислорода и азота, получаемых из уравнения реакции горения, кмоль/кмоль;
- количество горючего, кислорода и азота, получаемых из уравнения реакции горения, кмоль/кмоль;
М ГВ – молекулярная масса горючего вещества;
Vt – молярный объём газа при заданных условиях, м3/кмоль;
C, H, S, O – весовое содержание соответствующих элементов в составе горючего вещества, % масс.;
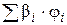 – сумма произведений стехиометрического коэффициента реакций горения каждого компонента горючей смеси (b i) на процентное содержание этого компонента (j i) в смеси;
– сумма произведений стехиометрического коэффициента реакций горения каждого компонента горючей смеси (b i) на процентное содержание этого компонента (j i) в смеси;
 – процентное содержание кислорода в сложном горючем газе.
– процентное содержание кислорода в сложном горючем газе.
Для газообразных горючих веществ расчёт объёмов воздуха и продуктов горения проводят в м3/м3. Так как 1 кмоль любого газа в одинаковых условиях занимает один и тот же объём (при нормальных условиях 22,4 м3), то объём, рассчитанный в м3/м3, численно будет таким же, как и в кмоль/кмоль.
Если горючее вещество находится в конденсированном состоянии (жидком или твёрдом), то, как правило, расчёты объёмов воздуха и продуктов горения проводят в м3/кг.
Для определения объёма воздуха при горении в условиях, отличных от нормальных, пользуются объединённым газовым законом:
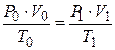 , (10)
, (10)
где Р 0 – нормальное давление, Па;
Т 0 – нормальная температура, К;
V 0 – объём воздуха при нормальных условиях (м3 или м3/кмоль);
P 1, T 1, V 1 – соответственно давление, объём и температура воздуха, характеризующие заданные условия горения.
Иногда на практике приходится решать обратную задачу – по известному процентному содержанию кислорода в продуктах горения находить коэффициент избытка воздуха:
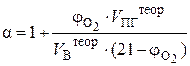 . (11)
. (11)
Для веществ, у которых объём продуктов горения равен объёму израсходованного воздуха (например, горение углерода, серы), эта формула упрощается:
 . (12)
. (12)
При расчёте объёма продуктов горения пользуются формулами, приведёнными в табл. 17.
Таблица 17
Расчётные формулы для определения теоретического объёма продуктов горения
| Группа горючих веществ | Расчётные формулы | Раз-мер-ность |
| Индивидуальное горючее вещество в газообразном состоянии | 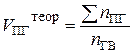 (13) (13)
| м3/м3 |
| Индивидуальное горючее вещество в конденсирован-ном состоянии | 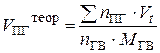 (14) (14)
| м3/кг |
| Смесь газов |  (15) (15)
| м3/м3 |
| Вещество сложного состава в конденсирован-ном состоянии |  (16) (16)
| м3/кг |
Расчёт объёма продуктов горения (СО2, Н2О, SO2, N2) при горении веществ сложного состава проводится по следующим формулам:
 ; (17)
; (17)
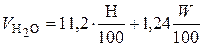 ; (18)
; (18)
 ; (19)
; (19)
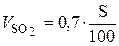 . (20)
. (20)
Процентный состав продуктов горения рассчитывается исходя из количества молей продуктов горения. Например, процентное содержание паров воды в продуктах горения составит, %
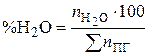 . (21)
. (21)
Если горение протекает с избытком воздуха, то при расчёте количества молей продуктов горения учитывается избыточное число молей кислорода и азота ( и
и  ), %
), %
 , (22)
, (22)
где 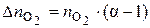 , (23)
, (23)
 . (24)
. (24)
Рассмотрим примеры решения задач на расчёт объёма воздуха, объёма и состава продуктов горения.
ПРИМЕР: Сгорает 4 м3 пропана (С3Н8). Рассчитать теоретические объёмы воздуха, объём и состав (в объёмных %) продуктов горения. Условия нормальные.
Date: 2015-08-15; view: 2436; Нарушение авторских прав