
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теплота. Теорія тепло ряду і молекулярно – кінетична теорія теплоти
|
|
Існує два способи знаходження кількості тепла. Перший спосіб пов‘язаний з використанням поняття ентропії. Теплота визначається з рівняння dq=TdS (dS=dq/T). Вираз для визначення роботи подібний до виразу визначення теплоти.
Для кінцевого процесу, в якому ентропія змінюється від S1 до S2 загальний вираз для кількості теплоти приймає вигляд 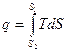 . В загальному випадку графічно ця залежність може бути зображена в T-S координатах кривою 1-2 (рис.6).
. В загальному випадку графічно ця залежність може бути зображена в T-S координатах кривою 1-2 (рис.6).
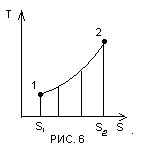
Подібно до того як в P-V діаграмі площа, обмежена кривою процесу і віссю абсцис, зображає роботу, в Т-S – діаграмі площа, обмежена кривою процесу і віссю абсцис, є кількість теплоти, що приймає участь в процесі
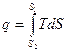 = площі 1,2,S2,S1,1.
= площі 1,2,S2,S1,1.
Інший спосіб знаходження кількості теплоти, яку поглинає або виділяє тіло (термодинамічна система) в якому – небудь процесі, пов‘язане з поняттям теплоємності. Q~mΔt Q=cmΔt
В загальному випадку підведення або відведення теплоти від тіла призводить до зміни його температури.
Відношення кількості теплоти qx, до відповідного рівня зміни температури Δt=t2-t1, називається теплоємністю тіла в термодинамічному процесі.
 - середня теплоємність
- середня теплоємність
Границя, до якої прямує середня теплоємність при Δt→0 називається істиною теплоємністю для заданого процесу Х.
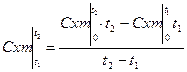
Теплоємність для газів залежить від термодинамічного процесу і поділяється на теплоємність ізобарну Ср і ізохорну Cv. Зв‘язок між ними встановлений відомим рівнянням Майєра Сp-Cv=R, де R – питома газова стала.
Питома теплоємність – це теплоємність одиниці кількості речовини:відповідно є мольна, масова і об‘ємна теплоємності.
 ;
; 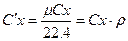
Для мольної теплоємності рівняння Майєра: 
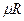 - універсальна газова стала.
- універсальна газова стала.
Відношення теплоємностей Ср і Сv називається показником адіабати
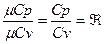

Згідно класично – кінетичної теорії теплоємність залежить тільки від атомності газів і не враховує залежності теплоємності газів від температури. Ці дані приведені в таблиці:
| Атомність газу | Мольна теплоємність кДж/(мольК) | k=Cp/Cv | |
| μCv | μCp | ||
| Одноатомний | 12.5 | 20.8 | 1.67 |
| Двохатомний | 20.8 | 29.1 | 1.40 |
| Багатоатомний | 25.0 | 33.3 | 1.33 |
Для реальних газів теплоємність визначається з таблиць довідників.
В наступній таблиці приведена класифікація різних видів теплоємності:
| Теплоємність | Масова кДж/(кгК) | Об‘ємна кДж/(м³К) | Мольна кДж/(мольК) | |||
| істина | середня | істина | середня | істина | середня | |
| Ізохорна | Сv | Cvm | C‘v | C‘vm | μCv | μCvm |
| Ізобарна | Cp | Cpm | C‘p | C‘pm | μCp | μCpm |
Date: 2015-07-27; view: 774; Нарушение авторских прав