
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Аминокислоты. Белки
|
|
Аминокислоты – это производные углеводородов содержащие две функциональные группы: аминогруппу (-NН2) и карбоксильную группу (-СООН).
α
Общая формула: NН2 -СН-СООН
l
R
В состав природных белков входят α-аминокислоты: α- атом – это первый соседний к карбоксильной группе атом Карбона, к нему же присоединяется аминогруппа. В природе существует множество аминокислот, но в состав белков входят 20 α-аминокислот.
Самая простая α- аминокислота – это глицын NН2СН2СООН (аминоуксусная кислота), в ней нет радикала. Самый простой радикал у аланина NН2 СНСООН
(2-аминопропановая кислота) l
СН3
Аминокислоты – это амфотерные соединения, т.к. содержат две разные по характеру группы: NН2 - основная группа, СООН- кислотная. Если в R содержится дополнительная - NН2 группа, то вся аминокислота в целом будет основная; если же в радикале дополнительная группа –СООН, то аминокислота – кислая.
Лизин – основная аминокислота NН2 СН СООН
l
(СН2)4 NН2
Аспарагиновая кислота – кислая аминокислота NН2 СН СООН
l
СН2СООН
Молекулярная форма аминокислот используется чтобы показать их состав. В растворах и в составе белков аминокислоты находятся в ионной форме: в аминокислотах идет внутримолекулярная поляризация с образованием биполярного иона (кислотный Н+ притягивается к неподеленной паре электронов атома Нитрогена, что ведет к образованию полюсов положительного и отрицательного зарядов).
+ _ _____
NН2- СН-СООН → NН3- СН-СОО
l l Биполярнй ион также
R R называют цвиттерион.
Химические свойства
1. Амфотерность аминокислот проявляется в их химических реакциях:
1). Как кислоты они реагируют с металлами, их оксидами и основаниями, с солями (см. в теме «Карбоновые кислоты»). Эти реакции идут по карбоксильной группе, при этом образуются соли.
2NН2 СНСООН + 2Nа 2NН2 СНСООNа + Н2
l l
R R
2). Как органические основания аминокислоты реагируют с кислотами (тема «Амины»), при этом также образуются соли.:
NН2 СНСООН + НCl → [ NН3 СНСООН] + Cl -
R R
2. Биохимически важная реакция аминокислот – это образование пептидов. Пептидная связь образуется из карбоксильной группы одной аминокислоты и аминогруппы другой. По механизму это реакция поликонденсации:

NH 3+ -CH-COO - + + H 3 N-CH-COO -
 R1 R 2
R1 R 2
-H 2 O
NH 3+ -CH- CO-HN -CH-COO - - это дипептид
R1 R 2
Группа - CO-HN - это пептидная связь. Если дипептид взаимодействует с еще одной молекулой аминокислоты, то образуется трипептид, также – тетрапептид (из 4 аминокислот) и т.д. Последовательность аминокислотных остатков в полипептидной цепи образует первичную структуру белка.
Пептидная связь имеет полярное строение – Оксиген, как наиболее электроотрицательный атом, притягивает электроны соседних связей и становится частично отрицательнозаряженным. Атом Гидрогена приобретает частичный положительный заряд. Эти полюса принимают участие в стабилизации вторичной структуры белка.
О -
║
- С - N -
ו
Н +
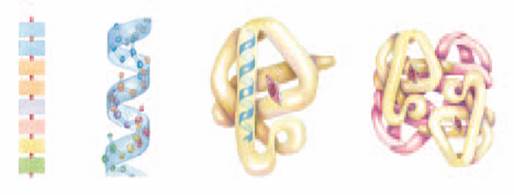
Уровни организации белков
Белки – это природные высокомолекулярные соединения (биополимеры), структурную основу которых составляют полипептидные цепи, построенные из остатков α-аминокислот.
Различают четыре уровня организации белков:
1. Первичная структура белка – это последовательность аминокислотных остатков в полипептидной цепи. Схематично:
NH 3+ -CH- CO-HN -CH- CO-NH -CH- CO-HN -CH- CO-NH -CH- CO-HN -CH-COO -
R 1 R 2 R 3 R 4 R 5 R 6
В организме человека более 10000 различных белков, и все они построены из одних и тех же 20 α-аминокислот (их называют стандартные аминокислоты), которые соединены между собой пептидными связями.
Пептидная связь – это прочная ковалентная связь, поэтому первичная структура белка – это самый стабильный уровень его организации. Последовательность аминокислотных остатков в полипептидной цепи должна строго соблюдаться и сохраняться, т.к. она определяет свойства данной белковой молекулы. Замена местоположения всего одной из нескольких тысяч аминокислот в белке влечет за собой изменение свойств всей белковой молекулы.
Вторичная структура белка – это способ «упаковки» аминокислотной цепочки в более компактную структуру. Наиболее важными видами вторичной структуры белка являются α-спираль и β–складчатые листки. Обе формы поддерживаются за счет образования многочисленных водородных связей между группами –С- и -N-.
║ ו
О Н
Практически все –СО- и - NН- группы пептидных связей участвуют в образовании водородный связей между витками спирали или между соседними листками складчатой структуры. Одна водородная связь – это слабая химическая связь, но при образовании вторичной структуры белка они многочисленны, что определяет относительную стабильность данного уровня организации белка.
α- правозакрученная спираль более часто встречается в природных белках. Она напоминает растянутую пружину, у которой на один виток приходится 3,6 аминокислотных остатка.
Третичная структура белка – это трехмерная структура, пространственная упаковка вторичной структуры белка в компактные глобулы. Данная структура поддерживается за счет ионного взаимодействия полярных радикалов, дисульфидных связей (-S-S-), водородных связей между отдельными R, но основная стабилизация идет за счет гидрофильного взаимодействия на поверхности глобулы. Молекулы воды (а белки всегда находятся в водной среде) притягиваются к полярным R аминокислот на поверхности глобулы и создают ее гидратную оболочку.
Четвертичной структурой обладают далеко не все белки. Это упаковка вместе нескольких глобул. Четвертичную структуру имеет, например, гемоглобин. Его молекула состоит из 4 глобул (субъединиц), каждая из которых обладает третичной структурой и содержит внутри гем – небелковое образование, содержащее Ферум. Данные субъединицы ассоциированы вместе и составляют единую структурную и функциональную единицу – молекулу гемоглобина, обладающей огромной молекулярной массой. Одна молекула гемоглобина переносит к тканям 4 молекулы кислорода. Стабилизируют четвертичную структуру слабые нековалентные связи.
Структура белка:
Первичная Вторичная Третичная Четвертичная
Денатурация белка
Под денатурацией подразумевают утрату трехмерной конформации, присущей данному белку. Под действием высокой температуры (50-600С), сильных кислот, щелочей, солей тяжелых металлов, органических растворителей разрушаются слабые (нековалентные) связи. Таким образом, белок теряет четвертичную, третичную и вторичную структуры. Первичная структура остается неизменной, т.к. за нее отвечают прочные пептидные связи. Благодаря сохранению первичной структуры денатурация может быть обратимой – ренатурация белка наступает если действие перечисленных факторов на белок было кратковременным.
Классическим примером денатурации белка является свертывание яичного белка при варке.
Качественне реакции на белки:
1. Биуретовая реакция – белки дают фиолетовое окрашивание при добавлении Купрум гидроксида (добавляют CuSO4 в щелочном растворе, образующийся Cu(OH)2 действует на пептидные связи белков).
2. Ксантопротеиновая реакция – под действием нитратной кислоты (HNO3) белки свертываются, образуя сгусток желтого или оранжевого цвета.
| <== предыдущая | | | следующая ==> |
| Аминокислоты, Спорт | | | Метаболизм Цистеина |
Date: 2015-08-07; view: 681; Нарушение авторских прав