
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

тренинг по решению задач
|
|
Цель: довести умения решать задачи по уравнению реакции до оптимального уровня усвоения.
| Вариант | Уравнение химической реакции | Дано | Найти | |
| А | Al + O2 → … | m (Al) = 2,7 г | V (O2) –? | |
| Б | m (Al) = 5,4 г | V воздуха, если φ (О2) 20 % | ||
| В | 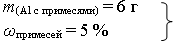
| V(O2) –? | ||
| Г | ω (Al)с прим = 2 г, ω прим = 4 % | V воздуха, если φ (О2) = 21 % | ||
| А | Mg + HCl → … + … | m (Mg) = 1,2 г | V (H2) –? | |
| Б | m (HCl)р-р = 730 г, ω (HCl) = 5 % | m (Mg) –? | ||
| В | m (Mg)с прим = 3 г, ω пр = 5 % | V (H2) –? | ||
| Г | m (Mg)с прим = 10 г, ω пр = 4 % | m (р-ра HCl), если ω (HCl) = 20 % |
| А | Al + H2SO4 → … + … | m (Al) = 5,4 г | V (H2) –? | ||||
| Б | m (H2SO4)р-р = 490 г, ω (H2SO4) = 5 % | m (Al) –? | |||||
| В | m (Al)с прим = 5 г, ω пр = 6 % | V (H2) –? | |||||
| Г | m (Al)с прим = 10 г, ω пр = 4 % | m (р-ра H2SO4) –?, если ω (H2SO4) = 10 % | |||||
| А | CaO + HCl → … + … | m (CaO) = 5,6 г | m (HCl) –? | ||||
| Б | m (HClр-р) = 200 г, ω (HCl) = 7,3 % | m (CaO) –? | |||||
| В | m (CaO)с прим = 4 г, ω пр = 10 % | m (HCl) –? | |||||
| Г | m (CaO)с прим = 10 г, ω пр = 5 % | m (р-ра HCl), если ω HCl = 10 % | |||||
| А | NaOH + H2SO4 → … + … | m (NaOH) = 2 г | m (H2SO4) –? | ||||
| Б | m (NaOHр-р) = 100 г, ω NaOH = 4 % | m (H2SO4) –? | |||||
| В | m (H2SO4)р-р = 98 г, ω (H2SO4) = 8 % | m (соли) –? | |||||
| Г | 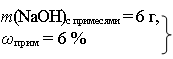
| m (р-ра H2SO4) –?, если ω (H2SO4) = 15 % | |||||
| А | Al + HCl → … + … | m (Al) = 1,08 г | V (H2) –? | ||||
| Б | m (Al) = 3,24 г | m (р-ра HCl), если ω (HCl) = 10 % | |||||
| В | m(Al)с прим = 6 г, ω пр = 2 % | V(H2) | |||||
| Г | m (Al)с прим = 10 г, ω пр = 4 % | m (р-ра HCl), если ω (HCl) = 8 % | |||||
Окончание табл.
| А | Al2O3 + HCl → … + … | m (Al2O3) 20,4 г | m (HCl) –? | |
| Б | m (HCl) = 365 г, ω = 30 % | m (Al2O3) –? | ||
| В | m (Al2O3) с прим = 10 г, ω прим = 20 % | m (HCl) –? | ||
| Г | m (Al2O3)с прим = 5 г, ω прим = 10 % | m (р-ра HCl), если ω (HCl) = 20 %? |
Матрица ответов (к с. 120–122)
| Вариант | Уравнение | Промежуточные действия | Ответ | |
| А | 4Al + 3O2 = 2Al2O3 | n (Al) = 0,1 моль; n (О2) = 0,075 | V (О2) = 1,68 л | |
| Б | n (Al) 0,2 моль; n (О2) = 0,15 моль; V (О2) = 3,36 л | V в = 16,8 л | ||
| В | m (Al) = 5,7 г; n (Al) = 0,21 моль; n (О2) = 0,158 моль | V (О2) = 3,55 л | ||
| Г | m (Al) = 1,92 г; n (Al) = 0,071 моль; n (О2) = 0,53 моль; V (О2) = 1,2 л | V в = 5,68 л | ||
| А | Mg + 2HCl → MgCl2 + H2 | n (Mg) = 0,05 моль = n (Н2) | V (Н2) = 1,12 л | |
| Б | m (HCl) = 36,5 г; n (HCl) = 1 моль; n (Mg) = 0,5 моль | m (Mg) = 12 г | ||
| В | m (Mg) = 2,85 г; n (Mg) = 0,12 моль; n (Н2) = 0,12 моль | V (Н2) = 2,7 л | ||
| Г | m (Mg) = 9,6 г; n (Mg) = 0,4 моль; n (HCl) = 0,8 моль; m (HCl) = 29,2 г | m (р-ра HCl) = 146 г |
Продолжение табл.
| А | 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 | n (Al) = 0,2 моль; n (Н2) = 0,3 моль | V (H2) = 6,72 л | |
| Б | m (H2SO4) = 24,5 г; n (H2SO4) = 0,25 моль; n (Al) = 0,167 моль | m (Al) = 4,5 г | ||
| В | m (Al) = 4,7 г; n (Al) = 0,174 моль; n (Н2) = 0,26 моль | V (Н2) = 5,85 л | ||
| Г | m (Al) = 9,6 г; n (Al) = 0,356 моль; n (H2SO4) = 0,533 моль; m (H2SO4) = 52,27 г | m (р-ра H2SO4) = 522,7 г | ||
| А | CaO + 2HCl = CaCl2 + H2O | n (CaO) = 0,1 моль; n (HCl) = 0,2 моль | m (HCl) = 7,3 г | |
| Б | m (HCl) = 14,6 г; n (HCl) = 0,4 моль; n (CaO) = 0,2 моль | m (CaO) = 11,2 г | ||
| В | m (CaO) = 3,6 г; n (CaO) = 0,064 моль; n (HCl) = 0,128 моль | m (HCl) = 4,7 г | ||
| Г | m (CaO) = 9,5 г; n (CaO) = 0,17 моль; n (HCl) = 0,34 моль; m (HCl) = 12,4 г | m (р-ра HCl) = 124 г |
Окончание табл.
| А | 2NaOH + H2SO4 = Na2SO4 + 2H2O | n (NaO) = 0,05 моль; n (H2SO4) = 0,025 моль | m (H2SO4) = 2,45 г | |
| Б | m (NaOH) = 4 г; n (NaOH) = 0,1 моль; n (H2SO4) = 0,05 моль | m (H2SO4) = 4,9 г | ||
| В | m (H2SO4) = 7,84 г; n (H2SO4) = 0,08 моль = υсоли | m (Na2SO4) = 11,36 г | ||
| Г | m (NaOH) = 5,64 г; n (NAOH) = 0,141; n (H2SO4) = 0,0705; m (H2SO4) = 6,909 | m (р-ра H2SO4) = 46,06 г | ||
| А | 2Al + 6HCl → 2AlCl3 + 3H2 | n (Al) = 0,04 моль; n (H2) = 0,06 моль | V (H2) = 1,344 л | |
| Б | n (Al) = 0,12 моль; n (HCl) = 0,36 моль; m (HCl) = 13,14 | m (р-ра) = 131,4 г | ||
| В | m (Al) = 5,88 г; n (Al) = 0,218 моль; n (Н2) = 0,327 моль | V (H2) = 7,3 л | ||
| Г | m (Al) = 9,6 г; n (Al) = 0,356 моль; n (HCl) = 1,067 моль; m (HCl) = 38,93 г | m (р-ра HCl) = 486,7 г | ||
| А | Al2O3 + 6HCl → 2AlCl3 + 3H2O | n (Al2O3) = 0,2 моль; n (HCl) = 1,2 моль | m (HCl) = 43,8 г | |
| Б | m (HCl) = 109,5 г; n (HCl) = 3 моль; n (Al2O3) = 0,5 моль | m (H2O3) = 51 г | ||
| В | m (Al2O3) = 8 г; n (Al2O3) = 0,078 моль; n (HCl) = 0,47 моль | m (HCl) = 17,2 г | ||
| Г | m (Al2O3) = 4,5 г; n (Al2O3) = 0,167 моль; n (HCl) = 1 моль; m (HCl) = 36,5 г | m (р-ра HCl) = 182,5 г |
В качестве домашних работ учащиеся могут взять следующие задачи:
В начале уроков 46–47 эти задачи разбираются у доски.
После уроков тренинга по решению задач учитель сообщает, что продолжается заочная олимпиада по химии. Вывешивает на доске объявлений в кабинете текст заданий зимнего тура олимпиады, указывает срок сдачи работ.
| <== предыдущая | | | следующая ==> |
| | | Определить вид линии, изобразить линию на чертеже и написать формулы преобразования |
Date: 2015-07-27; view: 2388; Нарушение авторских прав