
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Расчет объема и процентного состава продуктов горения
|
|
Состав продуктов горения зависит от химической природы горючего материала и условий его горения. Практически всегда органические вещества горят с образованием продуктов полного и неполного горения.
К продуктам полного сгорания относятся: углекислый газ, образующийся при горении углерода, разложении карбонатов; водяной пар, образующийся при горении водорода и испарении влаги в исходном веществе; оксид серы (IV) SO2 и азот – продукты горения соединений, содержащих серу и азот.
Продукты неполного сгорания – это оксид углерода (II) – угарный газ СО, сажа С, продукты термоокислительного разложения – смолы.
Неорганические вещества сгорают, как правило, до соответствующих оксидов.
Выход продуктов горения количественно установить невозможно из-за чрезвычайной сложности их состава, поэтому материальный баланс процесса горения рассчитывается из предположения, что вещество сгорает полностью до конечных продуктов. При этом в состав продуктов горения включают также азот воздуха, израсходованного на горение, и избыток воздуха при a > 1.
Как и в случае расчета объема воздуха, необходимого для горения, свои особенности имеет расчет продуктов горения для индивидуальных веществ, смеси газов и веществ с известным элементным составом.
2.2.1. Горючее – индивидуальное химическое соединение
В случае индивидуального химического соединения объем и состав продуктов горения рассчитывается по уравнению реакции горения.
| Расчет объема и процентного состава продуктов горения индивидуального вещества | Пример 2.8. Определить объем и состав в объемных % продуктов горения, образовавшихся при сгорании 3 кг бензола С6Н6. Температура 200С, давление 770 мм рт.ст., коэффициент избытка воздуха a = 1,4. |
1. Записываем уравнение реакции горения
3 кг х1 м3 х2 м3 х3 м3 х4 м3
С6Н6 + 7,5(О2 + 3,76N2) = 6СО2 + 3Н2О + 7,5×3,76N2
М = 78 кг 7,5×4,76 × Vм = 6×Vм = 3×Vм = 7,5×3,76×Vм =
=7,5×4,76×23,7 м3 =6×23,7 м3 =3×23,7 м3 =7,5×3,76×23,7 м3
2. Рассчитаем, какой объем занимает 1 кмоль газообразных веществ при заданных температуре и давлении.
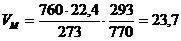 м3/кмоль
м3/кмоль

3. Теоретический объем продуктов горения (VПГ) определяем по уравнению реакции.
VПГ = 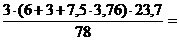 33,9 м3
33,9 м3
4. Горение протекает с коэффициентом избытка воздуха, следовательно, в состав продуктов горения войдет избыточный воздух DVв.
Для расчета избытка воздуха по уравнению реакции найдем теоретический объем воздуха, необходимый для полного сгорания бензола:
Vвтеор = х1 = 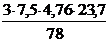 = 32,5 м3
= 32,5 м3
Избыток воздуха определим по формуле (3.4):
DVв= Vвтеор(a -1) = 32,5(1,4 – 1) = 13 м3
С учетом избытка воздуха практический объем продуктов горения составит:
VПГ* = VПГ + DVв = 33,9 + 13 = 46,9 м3
5. Иногда возникает необходимость рассчитать объем отдельных компонентов продуктов горения и их процентный состав.
В этом случае по уравнению реакции определяем объем СО2, Н2О и N2.
V(СО2) = х2 = 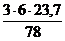 = 5,47 м3
= 5,47 м3
V(Н2О) = х3 = 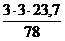 = 2,73 м3
= 2,73 м3
V(N2) = х4 = 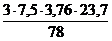 = 25,71 м3
= 25,71 м3
DVв= 13 м3 (рассчитано в п.4)
Объемная концентрация каждого компонента смеси рассчитывается следующим образом:
jоб (СО2) = 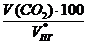 =
= 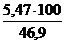 = 11,7 %
= 11,7 %
jоб (Н2О) = 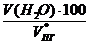 =
= 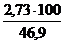 = 5,8 %
= 5,8 %
jоб (N2) = 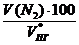 =
= 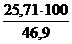 = 54,8 %
= 54,8 %
jоб (DVв) = 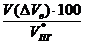 =
= 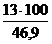 = 27,7 %
= 27,7 %
Обратите внимание, что более половины объема всех продуктов горения – это азот воздуха, израсходованного на горение. Если же горение протекает с коэффициентом избытка воздуха a > 1, то избыточный воздух также составляет значительную часть продуктов горения.
2.2.2. Горючее – смесь газов и паров
При расчете продуктов горения газовой смеси необходимо знать, какой объем продуктов горения выделяются при сгорании 1 м3 каждого горючего газа смеси. Далее, зная процентное содержание (в объемных %) каждого горючего газа, вычислить суммарный объем образовавшихся продуктов горения. Если горение протекает с избытком воздуха, то в состав продуктов горения необходимо включить и избыточный воздух.
| Расчет объема и процентного состава продуктов горения газовой смеси | Пример 2.9. Определить объем и состав продуктов горения 10 м3 природного газа следующего состава (в % объемных): метан СН4 – 75 %, этан С2Н6 – 4 %, пропан С3Н8 – 2 %, углекислый газ СО2 – 19 %. Горение протекает при a = 1,2. |
1. Составляем уравнение реакции горения для всех горючих газов смеси:
СН4 + 2(О2 + 3,76N2) = СО2 + 2Н2О +2×3,76N2 b (СН4) = 2
Для газообразных веществ отношение числа моль равно отношению объемов, следовательно, стехиометрические коэффициенты для каждого вещества в реакции горения – это и есть объем в м3 каждого компонента продуктов горения, выделившийся при сгорании 1 м3 горючего газа.
По уравнению реакции можно определить, что при сгорании 1 м3 метана СН4 образуется 1 м3 СО2, 2 м3 Н2О и 2×3,76 м3 N2.
С2Н6 + 3,5(О2 + 3,76N2) =2СО2 + 3Н2О +3,5×3,76N2 b (С2Н6) = 3,5
При сгорании 1 м3 этана С2Н6 образуется 2 м3 СО2, 3 м3 Н2О и 3,5×3,76 м3 N 2.
С3Н8 +,5(О2 + 3,76N2) =3СО2 + 4Н2О +5×3,76N2 b (С3Н8) =5
При сгорании 1 м3 этана С3Н8 образуется 3 м3 СО2, 4 м3 Н2О и 5×3,76 м3 N 2.
2. Определим теоретический объем продуктов горения.
Суммарный объем углекислого газа, образовавшегося при сгорании 1 м3 газовой смеси определяется с учетом процентного состава каждого горючего компонента газовой смеси, и также включается объем углекислого газа, входящий в состав исходной газовой смеси:
V(СО2) = 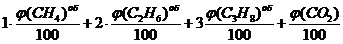 =
=
= 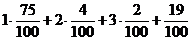 = 1,08 м3
= 1,08 м3
При сгорании 10 м3 газовой смеси объем образовавшегося углекислого газа составит:
V(СО2) = 1,08 × 10 = 10,8 м3
Аналогично рассчитываем объем паров воды, образовавшийся в результате сгорания 1 м3 смеси газов:
V(Н2О) = 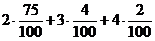 = 1,7 м3
= 1,7 м3
При сгорании 10 м3 газовой смеси объем паров воды будет:
V(Н2О) = 1,7 × 10 = 17 м3
Объем азота в продуктах горения составит для 1 м3 природного газа:
V(N2) = 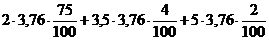 = 6,55 м3,
= 6,55 м3,
а для 10 м3
V(N2) = 6,55 × 10 = 65,5 м3
Теоретический объем продуктов горения 10 м3 газовой смеси составит:
VПГ = V(СО2)+ V(Н2О)+ V(N2) = (10,8 + 17 + 65,5) = 93,3 м3
2. Горение протекает с коэффициентом избытка воздуха a = 1,2, следовательно, в состав продуктов горения войдет и избыток воздуха. Для его расчета по формуле (3.6) определяем теоретический объем воздуха, необходимый для горения данной газовой смеси:
Vвтеор = 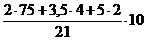 = 82,9 м3
= 82,9 м3
Избыток воздуха определим по формуле (3.4):
DVв= Vвтеор(a -1) = 82,9×(1,2 – 1) = 16,6 м3
С учетом избытка воздуха практический объем продуктов горения составит:
VПГ* = VПГ + DVв = 93,3 + 16,6 = 109,9 м3
2. Определим процентный состав продуктов горения:
jоб (СО2) = 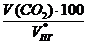 =
= 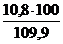 = 9,8 %
= 9,8 %
jоб (Н2О) = 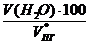 =
= 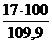 = 15,5 %
= 15,5 %
jоб (N2) = 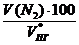 =
= 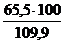 = 59,6 %
= 59,6 %
jоб (DVв) = 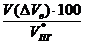 =
= 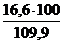 = 15,1 %
= 15,1 %
2.2.3. Горючее – сложное вещество с известным элементным составом
В этом случае теоретический выход продуктов горения определяется как сумма продуктов горения каждого элемента, входящего в состав вещества.
Рассчитаем, какой теоретический объем продуктов горения образуется при сгорании 1 кг каждого элемента при нормальных условиях.
Для углерода:
1 кг х1 м3 х2 м3
С + (О2 + 3,76N2) = СО2 + 3,76N2
12 кг 22,4 м3 3,76×22,4 м3
V(СО2) = х1 = 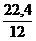 = 1,87 м3
= 1,87 м3
V(N2) = х2 = 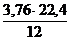 = 7,0 м3
= 7,0 м3
Для водорода:
1 кг х1 м3 х2 м3
Н + 0,25(О2 + 3,76N2) = 0,5Н2О + 0,25×3,76N2
1 кг 0,5×22,4 м3 0,25×3,76×22,4 м3
V(Н2О) = х1 = 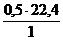 = 11,2 м3
= 11,2 м3
V(N2) = х2 = 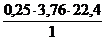 = 21,0 м3
= 21,0 м3
Для серы:
1 кг х1 м3 х2 м3
S + (О2 + 3,76N2) = SО2 + 3,76N2
32 кг 22,4 м3 3,76×22,4 м3
V(SО2) = х1 = 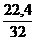 = 0,7 м3
= 0,7 м3
V(N2) = х2 = 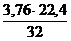 = 2,63 м3
= 2,63 м3
Для фосфора:
1 кг х1 м3 х2 м3
Р + 1,25(О2 + 3,76N2) = 0,5Р2О5 + 1,25×3,76N2
31 кг 0,5×22,4 м3 1,25×3,76×22,4 м3
V(Р2О5) = х1 = 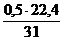 = 0,36 м3
= 0,36 м3
V(N2) = х2 = 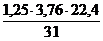 = 3,4 м3
= 3,4 м3
В состав горючего вещества может входить азот, влага, которые удаляются вместе с продуктами горения.
Объем 1 кг азота при нормальных условиях составит:
V(N2) = 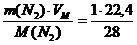 = 0,8 м3
= 0,8 м3
При нормальных условиях 1 кг паров воды займет объем:
V(Н2О) = 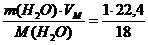 = 1,24 м3
= 1,24 м3
Если в состав горючего вещества входит кислород, то при горении он будет расходоваться на окисление горючих компонентов (углерода, водорода, серы, фосфора) и, поэтому из воздуха на горение будет израсходовано кислорода меньше на количество, которое содержалось в горючем веществе. Следовательно, в продуктах горения и азота будет меньше на количество, которое приходилось бы на кислород, если бы он находился не в горючем веществе, а в воздухе.
На 1 кг кислорода в воздухе будет приходиться объем азота, равный
V(N2) = 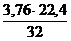 = 2,63 м3
= 2,63 м3
Полученные значения выходов продуктов горения элементов приведены в таблице 2.1.
Таблица 2.1.Теоретический объем продуктов горения элементов сложных веществ при нормальных условиях
| Элемент | Объем продуктов горения (м3) на 1 кг вещества | ||||
| СО2 | Н2О | SO2 | Р2О5 | N2 | |
| Углерод | 1,87 | 7,0 | |||
| Водород | 11,2 | 21,0 | |||
| Сера | 0,7 | 2,63 | |||
| Фосфор | 0,36 | 3,4 | |||
| Азот в горючем | 0,8 | ||||
| Азот за счет кислорода в горючем | - 2,63 | ||||
| Влага в горючем | 1,24 |
Используя данные таблицы 3.1., можно вычислить объем продуктов горения любого вещества с известным элементным составом.
Пусть w (С), w (Н), w (S), w (О),w (N) – – массовые доли элементов в веществе, %; w (W) – содержание влаги в веществе, %.
Тогда общие формулы для расчета каждого компонента продуктов горения при сгорании заданной массы (m) вещества будут иметь следующий вид:
V(СО2) = m× 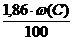 , м3 (2.9)
, м3 (2.9)
V(H2O) = m× 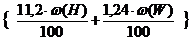 , м3 (2.10)
, м3 (2.10)
V(SО2) = m× 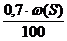 , м3 (2.11)
, м3 (2.11)
V(N2) = m× 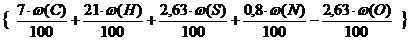 , м3 (2.12)
, м3 (2.12)
| Расчет объема и процентного состава продуктов горения вещества сложного элементного состава | Пример 2.10. Определить объем и процентный состав продуктов горения 5 кг каменного угля следующего состава (в %): С – 75,8 %, Н – 3,8 %, О – 2,8 %, S – 2,5 %, N – 1,1 %, W – 3,0 %, зола – 11,0 %. Горение протекает при a = 1,3, условия нормальные. |
1. По формулам (2.9) – (2.12) определяем объем каждого компонента продуктов горения 5 кг каменного угля.
V(СО2) = 5 × 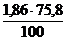 = 7 м3
= 7 м3
V(H2O) = 5 × 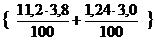 = 2,31 м3
= 2,31 м3
V(SО2) =5 × 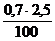 = 0,085 м3
= 0,085 м3
V(N2) = 5 × 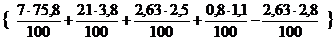 = 33,14 м3
= 33,14 м3
VПГ = 7 + 2,31 + 0,085 + 33,14 = 42,5 м3
2. Горение протекает с коэффициентом избытка воздуха 1,3, следовательно, в состав продуктов горения будет входить избыточный воздух.
По формуле (2.8) определяем теоретический объем воздуха, необходимый для горения данной массы образца угля:
Vвтеор = 5 × 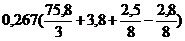 = 38,6 м3
= 38,6 м3
Избыток воздуха определим по формуле (2.4):
DVв= Vвтеор(a -1) = 38,6×(1,3 – 1) = 11,6 м3
С учетом избытка воздуха практический объем продуктов горения составит:
VПГ* = VПГ + DVв = 42,5 + 11,6 = 54,1 м3
3. Определим процентный состав продуктов горения:
jоб (СО2) = 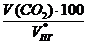 =
= 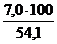 = 12,9 %
= 12,9 %
jоб (Н2О) = 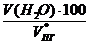 =
= 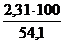 = 4,3 %
= 4,3 %
jоб (SО2) = 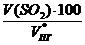 =
= 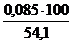 = 0,2 %
= 0,2 %
jоб (N2) = 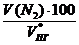 =
= 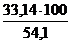 = 61,2 %
= 61,2 %
jоб (DVв) = 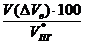 =
= 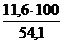 = 21,4 %
= 21,4 %
Date: 2015-07-27; view: 14916; Нарушение авторских прав