
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Коррозия с водородной деполяризацией. Метод защиты
|
|
Коррозию металлов, при которой катодная реакция осуществляется с выделением водорода, называют коррозией металлов с водородной деполяризацией.
Коррозия металлов с водородной деполяризацией имеет место:
- при высокой активности ионов Н+, т.е. в растворах кислот, например, кислотное растворение железа, цинка и других металлов;
- при достаточно отрицательных значениях потенциала ионизации металла, например, коррозия магния в воде или растворах солей.
На практике с такими явлениями сталкиваются при хранении и перевозке кислот, при кислотном травлении металлов, при получении кислот на стадии абсорбции.
Термодинамически протекание коррозии с выделением водорода возможно, если 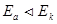
Значения равновесного потенциала водородного электрода в зависимости от 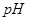 для парциального давления водорода
для парциального давления водорода 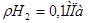 и
и 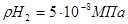 (последнее отвечает парциальному давлению Н2 в атмосфере) представлены в табл. 1
(последнее отвечает парциальному давлению Н2 в атмосфере) представлены в табл. 1
Равновесный потенциал водородного электрода при 25 °С в зависимости от 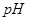 среды
среды
Давление водорода 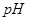 МПа МПа
| Ер, 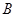 при при 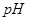 среды: среды:
| ||
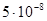
| +0,186 | -0,228 | -0,641 |
| 0,1 | -0,415 | -0,828 |
Катодный процесс выделения водорода состоит из стадий:
- массопереноса гидратированных ионов водорода к поверхности металла;
- электрохимической стадии разряда 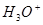 и образования
и образования 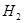 ;
;
- отвода 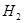 от поверхности металла.
от поверхности металла.
В щелочных растворах концентрация ионов 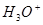 крайне мала и выделение водорода происходит за счет восстановления молекул воды:
крайне мала и выделение водорода происходит за счет восстановления молекул воды:
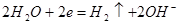
В большинстве случаев коррозия металлов происходит в растворах с высокой концентрацией 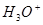 и поэтому концентрационная поляризация по
и поэтому концентрационная поляризация по 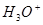 не наблюдается.
не наблюдается.
Главными причинами катодной поляризации является замедленная стадия электрохимического разряда или концентрационная поляризация по молекулярному водороду, связанная с отводом газообразного продукта.
Кинетика и механизм выделения 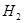 являются большим и самостоятельным вопросом, в изучение и развитие которого значительный вклад внесли работы ученых научной школы академика А.Н. Фрумкина. Эти работы широко освещаются в учебниках по электрохимии. Мы приведем только краткие, основные сведения.
являются большим и самостоятельным вопросом, в изучение и развитие которого значительный вклад внесли работы ученых научной школы академика А.Н. Фрумкина. Эти работы широко освещаются в учебниках по электрохимии. Мы приведем только краткие, основные сведения.
В широком интервале плотностей тока скорость реакции выделения 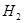 описывается уравнением Тафеля. При плотностях тока меньших, чем
описывается уравнением Тафеля. При плотностях тока меньших, чем 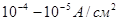 , зависимость изменения потенциала от плотности тока является линейной.
, зависимость изменения потенциала от плотности тока является линейной.
Для многих металлов наклон 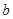 в координатах
в координатах 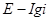 равен
равен 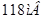 , что отвечает механизму замедленной стадии разряда с переносом одного электрона, хотя не исключены и другие механизмы.
, что отвечает механизму замедленной стадии разряда с переносом одного электрона, хотя не исключены и другие механизмы.
Константа а в уравнении Тафеля зависит от материала катода или материала инородных катодных включений в составе сплавов и численно определяется как величина перенапряжения при плотности тока, равной 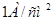 . Наиболее высокое перенапряжение наблюдается на свинце, ртути, кадмии, цинке.
. Наиболее высокое перенапряжение наблюдается на свинце, ртути, кадмии, цинке.
Поляризация вследствие замедленной диффузии молекулярного водорода носит название газовой концентрационной поляризации. Она сопровождает процесс водородной деполяризации, начиная с самых низких плотностей катодного тока.
На некоторых металлах выделение 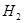 сопровождается процессом наводороживания. При образовании водорода адсорбированный атом водорода Надс поглощается металлом и диффундирует в его объем. Атомы Надс скапливаются внутри плоскостей и вакансий кристаллической решетки и там рекомбинируются в молекулы
сопровождается процессом наводороживания. При образовании водорода адсорбированный атом водорода Надс поглощается металлом и диффундирует в его объем. Атомы Надс скапливаются внутри плоскостей и вакансий кристаллической решетки и там рекомбинируются в молекулы 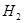 . Давление внутри металла увеличивается и происходит разрыв сплошности металла. Таким образом, коррозия металлов с водородной деполяризацией характеризуется:
. Давление внутри металла увеличивается и происходит разрыв сплошности металла. Таким образом, коррозия металлов с водородной деполяризацией характеризуется:
- большой зависимостью скорости коррозии металла от 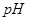 раствора;
раствора;
- большой зависимостью коррозионной стойкости сплавов от их природы и содержания в них катодных примесей;
- увеличением скорости коррозии во времени, что связано с ростом посторонних примесей на поверхности металла в результате его расторения;
- возможностью появления водородной хрупкости металлов.
Date: 2015-07-27; view: 1238; Нарушение авторских прав