
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Властивості пуринових основ аденіну та гуаніну. Значення азотистих основ у фізіології живих організмів і медицині. АТФ
|
|
Пуриновые основания — органические природные соединения, производные пурина. К пуриновым основаниям относятся аденин, гуанин, которые входят в состав нуклеиновых кислот; продукт азотистого обмена — мочевая кислота; лекарственные вещества — кофеин, теобромин.
Азо́тистые основа́ния — гетероциклические органические соединения, производные пиримидина и пурина, входящие в составнуклеиновых кислот. Для сокращенного обозначения пользуются большими латинскими буквами. К азотистым основаниям относятаденин (A), гуанин (G), цитозин (C), которые входят в состав как ДНК, так и РНК. Тимин (T) входит в состав только ДНК, а урацил (U) встречается только в РНК.[1]
После образования молекулы нуклеиновой кислоты входящие в её состав азотистые основания могут вступать в различные химические реакции под действием ферментов а также факторов внешней среды. Таким образом, нуклеиновые кислоты часто содержат модифицированные азотистые основания. Типичной модификацией такого рода является метилирование
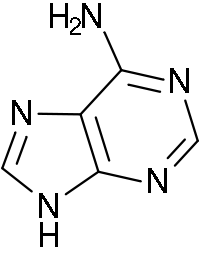 Аденин — азотистое основание, аминопроизводное пурина (6-аминопурин). Образует две водородных связи с урацилом и тимином (комплементарность).
Аденин — азотистое основание, аминопроизводное пурина (6-аминопурин). Образует две водородных связи с урацилом и тимином (комплементарность).
Аденин проявляет основные свойства. При взаимодействии сазотной кислотой, аденин теряет аминогруппу, превращаясь в гипоксантин (6-оксипурин). В водных растворах кристаллизуется в кристаллогидрат с тремя молекулами воды.
Аденин входит в состав многих жизненно важных для живых организмов соединений, таких как: аденозин, аденозинфосфотазы, аденозинфосфорные кислоты, нуклеиновые кислоты, адениновые нуклеотиды и др. В виде этих соединений аденин широко распространен в живой природе.
Исторически, назывался витамином B4[1], однако в настоящее время к витаминам не относится.
Гуани́н — азотистое основание, аминопроизводное пурина (2-амино-6-оксопурин), является составной частью нуклеиновых кислот. В ДНК, при репликации и транскрипции образует три водородных связи с цитозином(Cyt) (комплементарность). Впервые выделен из гуано.
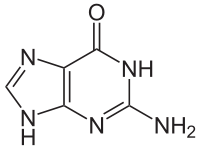
Проявляет основные свойства,. Реагирует с кислотами и щелочами с образованием солей.
При действии на гуанин HNO2 (азотистой кислоты) образуется ксантин.
Для определения гуанина его осаждают метафосфорной и пикриновойкислотами, с диазосульфокислотой в растворе Na2CO3 дает красное окрашивание.
Аденозинтрифосфа́т — нуклеозидтрифосфат, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах
Химически АТФ представляет собой трифосфорный эфир аденозина, который является производным аденина и рибозы.
Пуриновое азотистое основание — аденин — соединяется β-N-гликозидной связью с 1'-углеродом рибозы. К 5'-углероду рибозы последовательно присоединяются три молекулы фосфорной кислоты, обозначаемые соответственно буквами: α, β и γ.
АТФ относится к так называемым макроэргическим соединениям, то есть к химическим соединениям, содержащим связи, при гидролизе которых происходит освобождение значительного количества энергии. Гидролиз макроэргических связей молекулы АТФ, сопровождаемый отщеплением 1 или 2 остатков фосфорной кислоты, приводит к выделению, по различным данным, от 40 до 60 кДж/моль.
АТФ + H2O → АДФ + H3PO4 + энергия
АДФ + H2O → АМФ + H3PO4 + энергия
Класифікація, будова, номенклатура та способи добування моносахаридів. D- і L-стереохімічні ряди. Карбонільно-ендіольна та цикло-ланцюгова таутомерія моносахаридів. Епімерні монози
M- это углеводы представляющие собой полигидроксиальдегиды (альдозы) и полигидроксикетоны (кетозы) общей ф-лы С n Н 2 n О n (п = 3-9), в к-рых каждый атом С (кроме карбонильного) связан с группой ОН, и производные этих соед., содержащие разл. др. функц. группы, а также атом Н вместо одного или неск. гидроксилов.
По числу атомов С различают низшие М. (триозы и тетрозы; содержат в цепи соотв. 3 и 4 атома С), обычные (пентозы и гексозы) и высшие (гептозы, октозы, нонозы). Углеродные атомы в молекулах М. нумеруют таким образом, чтобы атом С карбонильной группы имел наим. номер
Другие М. имеют неск. асим. атомов С; их рассматривают как производные D- или L-глицеринового альдегида и относят к D- или L-ряду (абс. конфигурация М.) в соответствии с конфигурацией предпоследнего (п Ч 1) атома С.
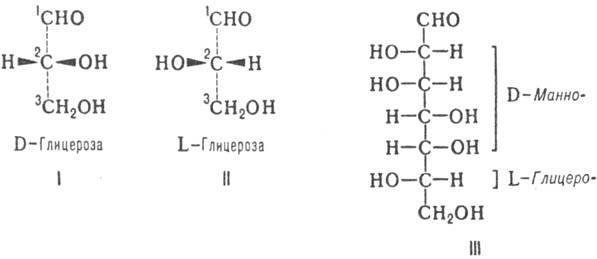
Различия между изомерными М. в каждом ряду обусловлены относит. конфигурацией остальных асим. центров; каждой относит. конфигурации в альдотетрозах, альдопентозах и альдогексозах соответствует тривиальное назв. моносахарида (рис. 1). Для обозначения конфигураций высших Сахаров используют префиксы, образованные из таких назв. (напр., L- глицеро -D- манно -гептоза; III). Стереохим. взаимоотношения между М. хорошо иллюстрируются проекционными Фишера формулами, в к-рых группа ОН располагается справа от вертикальной черты, обозначающей углеродную цепь, если соответствующий асим. центр имеет D-конфигу-рацию, и слева, если он имеет L-конфигурацию. Каждому представителю D-ряда соответствует его оптич. антипод, относящийся к L-ряду, в к-ром все асим. центры имеют противоположную конфигурацию. Общее число изомерных альдоз равно 2 n, где п- число асим. атомов С в молекуле.
Кетозы по сравнению с альдозами с той же длиной углеродной цепи содержат на один асим. атом С меньше. Однако у них встречается еще один вид изомерии, обусловленный разл. положением карбонильной группы. У большинства прир. кетоз атом С карбонильной группы занимает положение 2; представители D-ряда таких кетоз показаны на рис. 2.
Карбонильные группы М. легко реагируют внутримолеку-лярно с группами ОН, образуя циклич. полуацетали. Последние могут представлять собой пятичленный (фураноз-ная форма) или шестичленный (пиранозная форма) цикл и отличаться конфигурацией образующегося на месте карбонильной группы нового асим. центра (атом С этого асим. центра наз. а н о м е р н ы м, или г л и к о з и д н ы м). Эту конфигурацию обозначают буквой а, если она совпадает с конфигурацией центра, определяющего принадлежность М. к D- или L-ряду, и буквой Р в противоположном случае. Изомеры, различающиеся лишь конфигурацией аномерного атома, наз. а н о м е р а м и, а изменение конфигурации при этом атоме-а н о м е р и з а ц и е й. Для изображения циклич. форм М. удобно пользоваться Хоуорса формулами (см., напр., ф-лы IV и V-пиранозная и фуранозная формы кето-зы, а также рис. 3-циклич. ф-лы альдозы).

В р-ре каждый М. находится в виде смеси таутомеров (напр., рис. 3), соотношение между к-рыми в состоянии равновесия определяется их термодинамич. устойчивостью; в большинстве случаев преобладают пиранозные формы, а ациклические присутствуют в следовых кол-вах. Напротив, М. в кристаллич. состоянии представлены одной из тауто-мерных форм. Растворение кристаллов сопровождается таутомерными превращ., за протеканием к-рых можно следить по изменению во времени величины оптич. вращения (это явление наз. мутаротацией).

Рис. 3. Таутомерное равновесие D-глюкозы.
Фуранозные формы М. термодинамически менее выгодны, чем пиранозные, поскольку в практически плоском пятичленном цикле заместители вынуждены находиться в нестабильной заслоненной конформации. Напротив, шести-членные циклы имеют кресловидную форму, в к-рой заместители при соседних атомах С занимают более выгодные положения, соответствующие скошенной конформации. Существуют два типа кресловидной конформации пираноз-1 С 4 и 4C1 (цифры в верх. и ниж. индексах показывают номера атомов С, находящихся соотв. в верх. и ниж. положениях кресла). Более устойчивым является кресло с наим. числом объемистых аксиальных группировок. Поэтому для большинства альдогексоз D-ряда предпочтительным является кресло 4C1 с экваториальной группой СН 2 ОН и только для D-идозы в равновесии преобладает конформа-ция 1 С 4 (влияние накопления аксильных групп ОН):

На относит. устойчивость a- и b-форм кроме пространств. факторов влияют диполь-дипольные взаимод.-аномерный эффект, в результате к-рого заместитель при аномерном атоме стремится занять аксиальное положение (особенно в малополярных р-рителях), и D2 -эффект, заключающийся в повыш. нестабильности конформера с экваториальным заместителем у аномерного атома при наличии аксиального гидроксила в положении 2 (вследствие взаимного отталкивания атомов О; см. ф-лу Ньюмена):
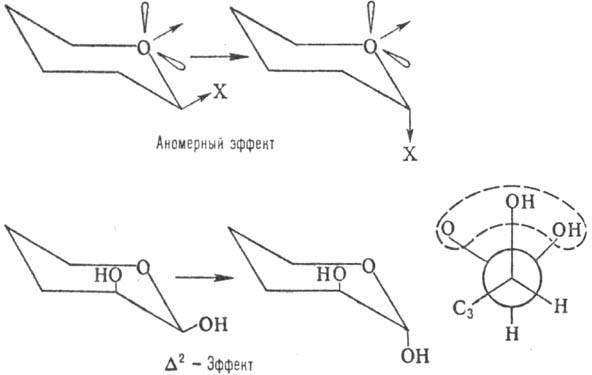
Кроме того, на относит. устойчивость a- и b-форм влияют водородные связи, к-рые могут играть стабилизирующую роль в относительно малополярных р-рителях, и нек-рые др. факторы.
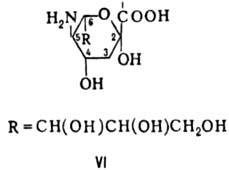
Кроме обычных известно неск. групп М., отличающихся своеобразным набором функц. групп или структурой углеродной цепи. К ним относятся дезоксисахара (одна или неск. групп ОН замещены на атомы Н), аминосахара (одна или неск. групп ОН замещены на аминогруппы), урановые кислоты (группа СН 2 ОН окислена в карбоксильную), разветвленные сахара (имеют разветвленную углеродную цепь с ме-тильной, гидроксиметильной или альдегидной группой в качестве ответвлений), высшие 2-кето-З-дезоксиальдоновые к-ты, в т. ч. сиаловые к-ты - производные 2-кето-3,5-дидез- окси-5-амино- D -глицеро- D -галакто-нононовой (нейрамино-вой) к-ты (ф-ла VI).
Распространение в природе. В природе широко распространены гексозы (D-глюкоза, D-галактоза, D-манноза, D-фруктоза) и пентозы (D-ксилоза, D-арабиноза, D-рибоза). М. редко в природе встречаются в своб. состоянии. Они входят в виде остатков в состав многочисл. гликозидов: олиго- и полисахаридов, более сложных биополимеров- гликопротеинов, гликолипидов, нуклеиновых кислот и др. Исключение - D-глюкоза, содержащаяся в плазме крови и соках растений, и D-фруктоза, большие кол-ва к-рой имеются в меде и плодах нек-рых растений.
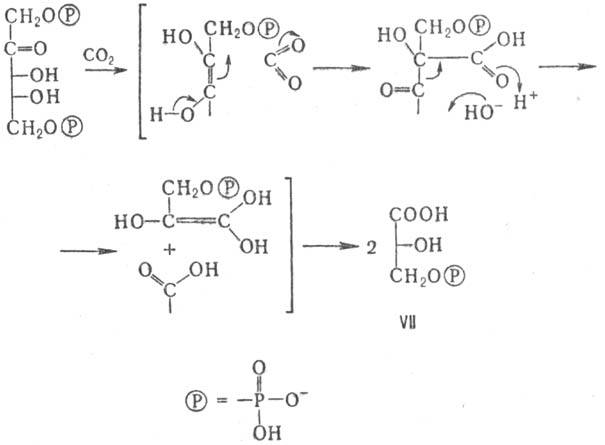
Образование М. в растениях связано с ассимиляцией ими СО 2 и происходит в результате фотосинтеза. Молекула СО 2 присоединяется к 1,5-дифосфату D-рибулозы в хлоро-пластах с участием фермента рибулозодифосфат-карбокси-лазы, а образующаяся в результате 3-фосфо-D-глицериновая к-та (ф-ла VII) путем дальнейшего восстановления и конденсаций дает D-глюкозу или D-фруктозу; при этом регенерируется молекула рибулозодифосфата (цикл Кальвина):
Распад гексоз, окислительный или анаэробный (гликолиз), служит источником энергии для большинства растит. и животных клеток; ферментативные трансформации гексоз приводят к получению др. природных М., а при более глубоких превращ. в обмене веществ из них образуются аминокислоты, липиды и др. орг. соединения. В многочисл. р-ции окисления, гликозилирования, восстановления и эпимеризации под действием соответствующих ферментов М. вступают в виде нуклеозиддифосфатсахаров (НДФС).
Процесс эпимеризации заключается в переходе формы с карбонильным кислородом в альдегидной или кетонной группе в енольную форму (с ОН-группой при углеродном атоме, связанном двойной связью). Благодаря кетоенольной таутомерии эпимерные моносахариды способны превращаться друг в друга. Эпимеризация обясняется тем, что при енолизации эпимерных моносахаридов (например,.D-глюкозы, />-манно-зы и />-фруктозы) образуется один и тот же ендиол. Очевидно, что при обратном превращении ендиола в карбонильную форму могут образоваться все три моносахарида
Date: 2015-07-27; view: 915; Нарушение авторских прав