
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Будова, ізомерія, номенклатура та способи добування алкінів. Хімічні властивості алкінів. Реакції приєднання та заміщення, СН-кислотний характер термінальних алкінів
|
|
Алкины – это углеводороды, в молекулах которых два атома углерода находятся в состоянии sp-гибридизации и связаны друг с другом тройной связью.
Общая формула: CnH2n–2, где n > 2.
Особенности алкинов: 1) длина связи в алкинах равна 0,120 нм; 2) каждый атом углерода в состоянии sp-гибридизации связан с двумя другими атомами; 3) может присоединять еще два атома.
Существует два типа изомерии алкинов: 1) изомерия положения тройной связи; 2) изомерия цепи.
Первые два члена гомологического ряда – этин и пропин – изомеров не имеют.
Для бутинов возможен только один вид изомерии – изомерия положения тройной связи.
Существует два типа номенклатуры: 1) международная номенклатура: этин; пропин; 2) рациональная номенклатура: ацетилен; метиацетилен.
Физические свойства алкинов: 1) С2Н2…С4Н6 – газы; 2) С5Н8…С15Н28 – жидкости; 3) С16Н30… – твердые вещества; 4) плохо растворимы в воде.
Химические свойства алкинов: обладают большой реакционной способностью, характеризуются реакцией присоединения, тройная связь содержит две π-связи.
Реакции присоединения:
1) присоединение водорода (гидрирование). На I ступени образуются алкены, на II ступени – алканы.
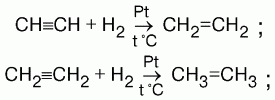
2) присоединение галогенов (галогенирование). HC≡CH + HCl → CH2=CHCl → CH3-CHCl2;
На I ступени образуются дигалогеналкены, на II – тетрагалогеналканы.
Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается;
3) присоединение галогеноводородов (гидрогалогенирование).
На I ступени образуются моногалогеналкены, на II – дигалогеналканы;
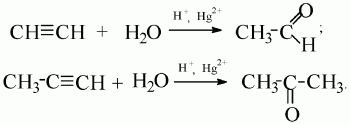
4) присоединение воды (гидратация).
Ацетилен образует альдегид, его гомологи – кетоны (реакция М.Г. Кучерова):
Реакция окисления: 1) горение (полное окисление): 2С2Н2 + 5O2 → 4СO2 + 2Н2О; 2) неполное окисление (под действием окислителя типа КМnO4, К2Сr2О7).
При действии сильных окислителей (КМnO4 в нейтральной среде, К2Сr2О7 в кислотной среде) алкины окисляются с разрывом молекулы по тройной связи (кроме ацетилена).
Конечным продуктом реакции являются карбоновые кислоты: СН3-С≡С-СН3 + 3[О] + Н2О → 2СН3-СООН – этановая (уксусная) кислота.
При неполном окислении ацетилена образуется двухосновная щавелевая кислота: СН≡Н + 4[О] → НООС-СООН.
ПОЛУЧЕНИЕ.1.Высокотемпературный крекинг метана. 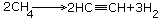
2.Гидролиз карбида кальция 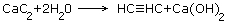
Способность ацетиленов с концевой тройной связью отдавать протон позволяет говорить о них как о соединениях, проявляющих кислотные свойства.
И хотя их кислотность очень мала, тем не менее алкины способны к реакциям замещения и реагируют с сильными основаниями, образуя при этом соли. Такие соли называют ацетиленидами. Если пропускать через аммиачным раствор солей одновалентной меди или серебра ацетилен, из раствора выпадает соответствен но красно-коричневый осадок алегиленида меди или белый осадок ацетилены да серебра. Ацетилен иды тяжелых металлов в сухом виде чувствительны к трению, удару и легко взрываются.
Ацетилениды натрия предъявляют особый интерес как промежуточные соединения для синтеза других алкинов. Они легко вступают в реакцию нуклеофильного замещения с галогеналканами. Аналогично протекает реакция с реактивами Гриньяра (магний-органическими соединениями). Русскими учеными Чугаевым и Церевигиновым было предложено определение подвижности атомов водорода с помощью магний органических соединений в органических соединениях. По количеству атомов водорода выделяется эквивалентное количество СН4. Метан собирают, определяют объем и рассчитывают число подвижных атомов водорода. Этот метод имеет аналитическое значение.
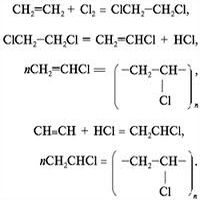
2. Замещение водорода при Csp на галоген. Атомы водорода при углероде с тройной связью замешаются на атомы галогенов (хлор, бром, йод) при действии галогенов в присутствии щелочей.
Date: 2015-07-27; view: 1304; Нарушение авторских прав