
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гипоталамические пептиды— либерины и статины, действующие на аденогипофиз
|
|
| Фактор | Основные эффекты у млекопитающих | Регуляция секреции |
| Кортиколиберин | Стимулирует секрецию АКТГ | Секреция стимулируется стрессорными нервными сигналами и подавляется АКТГ |
| Тиреолиберин | Стимулирует секрецию ТТГ и пролактина | Секрецию усиливает низкая температура тела и тормозят тиреоидные гормоны |
| Соматолиберин | Стимулирует секрецию СТГ | Секрецию стимулирует гипогликемия |
| Люлиберин | Стимулирует секрецию ФСГ и ЛГ | У самцов секреция вызывается снижением концентрации тестостерона в крови, а у самок — нервными сигналами и снижением концентрации эстрогенов. Высокая концентрация ЛГ или ФСГ в крови подавляет секрецию |
| Соматостатин | Тормозит секрецию СТГ и ТТГ | Секреция вызывается физической нагрузкой. Фактор быстро инактивируется в тканях тела |
| Пролактостатин | Тормозит секрецию пролактина | Секрецию стимулирует высокая концентрация пролактина и подавляют эстрогены, тестостерон и нервные сигналы при сосании |
| Меланостатин | Угнетает секрецию МСГ | Секрецию стимулирует мелатонин |
27. Гипоталамо-нейрогипофизарная система. Гормоны задней доли гипофиза. Механизм действия вазопрессина на клетки эпителия почечных канальцев.
Гипоталамо-нейрогипофизарная (заднегипофизарная) система представлена нейросекреторными клетками крупноклеточных ядер переднего гипоталамуса — супраоптического и паравентрикулярного. Аксоны этих клеток опускаются в нейрогипофиз, по ним в заднюю долю гипофиза поступают и депонируются нейропептиды вазопрессин и окситоцин, связанные со специфическими белками нейрофизинами.
Гипоталамические нейропептиды в зависимости от места реализации эффекта делят на три группы:
1) висцерорецепторные нейрогормоны, обладающие преимущественным действием на висцеральные органы (вазопрессин, окситоцин),
2) нейрорецеп-торные нейрогормоны или нейромодуляторы и медиаторы, обладающие выраженными эффектами на функции нервной системы (эндорфины, энкефалины, нейротензин, вазопрессин, ангиотензин и др.),
3) аденогипофизрецепторные нейрогормоны, регулирующие деятельность железистых клеток аденогипофиза.
Обшее звено управления включает кроме гипоталамуса и другие структуры центральной нервной системы, например, лимбическую систему, меняющие деятельность эндокринных клеток в зависимости от приспособительных потребностей организма при эмоциях и поведенческих актах.
Звенья общего и гуморального управления имеют многочисленные обратные связи, контролирующие процессы синтеза и секреции, уровень гормонов в крови и реализацию их эффектов в органах и тканях.
Задняя доля гипофиза тесно связана с супраоптическим и паравентрикулярным ядром гипоталамуса. Нервные клетки этих ядер вырабатывают нейросекрет, который транспортируется в заднюю долю гипофиза. Накапливаются гормоны в питуицитах, в этих клетках гормоны превращаются в активную форму. В нервных клетках паравентрикулярного ядра образуется окситоцин, в нейронах супраоптического ядра – вазопрессин.
Среди гормонов, синтезируемых в задней доле гипофиза, выделяют:
- Окситоцин. Многофункциональный гормон гипофиза, который может как стимулировать сокращение матки при родах, так и способствовать лактации. А также этот гормон играет огромную роль в процессе сексуального возбуждения человека.
- Вазопрессин, он же антидиуретический гормон. Влияет на работу почек, центральной нервной и сердечнососудистой системы человека. Нарушения в его выработке или восприятии организмом могут привести к несахарному диабету и синдрому Пархона.
- Целый ряд гормонов, схожих по биологическому действию с вышеперечисленными, среди них: мезотоцин, изотоцин, аспаротоцин, вазотоцин, глумитоцин и валитоцин.
Главной стороной биологического действия вазопрессина является его способность стимулировать реабсорбцию воды в дистальных отделах канальцев почек. Механизм действия вазопрессина сводится к повышению проницаемости эпителия почечных канальцев. В результате этого вода из мочи, которая в этом отделе обладает меньшим осмотическим давлением, чем плазма крови, свободно поступает из канальцев в кровь. В отличие от реабсорбции электролитов, в частности натрия, которая происходит через клетки канальцев с участием ферментов, реабсорбция воды происходит через межклеточные пространства. Под влиянием вазопрессина клетки канальцев вырабатывают гиаулоронидазу, вызывающую деполимеризацию мукополисахаридов межклеточного цемента, делая его проницаемым для воды.
В определенных экспериментальных условиях вазопрессин в дозах, значительно превышающих те, которые оказывают антидиуретическое действие, повышает артериальное давление. У здоровых людей он не оказывает вазопрессорного эффекта, однако он способен повышать артериальное давление у больных с нарушениями со стороны вегетативной нервной системы, страдающих ортостатической гипотонией, пониженным потоотделением.
В больших дозах вазопрессин повышает тонус гладкой мускулатуры, в частности, мускулатуры кишечника.
Высказывается предположение об участии вазопрессина в нейросекреторной системе, регулирующей продукцию АКТГ. Имеются данные о прямом стимулирующем действии вазопрессина на выделение гликокортикоидов корой надпочечников, однако в физиологических условиях это действие гормона, по-видимому, не проявляется.
28. Строение надпочечников. Гормоны коры и мозгового слоя надпочечников: влияние на обмен веществ и физиологические функции организма.
Надпочечники – парные железы, расположенные над верхними полюсами почек. Они имеют важное жизненное значение. Различают два типа гормонов: гормоны коркового слоя и гормоны мозгового слоя.
Гормоны коркового слоя длятся на три группы:
1) глюкокортикоиды (гидрокортизон, кортизон, кортикостерон);
2) минералокортикоиды (альдестерон, дезоксикортикостерон);
3) половые гормоны (андрогены, эстрогены, прогестерон).
Глюкокортикоиды синтезируются в пучковой зоне коры надпочечников. По химическому строению гормоны являются стероидами, образуются из холестерина, для синтеза необходима аскорбиновая кислота.
Физиологическое значение глюкокортикоидов.
Глюкокортикоиды влияют на обмен углеводов, белков и жиров, усиливают процесс образования глюкозы из белков, повышают отложение гликогена в печени, по своему действию являются антагонистами инсулина.
Глюкокортикоиды оказывают катаболическое влияние на белковый обмен, вызывают распад тканевого белка и задерживают включение аминокислот в белки.
Гормоны обладают противовоспалительным действием, что обусловлено снижением проницаемости стенок сосуда при низкой активности фермента гиалуронидазы. Уменьшение воспаления обусловлено торможением освобождения арахидоновой кислоты из фосфолипидов. Это ведет к ограничению синтеза простагландинов, которые стимулируют воспалительный процесс.
Глюкокортикоиды оказывают влияние на выработку защитных антител: гидрокортизон подавляет синтез антител, тормозит реакцию взаимодействия антитела с антигеном.
Глюкокортикоиды оказывают выраженное влияние на кроветворные органы:
1) увеличивают количество эритроцитов за счет стимуляции красного костного мозга;
2) приводят к обратному развитию вилочковой железы и лимфоидной ткани, что сопровождается уменьшением количества лимфоцитов.
Выделение из организма осуществляется двумя путями:
1) 75–90 % поступивших гормонов в кровь удаляется с мочой;
2) 10–25 % удаляется с калом и желчью.
Регуляция образования глюкокортикоидов.
Важную роль в образовании глюкокортикоидов играет кортикотропин передней доли гипофиза. Это влияние осуществляется по принципу прямых и обратных связей: кортикотропин повышает продукцию глюкокортикоидов, а избыточное их содержание в крови приводит к торможению кортикотропина в гипофизе.
В ядрах переднего отдела гипоталамуса синтезируется нейросекрет кортиколиберин, который стимулирует образование кортикотропина в передней доле гипофиза, а он, в свою очередь, стимулирует образование глюкокортикоида. Функциональное отношение «гипоталамус – передняя доля гипофиза – кора надпочечников» находится в единой гипоталамо-гипофизарно-надпочечниковой системе, которая играет ведущую роль в адаптационных реакциях организма.
Адреналин – гормон мозгового вещества надпочечников – усиливает образование глюкокортикоидов.
Мозговой слой надпочечников вырабатывает гормоны, относящиеся к катехоламинам. Основной гормон – адреналин, вторым по значимости является предшественник адреналина – норадреналин. Хромаффиновые клетки мозгового слоя надпочечников находятся и в других частях организма (на аорте, у места разделения сонных артерий и т. д.), они образуют адреналовую систему организма. Мозговой слой надпочечников – видоизмененный симпатический ганглий.
Значение адреналина и норадреналина
Адреналин выполняет функцию гормона, он поступает в кровь постоянно, при различных состояниях организма (кровопотере, стрессе, мышечной деятельности) происходит увеличение его образования и выделения в кровь.
Возбуждение симпатической нервной системы приводит к повышению поступления в кровь адреналина и норадреналина, они удлиняют эффекты нервных импульсов в симпатической нервной системе. Адреналин влияет на углеродный обмен, ускоряет расщепление гликогена в печени и мышцах, расслабляет бронхиальные мышцы, угнетает моторику ЖКТ и повышает тонус его сфинктеров, повышает возбудимость и сократимость сердечной мышцы. Он повышает тонус кровеносных сосудов, действует сосудорасширяюще на сосуды сердца, легких и головного мозга. Адреналин усиливает работоспособность скелетных мышц.
Повышение активности адреналовой системы происходит под действием различных раздражителей, которые вызывают изменение внутренней среды организма. Адреналин блокирует эти изменения.
Адреналин – гормон короткого периода действия, он быстро разрушается моноаминоксидазой. Это находится в полном соответствии с тонкой и точной центральной регуляцией секреции этого гормона для развития приспособительных и защитных реакций организма.
Норадреналин выполняет функцию медиатора, он входит в состав симпатина – медиатора симпатической нервной системы, он принимает участие в передаче возбуждения в нейронах ЦНС.
Секреторная активность мозгового слоя надпочечников регулируется гипоталамусом, в задней группе его ядер расположены высшие вегетативные центры симпатического отдела. Их активация ведет к увеличению выброса адреналина в кровь. Выделение адреналина может происходить рефлекторно при переохлаждении, мышечной работе и т. д. При гипогликемии рефлекторно повышается выделение адреналина в кровь.
29. Строение щитовидной железы. Гормоны щитовидной железы: влияние на обмен веществ и функции организма. Симптомы гипер- и гипофункции щитовидной железы.
Щитовидная железа расположена с обеих сторон трахеи ниже щитовидного хряща, имеет дольчатое строение. Структурной единицей является фолликул, заполненный коллоидом, где находится йодсодержащий белок – тиреоглобулин.
Гормоны щитовидной железы делятся на две группы:
1) йодированные – тироксин, трийодтиронин;
2) тиреокальцитонин (кальцитонин).
Йодированные гормоны образуются в фолликулах железистой ткани, его образование происходит в три этапа:
1) образование коллоида, синтез тиреоглобулина;
2) йодирование коллоида, поступление йода в организм, всасывание в виде йодидов. Йодиды поглощаются щитовидной железой, окисляются в элементарный йод и включаются в состав тиреоглобулина, процесс стимулируется ферментом – тиреоидпероксиказой;
3) выделение в кровоток происходит после гидролиза тиреоглобулина под действием катепсина, при этом освобождаются активные гормоны – тироксин, трийодтиронин.
Основной активный гормон щитовидной железы – тироксин, соотношение тироксина и трийодтиронина составляет 4: 1. Оба гормона находятся в крови в неактивном состоянии, они связаны с белками глобулиновой фракции и альбумином плазмы крови. Тироксин легче связывается с белками крови, поэтому быстрее проникает в клетку и имеет большую биологическую активность. Клетки печени захватывают гормоны, в печени гормоны образуют соединения с глюкуроновой кислотой, которые не обладают гормональной активностью и выводятся с желчью в ЖКТ. Этот процесс называется дезинтоксикацией, он предотвращает чрезмерное насыщение крови гормонами.
Роль йодированных гормонов:
1) влияние на функции ЦНС. Гипофункция ведет к резкому снижению двигательной возбудимости, ослаблению активных и оборонительных реакций;
2) влияние на высшую нервную деятельность. Включаются в процесс выработки условных рефлексов, дифференцировки процессов торможения;
3) влияние на рост и развитие. Стимулируют рост и развитие скелета, половых желез;
4) влияние на обмен веществ. Происходит воздействие на обмен белков, жиров, углеводов, минеральный обмен. Усиление энергетических процессов и увеличение окислительных процессов приводят к повышению потребления тканями глюкозы, что заметно снижает запасы жира и гликогена в печени;
5) влияние на вегетативную систему. Увеличивается число сердечных сокращений, дыхательных движений, повышается потоотделение;
6) влияние на свертывающую систему крови. Снижают способность крови к свертыванию (уменьшают образование факторов свертывания крови), повышают ее фибринолитическую активность (увеличивают синтез антикоагулянтов). Тироксин угнетает функциональные свойства тромбоцитов – адгезию и агрегацию.
Регуляция образования йодсодержащих гормонов осуществляется:
1) тиреотропином передней доли гипофиза. Влияет на все стадии йодирования, связь между гормонами осуществляется по типу прямых и обратных связей;
2) йодом. Малые дозы стимулируют образование гормона за счет усиления секреции фолликулов, большие – тормозят;
3) вегетативной нервной системой: симпатическая – повышает активность продукции гормона, парасимпатическая – снижает;
4) гипоталамусом. Тиреолиберин гипоталамуса стимулирует тиреотропин гипофиза, который стимулирует продукцию гормонов, связь осуществляется по типу обратных связей;
5) ретикулярной формацией (возбуждение ее структур повышает выработку гормонов);
6) корой головного мозга. Декортикация активизирует функцию железы первоначально, значительно снижает с течением времени.
Тиреокальцитоцин образуется парафолликулярными клетками щитовидной железы, которые расположены вне железистых фолликул. Он принимает участие в регуляции кальциевого обмена, под его влиянием уровень Ca снижается. Тиреокальцитоцин понижает содержание фосфатов в периферической крови.
Тиреокальцитоцин тормозит выделение ионов Ca из костной ткани и увеличивает его отложение в ней. Он блокирует функцию остеокластов, которые разрушают костную ткань, и запускают механизм активации остеобластов, участвующих в образовании костной ткани.
Уменьшение содержания ионов Ca и фосфатов в крови обусловлено влиянием гормона на выделительную функцию почек, уменьшая канальцевую реабсорбцию этих ионов. Гормон стимулирует поглощение ионов Ca митохондриями.
Регуляция секреции тиреокальцитонина зависит от уровня ионов Ca в крови: повышение его концентрации приводит к дегрануляции парафолликулов. Активная секреция в ответ на гиперкальциемию поддерживает концентрацию ионов Ca на определенном физиологическом уровне.
Секреции тиреокальцитонина способствуют некоторые биологически активные вещества: гастрин, глюкагон, холецистокинин.
При возбуждении бета-адренорецепторов повышается секреция гормона, и наоборот.
Нарушение функции щитовидной железы сопровождается повышением или понижением ее гормонообразующей функции.
Недостаточность выработки гормона (гипотериоз), появляющаяся в детском возрасте, ведет к развитию кретинизма (задерживаются рост, половое развитие, развитие психики, наблюдается нарушение пропорций тела).
Недостаточность выработки гормона ведет к развитию микседемы, которая характеризуется резким расстройством процессов возбуждения и торможения в ЦНС, психической заторможенностью, снижением интеллекта, вялостью, сонливостью, нарушением половых функций, угнетением всех видов обмена веществ.
При повышении активности щитовидной железы (гипертиреозе) возникает заболевание тиреотоксикоз. Характерные признаки: увеличение размеров щитовидной железы, числа сердечных сокращений, повышение обмена веществ, температуры тела, увеличение потребления пищи, пучеглазие. Наблюдаются повышенная возбудимость и раздражительность, изменяется соотношение тонуса отделов вегетативной нервной системы: преобладает возбуждение симпатического отдела. Отмечаются мышечное дрожание и мышечная слабость.
Недостаток в воде йода приводит к снижению функции щитовидной железы со значительным разрастанием ее ткани и образованием зоба. Разрастание ткани – компенсаторный механизм в ответ на снижение содержания йодированных гормонов в крови.
Симптомы пониженной выработки гормонов щитовидки (гипотиреоз):
o Увеличение веса;
o Повышение уровня холестерина в крови;
o Слабость, сонливость и повышенная утомляемость;
o Отеки конечностей и лица;
o Депрессия;
o Нарушения сна;
o Запоры;
o Нарушение менструального цикла у женщин;
o Снижение потенции у мужчин;
o Сухая кожа;
o Ломкость ногтей, волос;
o Слабый пульс;
o Снижение концентрации внимания и памяти.
Симптомы повышенной выработки гормонов щитовидки (гипертиреоз):
o Общая слабость, бессонница, раздражительность;
o Повышенное артериальное давление;
o Дрожание рук или всего тела;
o Потеря веса, даже при нормальном питании;
o Нарушение менструального цикла у женщин;
o Снижение потенции у мужчин;
o Жидкий стул (поносы);
o Потливость, непереносимость жары;
o Нарушение ритма сердца, сердцебиение (тахикардия);
o В редких случаях - возможно ощущение песка и двоение в глазаз, экзофтальм (выпячивание глазных яблок).
30. Эндокринная функция поджелудочной железы. Значение гормонов поджелудочной железы в регуляции обмена веществ. Симптомы недостаточности эндокринной функции поджелудочной железы.
Поджелудочная железа – железа со смешанной функцией. Морфологической единицей железы служат островки Лангерганса, преимущественно они расположены в хвосте железы. Бета-клетки островков вырабатывают инсулин, альфа-клетки – глюкагон, дельта-клетки – соматостатин. В экстрактах ткани поджелудочной железы обнаружены гормоны ваготонин и центропнеин.
Инсулин регулирует углеводный обмен, снижает концентрацию сахара в крови, способствует превращению глюкозы в гликоген в печени и мышцах. Он повышает проницаемость клеточных мембран для глюкозы: попадая внутрь клетки, глюкоза усваивается. Инсулин задерживает распад белков и превращение их в глюкозу, стимулирует синтез белка из аминокислот и их активный транспорт в клетку, регулирует жировой обмен путем образования высших жирных кислот из продуктов углеводного обмена, тормозит мобилизацию жира из жировой ткани.
В бета-клетках инсулин образуется из своего предшественника проинсулина. Он переносится в клеточные аппарат Гольджи, где происходят начальные стадии превращения проинсулина в инсулин.
В основе регуляции инсулина лежит нормальное содержание глюкозы в крови: гипергликемия приводит к увеличению поступления инсулина в кровь, и наоборот.
Паравентрикулярные ядра гипоталамуса повышают активность при гипергликемии, возбуждение идет в продолговатый мозг, оттуда в ганглии поджелудочной железы и к бета-клеткам, что усиливает образование инсулина и его секрецию. При гипогликемии ядра гипоталамуса снижают свою активность, и секреция инсулина уменьшается.
Гипергликемия непосредственно приводит в возбуждение рецепторный аппарат островков Лангерганса, что увеличивает секрецию инсулина. Глюкоза также непосредственно действует на бета-клетки, что ведет к высвобождению инсулина.
Глюкагон повышает количество глюкозы, что также ведет к усилению продукции инсулина. Аналогично действует гормоны надпочечников.
Вегетативная нервная система регулирует выработку инсулина посредством блуждающего и симпатического нервов. Блуждающий нерв стимулирует выделение инсулина, а симпатический тормозит.
Количество инсулина в крови определяется активностью фермента инсулиназы, который разрушает гормон. Наибольшее количество фермента находится в печени и мышцах. При однократном протекании крови через печень разрушается до 50 % находящегося в крови инсулина.
Важную роль в регуляции секреции инсулина выполняет гормон соматостатин, который образуется в ядрах гипоталамуса и дельта-клетках поджелудочной железы. Соматостатин тормозит секрецию инсулина.
Активность инсулина выражается в лабораторных и клинических единицах.
Глюкагон принимает участие в регуляции углеводного обмена, по действию на обмен углеводов он является антагонистом инсулина. Глюкагон расщепляет гликоген в печени до глюкозы, концентрация глюкозы в крови повышается. Глюкагон стимулирует расщепление жиров в жировой ткани.
Механизм действия глюкагона обусловлен его взаимодействием с особыми специфическими рецепторами, которые находятся на клеточной мембране. При связи глюкагона с ними увеличивается активность фермента аденилатциклазы и концентрации цАМФ, цАМФ способствует процессу гликогенолиза.
Регуляция секреции глюкагона. На образование глюкагона в альфа-клетках оказывает влияние уровень глюкозы в крови. При повышении глюкозы в крови происходит торможение секреции глюкагона, при понижении – увеличение. На образование глюкагона оказывает влияние и передняя доля гипофиза.
Гормон роста соматотропин повышает активность альфа-клеток. В противоположность этому гормон дельта-клетки – соматостатин тормозит образование и секрецию глюкагона, так как он блокирует вхождение в альфа-клетки ионов Ca, которые необходимы для образования и секреции глюкагона.
Физиологическое значение липокаина. Он способствует утилизации жиров за счет стимуляции образования липидов и окисления жирных кислот в печени, он предотвращает жировое перерождение печени.
Функции ваготонина – повышение тонуса блуждающих нервов, усиление их активности.
Функции центропнеина – возбуждение дыхательного центра, содействие расслаблению гладкой мускулатуры бронхов, повышение способности гемоглобина связывать кислород, улучшение транспорта кислорода.
Нарушение функции поджелудочной железы.
Уменьшение секреции инсулина приводит к развитию сахарного диабета, основными симптомами которого являются гипергликемия, глюкозурия, полиурия (до 10 л в сутки), полифагия (усиленный аппетит), полидиспепсия (повышенная жажда).
Увеличение сахара в крови у больных сахарным диабетом является результатом потери способности печени синтезировать гликоген из глюкозы, а клеток – утилизировать глюкозу. В мышцах также замедляется процесс образования и отложения гликогена.
У больных сахарным диабетом нарушаются все виды обмена.
31. Гормональная регуляция обмена кальция в организме.
Ионы Са2+ принимают участие в формировании многих структур организма, в регуляции течения метаболических процессов. Функции кальция. Участие в контактном узнавании клеток за счет образования катионных Са2+ мостиков. Стабилизация формы клеток в результате взаимодействия с компонентами клеточных мембран и цитоскелета. Регуляция проницаемости мембран нейронов и миоцитов. Участие в мышечном сокращении. Стимуляция биосинтетических и секреторных процессов. Регуляция активности ряда ферментов. Регуляция окислительного фосфорилирования. Стимуляция свертывания крови. Опосредование эффектов ряда гормонов. Концентрация Са в крови стабильна, ее колебания не превышают 3%. В плазме крови содержится 2,4 – 4 ммоль/л (9-11 мг%) кальция. Уровень кальция зависит от функционального состояния 3 структур организма: Костного аппарата – резервуара Са. Тонкого кишечника, который обеспечивает всасывание Са и его реабсорбцию. Почек, в которых осуществляется реабсорбция ионов кальция и фосфора. Уровень кальция в организме контролируется 2 гормонами: паратгормоном и кальцитонином, а также витамином 1,25 (ОН)2 D3. Паратгормон обладает гиперкальциемическим действием и одновременно снижает концентрацию фосфатов в крови. В кости паратгормон стимулирует мобилизацию и выход в кровь Са2+. В кишечнике паратгормон усиливает всасывание Са2+ в кровь. В почках паратгормон усиливает реабсорбцию Са2+ в дистальных сегментах извитых канальцев и тормозит реабсорбцию фосфатных ионов в проксимальных отделах канальцевого аппарата. Паратгормон стимулирует в почках синтез 1,25 (ОН)2 D3 из малоактивного 25-ОН-D3. 1,25 (ОН)2D3 витамин усиливает всасывание Са2+ и фосфатов в слизистой тонкого кишечника, мобилизует Са2+ и фосфаты из костной ткани и увеличивает реабсорбцию Са2+ в почках. Кальцитонин – гипокальцемический гормон. В костной ткани кальцитонин способствует отложению Са2+. Замедляет всасывание Са и фосфатов из кишечника. В почках кальцитонин препятствует реабсорбции Са2+. В отношении уровня фосфатов в крови кальцитонин и паратгормон являются синергистами: оба гормона вызывают гипофосфатемию. Отклонения в концентрации Са2+ в крови, превышающие 3-5%, приводят к специфическому изменению интенсивности функционирования желез, секретирующих паратгормон и кальцитонин. Повышение уровня ионов Са2+ в крови стимулирует секрецию кальцитонина и торможение секреции паратгормона и 1,25 (ОН)2D3. Повышение уровня ионов Са2+ в крови стимулирует секрецию паратгормона и витамина D3 и тормозит секрецию кальцитонина. Гипокальцемия – онемение и покалывание в пальцах и оклоротовой области, гиперреактивные рефлексы, спазмы мышц, тетания, судороги. У новорожденных могут наблюдаться летаргия и плохое сосание. При хронической гипокальцемии происходят переломы костей как следствие остеопороза. Гиперкальцемия может сопровождаться кальцификацией мягких тканей. Образуются фосфаты кальция, которые откладываются во всех органах.
32. Кислотно-щелочное равновесие, его физиологические показатели. Механизмы компенсации нарушений кислотно-щелочного равновесия буферными системами крови.
Кислотно-щелочное равновесие — относительное постоянство концентрации водородных ионов во внутренних средах организма, обеспечивающее полноценность метаболических процессов, протекающих в клетках и тканях.
Нормальная реакция крови должна быть слабощелочной. В норме кислотно-щелочное равновесие (КЩР) соответствует pH, равному 7,35–7,45. Если рН выше 7,45, это состояние характеризуется как защелачивание организма (алкалоз). Если рН ниже 7,35, это свидетельствует о закислении организма (ацидозе). Желудочно-кишечный тракт может нормально работать только при слабощелочной реакции крови, которую мы будем называть нормальной.
Состояние кислотно-щелочного равновесия легко определить по цвету конъюнктивы (оболочки, покрывающей внутреннюю поверхность век на обоих глазах). Ярко-розовый цвет конъюнктивы соответствует тому, что pH находится в норме. Бледно-розовый цвет конъюнктивы свидетельствует об ацидозе, а темно-розовый — об алкалозе.
Парциальное напряжение углекислоты (РCO2) — парциальное давление углекислого газа над кровью находящегося в равновесии с растворенным СО2 в артериальной крови.
Буферные основания (БО) крови — общая сумма концентрации всех анионов цельной крови, обладающих буферными свойствами при условии полного насыщения крови кислородом, 38°С и P CO2 = 40 мм рт.ст.
| Показатель и его обозначение | Характеристика | Метод исследования и материал | Единица измерения | Абсолютная величина в норме | |
| рН | Отрицательный десятичный логарифм концентрации водородных ионов | Потенциометрический: артериальная и венозная кровь | -lg10 | 7,36—7,42 (артериальная) | |
| 7,26—7,36(венозная) | |||||
| Парциальное давление углекислого газа в крови (рСО2) | Парциальное давление углекислого газа в газовой смеси, уравновешенной с кровью; отражает концентрацию СО2, растворенного в плазме крови (в т.ч. и гидратированного СО2) | Потенциометрическое измерение селективным электродом, определение по номограмме | кПа | 4,7—6,0 (♂) | |
| 4,3—5,7 (♀) | |||||
| мм рт. ст. | 35—45 (♂) | ||||
| 32—43 (♀) | |||||
| Парциальное давление кислорода в крови (рО2) | Парциальное давление кислорода в газовой смеси, уравновешенной с кровью; отражает концентрацию О2 растворенного в плазме крови | Потенциометрический; артериальная кровь | кПа | 31,1—11,4 (до 40 лет) | |
| 9,6—13,7 (старше 40 лет) | |||||
| мм рт. ст. | 83—108 (до 40 лет) | ||||
| 72—104 (старше 40 лет) | |||||
| Общее содержание СО2 в крови (прежнее название — щелочной резерв) | Концентрация общей углекислоты в крови и плазме, т.е. ее ионизированной фракции (ионы бикарбоната, карбамата и карбоната) и неионизированной фракции, содержащей в основном безводный углекислый газ и угольную кислоту | Газометрическое определение; артериальная и капиллярная кровь | ммоль/л | 24,6—28,6 (♂) | |
| 22,7—28,5 (♀) и | |||||
| 19,84—24,76 (♂) | |||||
| 18,93—24,87 (♀) | |||||
| Стандартный бикарбонат плазмы крови | Концентрация бикарбонатных ионов в пробе крови, уравновешенной при 37° со стандартной газовой смесью при рСО2 — 40 мм рт. ст. и рО2 более 100 мм рт. ст. | Артериальная кровь | ммоль/л | 22,5—26,9 (♂) | |
| 21,8—26,2 (♀) | |||||
| Актуальные (истинные) бикарбонаты крови | Концентрация бикарбонатных ионов в плазме крови в физиологических условиях (при 38° в плазме крови, взятой без соприкосновения с воздухом) | Артериальная кровь | ммоль/л | 23,6—27,2 (♂) | |
| 21,8—27,2 (♀) | |||||
| Буферные основания (buffer base; ВВ) | Концентрация ионов бикарбоната и анионов белков (буферных оснований) в цельной крови, определяемая путем титрования до изоэлектрической точки белков при рСО2 равном 0 | Определение по номограмме; капиллярная кровь | ммоль/л | 43,7—53,5 | |
| Избыток оснований (base excess; BE) | Разница между концентрацией сильных оснований в крови и в той же крови, оттитрованной сильной кислотой или сильным основанием до рН 7,4 при рСО2 40 мм рт. ст. и 37°. Положительные величины свидетельствуют об относительном дефиците некарбоновых кислот, потере ионов Н+; отрицательные величины — об относительном избытке некарбоновых кислот и ионов Н+ | Капиллярная кровь | ммоль/л | От -2,7 до +2,5 (♂) | |
| Определение по номограмме; артериальная кровь | |||||
Устранение сдвига рН в организме осуществляется с помощью физико-химических и физиологических механизмов регуляции. Первыми включаются буферные системы крови.
а) бикарбонатный буфер, который состоит из Н2СО3 и NaHCO3 = 1: 20;
б) гемоглобиновый буфер: HbO2 и HbH;
в) фосфатный буфер: NaH2PO4:Na2HPO4 = 1:4;
г) белковый буфер.
Бикарбонатная буферная система – мощная и самая управляемая система внеклеточной жидкости и крови. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови.
Представляет собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты Н2СО3, выполняющую роль донора протона, и бикарбонат-иона НСО3–, выполняющего роль акцептора протона:
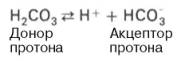
Механизм действия: при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н+ взаимодействуют с ионами бикарбоната НСО3–, что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Последующее снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 через легкие в результате их гипервентиляции (напомним, что концентрация Н2СО3 в плазме крови определяется давлением СО2 в альвеолярной газовой смеси). Если в крови увеличивается количество оснований, то они, взаимодействуя со слабой угольной кислотой, образуют ионы бикарбоната и воду. При этом не происходит сколько-нибудь заметных сдвигов в величине рН. Кроме того, для сохранения нормального соотношения между компонентами буферной системы в этом случае подключаются физиологические механизмы регуляции кислотно-основного равновесия: происходит задержка в плазме крови некоторого количества СО2 в результате гиповентиляции легких.
Фосфатная буферная система представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4– (донор протонов) и иона НРО42– (акцептор протонов):
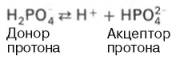
Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли двузамещенный фосфат – Na2HPO4. Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. В других тканях эта система является одной из основных.
В итоге рН крови сохраняется неизменным. Фосфаты выполняют буферную роль главным образом во внутриклеточной среде (особенно клеток канальцев почек) и поддерживают исходное состояние бикарбонатного буфера.
Белковая буферная система имеет меньшее значение для поддержания КОР в плазме крови, чем другие буферные системы.
Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок–Н+ (кислота, донор протонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4.
Обладая амфолитными свойствами, в кислой среде они ведут себя как основания, а в щелочной среде — как кислоты. Белковая буферная система состоит из слабодиссоциирующего белка с кислым свойствами (белок-СООН) и белка в комплексе с сильными основаниями (белок-COONa).
Гемоглобиновая буферная система – самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови.
Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Константа диссоциации кислотных групп гемоглобина меняется в зависимости от его насыщения кислородом. При насыщении кислородом гемоглобин становится более сильной кислотой (ННbО2). Гемоглобин, отдавая кислород, превращается в очень слабую органическую кислоту (ННb).
Буферные свойства гемоглобина прежде всего обусловлены возможностью взаимодействия кисло реагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина: КНb + Н2СO3—> КНСO3 + ННb.
Именно таким образом превращение калийной соли гемоглобина эритроцитов в свободный ННb с образованием эквивалентного количества бикарбоната обеспечивает поддержание рН крови в пределах физиологически допустимых величин
Буферные системы крови играют важную роль в регуляции кислотно-основного равновесия. Как отмечалось, в этом процессе, помимо буферных систем крови, активное участие принимают также система дыхания и мочевыделительная система.
Лёгкие обеспечивают устранение или уменьшение сдвигов КЩР путём изменения объёма альвеолярной вентиляции.
Причиной изменения объёма дыхания является прямое или рефлекторное изменение возбудимости нейронов дыхательного центра.
Снижение рН в жидкостях организма является специфическим рефлекторным стимулом увеличения частоты и глубины дыхательных движений. Вследствие этого лёгкие выделяют избыток С02 (образующийся при диссоциации угольной кислоты). Повышение рН в жидких средах организма снижает возбудимость инспираторных нейронов дыхательного центра. Это приводит к уменьшению альвеолярной вентиляции и выведению из организма С02, т.е. к гиперкапнии. В связи с этим в жидких средах организма возрастает уровень угольной кислоты, диссоциирующей с образованием Н+, — показатель рН снижается. Следовательно, система внешнего дыхания довольно быстро (в течение нескольких минут) способна устранить или уменьшить сдвиги рН и предотвратить развитие ацидоза или алкалоза: увеличение вентиляции лёгких в 2 раза повышает рН крови примерно на 0,2; снижение вентиляции на 25% может уменьшить рН на 0,3-0,4.
легкие (ежесуточно выводят 850 г Н2СО3);
Почки регулируют кислотно-щелочное равновесие, выделяя кислую или щелочную мочу. Выделение кислой мочи снижает общее количество кислых продуктов во внеклеточной жидкости, как и выделение оснований снижает их содержание в жидких средах организма.
В просвет канальцев путем фильтрации непрерывно поступает большое количество ионов НСО3, выделение которых в конечную мочу удаляет основания из плазмы. Эпителиоциты выделяют в просвет канальцев также большое количество ионов Н+, таким образом удаляя их из крови. Если количество выделенных ионов Н+ превысит число ионов бикарбоната, попавших в первичную мочу, внеклеточная жидкость в сумме потеряет больше кислых продуктов. И наоборот, если количество ионов НСО3, попавших в просвет канальца, превысит секрецию протонов, в сумме возникнет дефицит оснований.
Почки обладают способностью выводить как избыток кислот, так и щелочей. Почки могут реабсорбировать бикарбонаты.
Нарушения кислотно-щелочного равновесия. В тех случаях, когда компенсаторные механизмы организма не могут предотвратить нарушения Кщр., развиваются два патологических состояния, противоположных по своей направленности: ацидоз и алкалоз.
Ацидоз и алкалоз могут возникнуть вследствие различных причин, но в основном к нарушению Кщр. приводят три патологических процесса:
-нарушение выведения углекислого газа легкими,
-избыточное образование кислых продуктов в тканях
-нарушение выведения из организма оснований с мочой и др.
Метаболический алкалоз характеризуется повышением рН крови и увеличением концентрации бикарбоната.
Компенсация метаболического алкалоза прежде всего осуществляется за счет снижения возбудимости дыхательного центра при повышении рН, что приводит к урежению частоты дыхания и возникновению компенсаторной гиперкапнии. Кислотность мочи и содержание аммиака в ней понижены.
Респираторный алкалоз характеризуется повышением рН и снижением рС02 крови. Связан с избыточным удалением С02 через лёгкие.
Вследствие понижения содержания угольной кислоты в артериальной крови происходит сдвиг в бикарбонатной буферной системе: часть бикарбонатов превращается в угольную кислоту. Снижение концентрации НСО3 происходит при участии гемоглобинового буферного механизма.
Метаболический ацидоз характеризуется снижением рН крови и уменьшением концентрации бикарбоната плазмы вследствие потерь бикарбоната или накопления других кислот, кроме угольной (например, молочной). Такой ацидоз может наблюдаться при сердечной недостаточности, многих типах гипоксии, нарушениях функций печени и почек по нейтрализации и экскреции кислых веществ, истощении буферных систем.
Респираторный ацидоз характеризуется снижением рН крови и повышением рС02 крови (более 40 мм рт.ст.). Респираторный ацидоз связан со снижением способности выделять С02 через лёгкие.

33. Состав крови. Эритроциты, их структура, физиологическое значение, старение и разрушение. Физиологические эритроцитозы.
Date: 2015-07-27; view: 1202; Нарушение авторских прав