
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Расчетная часть
|
|
Данные для расчета:
Температура катализатора на входе в реактор T0 = 625ºC;
Температура в реакторе T = 555ºC;
Объемная скорость по бутану VG = 210 час-1;
Коэффициент межфазного обмена β = 0,5 с-1;
Выход бутилена YB = 32 %;
Селективность SB = 72%.
1. Константы скоростей реакции первого порядка:
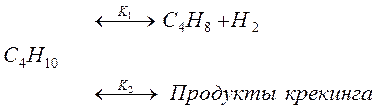
Находим константу скорости реакции первого порядка:
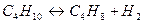 .
.
Через равновесные концентрации реагентов ее можно выразить:
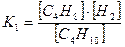 .
.
Далее в пересчете на 1 моль бутана в 1 литре:
Образуется бутилена:

Образуется водорода:
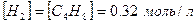
Найдем степень конверсии бутана:
 .
.
Откуда,
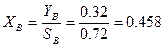
Тогда равновесная концентрация непрореагировавшего бутана:

Подставляя в выражение для K1, получим:
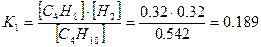
Для параллельных реакций зависимость констант скоростей реакций описывается выражением:
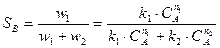 ;
;
где w1 и w2 – скорости протекания реакция дегидрирования и крекинга соответственно.
Так как порядок реакций дегидрирования равен порядку реакций крекинга, реакция дегидрирования и крекинга являются реакциями первого порядка, то SR не зависит от концентрации:
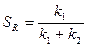 .
.
Откуда,
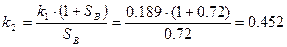
Сравним результат с данными полученными при расчете по эмпирической зависимости константы скорости реакции от температуры среды:
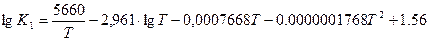
При T = 828 K (555ºC)
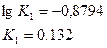
Откуда,
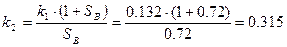
Сравнение результатов расчета:
| Рассчитано | Теоретическое | ε, % | |
| K1 | 0.189 | 0.132 | |
| K2 | 0.452 | 0.315 |
2. Размеры реактора дегидрирования
Условие:
расход бутана GB=12т/час;
плотность кипящего слоя ρ=700кг/м3;
размер частиц катализатора dз=0,05 мм;
скорость псевдоожижения Uп=0,05м/с;
число псевдоожижения φ=4.
Расход бутана.
Находим количество моль бутана в 12 тоннах:
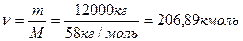
Находим объем бутана при давлении P=130 КПа (давление в реакторе дегидрирования), при температуре T=838К (температура в реакторе дегидрирования) по уравнению Менделеева-Клайперона:
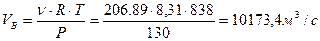
Тогда объемная скорость бутана в пересчете на секунду:
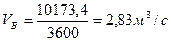
Линейная скорость бутана по условию Uп=0,05м/с, тогда площадь сечения аппарата:
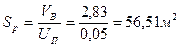
Откуда диаметр аппарата:
 .
.
Плотность бутана при условиях в реакторе:

Где М – молярная масса бутана, 58г/моль; Р – давление в реакторе, 130 КПа; R – газовая постоянная, 8,31 Дж/(моль*К); Т – температура в реакторе, 828К.
Найдем порозность псевдоожиженного слоя ε используя систему уравнений:
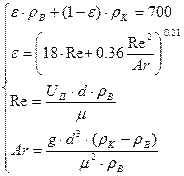
где ε – порозность кипящего слоя; ρв – плотность бутана при условиях в реакторе, 1,179 кг/м3; ρк – кажущаяся плотность катализатора; Uп – скорость псевдоожижения, 0,05м/с; d – диаметр частиц катализатора, 0,05мм; μ – динамическая вязкость бутана при условиях в реакторе,0,000373 пз.
Первое уравнение описывает плотность кипящего слоя, второе используется для нахождения порозности кипящего слоя, третье и четвертое для нахождения значения критериев описывающих гидродинамику потока.
Решаем систему уравнений:
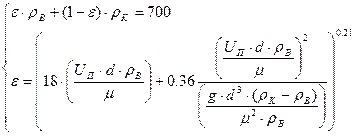
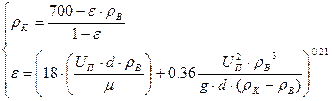

Находим решение уравнения
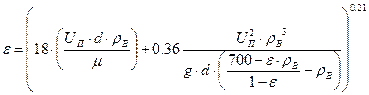
Методом итераций:
| ε | ƒ(ε) | Δ |
| 0,6653 | 0,66542 | -0,00011983 |
| 0,6654 | 0,665419 | -0,00001941 |
| 0,6655 | 0,665419 | 0,00008101 |
| 0,6656 | 0,665419 | 0,00018143 |
| 0,6657 | 0,665418 | 0,00028185 |
Порозность слоя ε =0,665
Объем занимаемый катализатором:

Где VВ – объемный расход бутана, 10173,4 м3/час; VG – объемная скорость по бутану, 210 час-1.
Объем реактора:
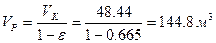
Высота реактора:

Рассчитанные размеры плохо согласуются с теоретическими данными:
Диаметр 5,9-6,4 м
Высота 29-34 м
Объем 792-1100 м3.
Список литературы.
1. Минскер К. С., Сангалов Ю. А. Изобутилен и его полимеры. М.: Химия, 1986.
2. Адельсон С. В., Вишнякова Т. П., Паушкин Я. М. Технология нефтехимического синтеза. М.: Химия, 1985.
3. Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза. М.: Химия, 1988.
4. Паушкин Я. М., Адельсон С. В., Вишнякова Т. П. Технология нефтехимического синтеза. М.: Химия, 1973.
5. Огородников С. К. Справочник нефтехимика. Л.: Химия, 1978.
6. Жоров
7. Барон Н. М., Пономарёва А.М., Равдель А.А. Краткий справочник физико-химических величин. СПб.: «Иван Фёдоров», 2002.
8. Сарданашвили А. Г., Львова А. И. Примеры и задачи по технологии переработки нефти и газа. М.: «Химия», 1980.
Date: 2015-07-27; view: 1019; Нарушение авторских прав