
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Соединения серы в тропосфере
|
|
Основные поступления неорганических соединений серы в тропосферу связаны с антропогенными источниками. На их долю приходится примерно 65% всех поступлений неорганических соединений серы в атмосферу. 95% от этого количества составляет диоксид серы. В тропосфере происходят процессы окисления соединений серы, основным окислителем в которых выступают свободные радикалы. Сероводород последовательно через ряд стадий окисляется до SO2. Окисление диоксида серы может протекать в газовой, твердой либо жидкой фазе. Протекающие при этом процессы можно представить следующими уравнениями реакций:
SO2 + OH + M = HSO3 + M* (56)
HSO3 + HO2 = SO3 + 2OH (57)
SO2 + HO2 = SO3 + OH (58)
SO2 + CH3 O2 = SO3 + CH3O (59)
Скорость превращений диоксида серы в воздухе, в среднем 0,1% ч-1, что соответствует времени пребывания SO2 в тропосфере, равно 5 суткам. Процесс превращения диоксида серы резко ускоряется в воздухе промышленных регионов, где увеличивается содержание свободных радикалов. В таком случае скорость превращения может возрасти до 1% ч-1.
Триоксид серы – SO3 – легко взаимодействует с частицами атмосферной влаги и образует растворы серной кислоты, которые взаимодействуя с аммиаком или ионами металлов, частично переходят в соответствующие сульфаты. Оксиды железа, алюминия, хрома и других металлов, которые также могут находиться в сильно запыленном воздухе, ускоряют процесс окисления диоксида серы.
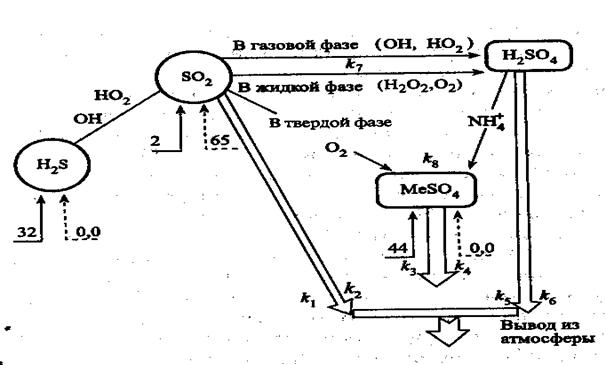
Рис. 3. Трансформация неорганических соединений серы в тропосфере (числа – млн т элементной серы в год).
Скорость процессов трансформации и стока диоксида серы, серной кислоты и сульфатов приято представлять в виде кинетических уравнений первого порядка.
v(SO2) = - d[SO2] /dt = -(k1 + k2 + k7)[SO2] (60)
v(H2SO4) = - d[H2SO4] /dt = k7[SO2] -(k5 + k6 + k8)[H2SO4] (61)
v(MeSO4) = - d[MeSO4] /dt = k8[H2SO4] -(k3 + k4)[MeSO4] (62),
где t – время; [SO2], [H2SO4], [MeSO4] – концентрации диоксида серы, серной кислоты и сульфатов соответственно; k1 и k2, k3 и k4, k5 и k6 – константы скорости процессов мокрого и сухого осахдения диоксида серы, сульфатов и серной кислоты соответственно (см. рис); k7 - константы скорости процесса трансформации диоксида серы в серную кислоту (учитывает сумму превращений в газовой и жидкой фазах); k 8 - константа скорости образования сульфатов из SO2 и H2SO4. Решая систему уравнений (60) – (62) можно определить долю отдельных компонентов, присутствующих в тропосфере через определенное время после разового выброса диоксида серы в атмосферу. Среднеевропейские значения соответствующих констант: k1 = k4= k6 = k8 = 0,03 ч-1;
k2 = 0,025 ч-1; k3 = k5 =0,01 ч-1; k7 = 0,1 ч -1.
Соединения азота в тропосфере – в основном это оксиды азота, аммиак, соли аммония, азотная кислота и нитраты. Из оксидов азота следует выделить N2O, NO и NO2. Другие оксиды азота в условиях тропосферы являются неустойчивыми.
N2O - поступает в атмосферу в основном в результате протекания процессов денитрификации.
Выводится N2O из атмосферы в основном в процессах фотодиссоциации:
N2O + hν = N2 + O, λ< 250 нм (63)
N2O + O(1D) = N2 + O2, (64)
N2O + O(1D) = 2NO (65)
Константы скорости реакций (64) и (65) при 298 К равны 7,4∙10-11 и 8,6∙10-11см3с-1.
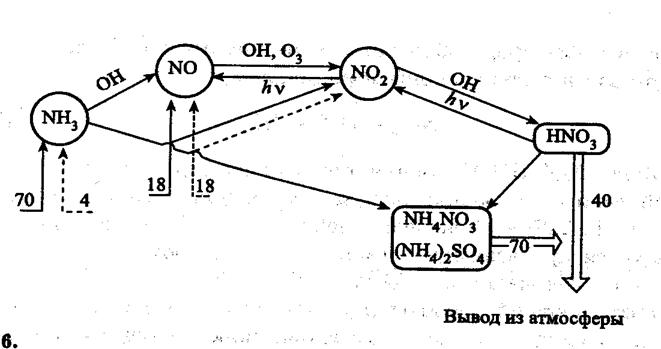
Рис. 4. Атмосферный цикл соединений азота (числа –млн т элементного азота в год.
В тропосфере NO взаимодействует с гидропероксидными радикалами:
NO + O3 = NO2 + OH
NO + O3 = NO2 + O2
Диоксид азота в тропосфере разлагается:
NO2 + hν = NO + O(3P), λ< 398 нм
В атмосферном цикле соединений азота важной составляеющей является образование азотной кислоты:
NO2 + OH = HNO3
Часть азотной кислоты разлагается:
HNO3 = NO2 + OH или
HNO3 + OH = NO3 + H2О
Основное количество азотной кислоты выводится из тропосферы с атмосферными осадками в виде растворов HNO3 и её солей.
Ежегодно из природных источников в атмосферу поступает около 70 млн т NH3 в пересчете на азот. Антропогенный вклад в загрязнение атмосферы аммиаком составляет около 4 млн т. Часть аммиака вступает во взаимодействие с радикалами (в основном с гидроксидным радикалом):
NH3 + OH = NH2 + H2О
В дальнейшем NH2 легко окисляется до оксида азота.
Date: 2015-07-22; view: 2963; Нарушение авторских прав