
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Окисники
|
|
Тільки окисникамиє:
– хімічні сполуки, що містять атоми елементів з найвищим позитивним ступенем окиснення:
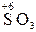 ,
, 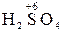 ,
, 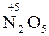 ,
, 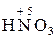 ,
, 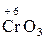 ,
, 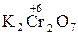 ,
,  ,
, 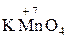 ;
;
– атоми і молекули Флюору й Оксигену (крім сполук з флюором 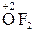 ).
).
3.3. Елементи, що виявляють окисні
і відновні властивості
Слід запам'ятати, що в окисно-відновних реакціях деякі елементи можуть виступати залежно від умов і окисниками, і відновниками.
До них відносять:
– атоми і молекули неметалів головних підгруп ІV – VІІ груп, а також Бор і Гідроген.
Наприклад:

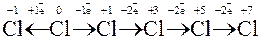
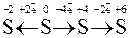
відновлення окиснення
– атоми елементів у сполуках з проміжним (між нижчим і вищим) ступенем окиснення: 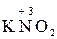 ,
, 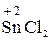 ,
, 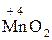 та ін.
та ін.
Окисно-відновні властивості елементів і їх сполук зручно простежити на прикладі сполук Мангана:



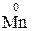 →
→  →
→ 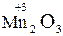 →
→  →
→ 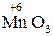 →
→ 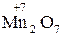
тільки окисники і відновники тільки
відновник окисник
Контрольні питання та завдання
1. Чим визначаються окисно-відновні властивості елементів та сполук?
2. Чому деякі елементи можуть бути і окисниками, і відновниками?
3. Визначте, яку окисно-відновну функцію проявляють хімічні сполуки, що містять атоми елементів з найвищим позитивним або негативним ступенем окиснення.
4. ОКИСНІ ВЛАСТИВОСТІ КИСЛОТ
Усі кислоти (крім НNO3 і концентрованої Н2SО4) є окисниками за рахунок водневих іонів Н+, що утворюються при дисоціації у водних розчинах. Взаємодія цих кислот з відновниками супроводжується виділенням газоподібного водню:
Fе + 2НСІ = FеСІ2 + Н2. (25)


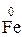 – 2
– 2 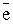 =
= 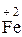 1 – окиснення, відновник Fe;
1 – окиснення, відновник Fe;
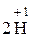 + 2
+ 2 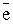 =
= 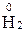 1 – відновлення, окисник HCl.
1 – відновлення, окисник HCl.
 За такою схемою протікають реакції поміж вказаними кислотами і металами, що знаходяться у ряду активності до гідрогену.
За такою схемою протікають реакції поміж вказаними кислотами і металами, що знаходяться у ряду активності до гідрогену.
Аніони нітратної і концентрованої сульфатної кислот є більш сильними окисниками, ніж іон 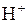 . Тому при їх взаємодії з металами або неметалами водень не виділяється, а утворюються речовини з меншим ступенем окиснення: Нітрогену від
. Тому при їх взаємодії з металами або неметалами водень не виділяється, а утворюються речовини з меншим ступенем окиснення: Нітрогену від 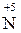 до
до 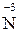 і Сульфуру від
і Сульфуру від  до
до 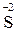 .
.
При взаємодії металів з нітратною кислотою утворюється сіль, вода і продукт відновлення нітрогену 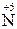 , тип якого визначається активністю металу і концентрацією кислоти.
, тип якого визначається активністю металу і концентрацією кислоти.
Усі метали, що знаходяться в ряду активності, умовно можна розбити на дві групи: від літію до феруму – активні метали, від феруму (включно) і далі – неактивні.
Активні метали залежно від концентрації кислоти відновлюють Нітроген 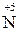 до
до 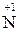 ,
, 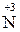 , а неактивні – до
, а неактивні – до 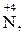
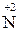 .
.
 конц MeNO3 + H2O +
конц MeNO3 + H2O + 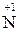 2O (N2);
2O (N2);
Me (акт) + HNO3 (26)
розбав MeNO3 + H2O +  H4NO3;
H4NO3;
 конц MeNO3 + H2O +
конц MeNO3 + H2O + 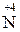 O2;
O2;
Me (неакт) + HNO3 (27)
розбав MeNO3 + H2O + 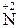 O.
O.
Взаємодія активних металів з концентрованою сульфатною кислотою приводить до утворення H2S або S, а неактивних – SO2:
 Ме (акт) MeSO4 + H2O + H2
Ме (акт) MeSO4 + H2O + H2 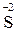 (S);
(S);
 Me + H2SO4 (конц) (28)
Me + H2SO4 (конц) (28)
Ме (неакт) MeSO4 + H2O + 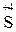 О2.
О2.
Контрольні питання та завдання
1. Чи виділяється газоподібний водень під час взаємодії нітратної та концентрованої сульфатної кислот з металами?
2. Що виконує роль окисника у молекулах нітратної та концентрованої сульфатної кислот?
3. Назвіть продукти реакції розбавленої нітратної кислоти з активними металами.
4. У чому полягають особливості складання рівнянь окисно-відновних реакцій металів з нітратною та концентрованою сульфатною кислотами?
Приклади розв’язання типових задач
1. Визначте коефіцієнти в окисно-відновній реакції, укажіть процеси, а
також напишіть, яка речовина є окисником, яка відновником:
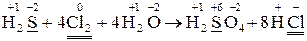 ;
;


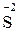 – 8
– 8 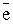 =
=  1 – процес окиснення, відновник
1 – процес окиснення, відновник 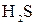 ;
;
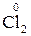 + 2
+ 2 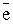 =
= 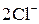 4 – процес відновлення, окисник
4 – процес відновлення, окисник 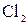 ;
;
 |
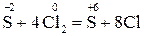 ¯.
¯.
2. Закінчіть окисно-відновну реакцію:
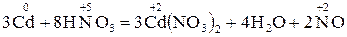 ;
;


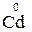 – 2
– 2 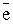 =
= 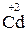 3 – процес окиснення, відновник
3 – процес окиснення, відновник 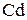 ;
;
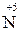 + 3
+ 3 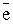 =
= 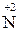 2 – процес відновлення, окисник
2 – процес відновлення, окисник 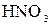 ;
;
 |
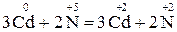 .
.
Питання для самоперевірки
1. Умови і характер перебігу окисно-відновного процесу. Як залежить
перебіг окисно-відновного процесу від реакції середовища? Наведіть приклади.
2. Перелічте типи окисно-відновних реакцій.
3. Що спільного між ступенем окиснення та валентністю і в чому
відмінність між ними?
4. Що таке окиснення та відновлення?
5. У чому суть методу електронного балансу?
6. Що означає ступінь окиснення елемента? Чим треба користуватися при обчисленні ступеня окиснення елемента у сполуці?
7.Визначіть окисник, відновник, процеси окиснення і відновлення, а також коефіцієнти в наступних рівняннях окисно-відновних реакцій:
7.1. H2S + K2Cr2O7 + H2SO4 ® S + Cr2(SO4)3 + K2SO4 + H2O
7.2. PbO2 +MnSO4 + H2SO4 ® HMnO4 +PbSO4 + H2O
7.3. MnO2 + KClO3 + KOH ® K2MnO4 + KCl + H2O
7.4. NaCrO2 + Br2 + NaOH ® Na2CrO4 + NaBr + H2O
7.5. K2Cr2O7 + SnSO4 + H2SO4 ® Cr2(SO4)3 + Sn(SO4)2 + H2O + K2SO4
7.6. Mg + H2SO4 ® MgSO4 + H2S + H2O
7.7. Cu + HNO3 ® Cu(NO3)2 + NO2 + H2O
7.8. Ni + H2SO4 ® NiSO4 + SO2 + H2O
7.9. Fe + HNO3 ® Fe(NO3)3 + NO + H2O
7.10. Co + HNO3 ® Co(NO3)2 + N2 + H2O
Date: 2015-07-24; view: 528; Нарушение авторских прав