
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Йонно-електронний метод. Для складання рівнянь окисно-відновних реакцій застосовують також йонно-електронний метод
|
|
Для складання рівнянь окисно-відновних реакцій застосовують також йонно-електронний метод.
1. Рівняння реакції записують йонно-електронними напівреакціями:



 6 1 – відновлення, окисник
6 1 – відновлення, окисник 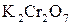 ;
;
6 (23)
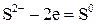 2 3 – окиснення, відновник
2 3 – окиснення, відновник 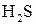 ;
;

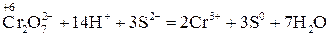 .
.
Перше рівняння відновлення біхромат іона показує, що під час перетворення йона 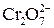 на катіон
на катіон 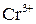 сім атомів Оксигену повинні зв'язуватися з 14 йонами Гідрогену (кисле середовище), утворюючи 7 молекул води.
сім атомів Оксигену повинні зв'язуватися з 14 йонами Гідрогену (кисле середовище), утворюючи 7 молекул води.
Друге рівняння процесу окиснення Сірки показує, що цей процес відбувається без участі йонів Гідрогену.
2. Знайшовши спільний множник (6) для цих двох йонно-електронних рівнянь і помноживши кожне з них на відповідні коефіцієнти (1 та 3), дістають сумарне йонне рівняння даної окисно-відновної реакції. Вірність сумарного рівняння перевіряють за тими ж ознаками, що і в методі електронного балансу, тільки напослідок перевіряють не суму ступенів окиснення, а суму зарядів йонів у обох частинах: (2−) + (14+) + 3(2−) = 2(3+) + 3(0) → (6+) = (6+).
3. Знайдені коефіцієнти переносять у вихідне молекулярне рівняння, а потім згідно з методом електронного балансу визначають число молекул H2SO4 (4) та H2O (7):
K2Cr2O7 + 3H2S + 4H2SO4 → Cr2(SO4)3 + 3S + K2SO4 + 7H2O. (24)
Контрольні питання та завдання
1. На чому базується метод електронного балансу?
2. Назвіть послідовність дій під час визначення коефіцієнтів у рівняннях окисно-відновних реакцій методом електронного балансу.
3. У чому особливість деяких міжмолекулярних реакцій, у яких окисник або відновник одночасно є і середовищем?
3. ОКИСНИКИ І ВІДНОВНИКИ
Окисно-відновну здатність елементів якісно можна оцінювати за їх положенням у періодичній системі Д.І. Менделєєва, величинами енергії іонізації та електронегативності. Необхідно знати, що згідно з окисно-відновною функцією елементи розподіляють на три групи:
– тільки відновники;
– тільки окисники;
– окисники або відновники залежно від умов.
3.1. Відновники
Тільки відновниками можуть бути:
– вільні атоми металів усіх сімейств: s, р, d, f;
– хімічні сполуки, що містять неметалеві елементи головних підгруп
ІV–VІІ груп у формі існування з найбільш негативним ступенем окиснення:
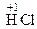 ,
, 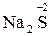 ,
, 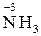 ,
, 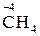 та ін.
та ін.
Date: 2015-07-24; view: 688; Нарушение авторских прав