
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретичні відомості. Матеріальні тіла є джерелами електромагнітного випромінювання
|
|
Матеріальні тіла є джерелами електромагнітного випромінювання. При зіткненні один з одним атоми і молекули отримують енергію, завдяки чому переходять у збуджений стан. Потім цю енергію вони випромінюють. Таким чином, джерелом енергії при тепловому випромінюванні є кінетична енергія теплового руху атомів і молекул.
На початку ХХ століття було з'ясовано, що спектр випромінювання молекул складається із широких розмитих смуг без різких границь. Такі спектри називаються смугастими. Спектри випромінювання атомів складаються з окремих різких ліній і називаються лінійчатими. Для кожного елемента існує цілком визначений випромінюваний їм лінійчатий спектр. У такий спосіб за спектром можна визначити елемент, якому він належить.
Закономірності в атомних спектрах. Лінії в спектрах розташовуються закономірно. Окремі лінії в спектрах можуть бути об'єднані в групи ліній, що називаються серіями (рис.1.1).
Наприклад, Лайман відкрив серію ліній, що лежать в ультрафіолетовій частині спектра атома водню
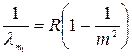 , (m =2, 3, 4…), (1.1)
, (m =2, 3, 4…), (1.1)
- де 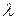 - довжина хвилі випромінювання відповідної лінії;
- довжина хвилі випромінювання відповідної лінії;
R- стала величина,
m - номер рівня, з якого здійснюється перехід.

Рис. 1.1. Рівні енергії атома водню
Бальмер відкрив, що лінії у видимій частині спектра водню можна представити формулою
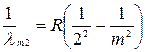 (m =3, 4, 5…). (1.2)
(m =3, 4, 5…). (1.2)
В інфрачервоній частині спектра атома водню було відкрито серії:
Пашена 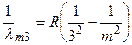 (m =4, 5, 6…), (1.3)
(m =4, 5, 6…), (1.3)
Брекета 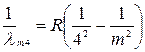 (m =5, 6, 7…), (1.4) Пфунда
(m =5, 6, 7…), (1.4) Пфунда 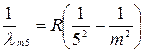 (m =6, 7, 8…). (1.5)
(m =6, 7, 8…). (1.5)
З формул (1.1-1.5) випливає, що довжини хвиль спектральних ліній атома водню, які випромінюються при переході атома з рівня m на рівень n, у загальному випадку можуть бути визначені за допомогою формули:
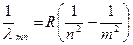 . (1.6)
. (1.6)
Формула (1.6) відома у спектроскопії з 1885 року. Вона одержана емпіричним шляхом і називається формулою Бальмера. Формула Бальмера вірно описує експериментально одержані значення довжин хвиль спектральних ліній атома водню при R =1,097373∙107 м-1 (стала Рідберга).
У даній роботі досліджується серія Бальмера, лінії якої знаходяться у видимій частині спектру. Для серії Бальмера n = 2. Для перших чотирьох ліній цієї серії m приймає значення 3, 4, 5 i 6. Ці лінії прийнято умовно позначати як H a, H b, H g, H d.
Градуювання спектрометра. Для роботи зі спектрометром УМ-2 його необхідно попередньо проградуювати. Для градуювання зазвичай користуються ртутною лампою. Але, оскільки червона лінія спектру ртуті дуже слабка, для більш точного градуювання приладу доцільно скористатися неоновою лампою, тому що спектр неону багатий на червоні смуги різних відтінків.
Градуювання вимагає побудови відповідної кривої (графіка), де по осях відкладаються градусні поділки барабану (вісь X) та довжини хвиль відповідних ліній спектру (вісь У). Графік доцільно будувати великомасштабним на міліметровому папері. Дані для графіка одержуються шляхом спостереження спектральних ліній ртуті i неону, зняттям показників барабану у градусах та відповідності їх табличним значенням (табл.1.1) довжин хвиль.
Інколи при побудові графіка спостерігаються точки, що не належать головній кривій. Це пояснюється помилковим розшифруванням спостережуваної картини спектральних ліній. У цьому випадку необхідно більш уважно порівняти спостережувану картинку з таблицею i відповідно до цього скорегувати градуювальний графік.
Необхідно зауважити, що у спектрі водню (водневій трубці) поряд з лініями атомного спектру спостерігається спектр молекулярного водню. У зв'язку з цим пошук необхідних ліній слід розпочинати з найбільш інтенсивної червоної лінії H a. Друга лінія H b - зелено-голуба. У проміжку між H a і H b розташовується декілька червоно-жовтих i зелених слабких молекулярних ліній. Третя лінія H g - фіолетово-синя. Четверта лінія H d - фіолетова.
Date: 2015-07-24; view: 498; Нарушение авторских прав