
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Корпускулярно-волновая природа света
|
|
В 1905 году, в том же году, в каком Альберт Эйнштейн написал первую статью по теории относительности, появилась и другая его работа, посвященная квантовой природе света. В ней автор развивал идею Планка. Эйнштейн пришел к выводу, что свет не только излучается и поглощается, но и распространяется в пространстве отдельными порциями. Эти кванты электромагнитного поля стали называться фотонами. По представлениям Эйнштейна, свет не является непрерывным волновым процессом, а представляет собой поток фотонов.
Представления о квантовой природе света есть в определенной степени возрождение ньютоновской корпускулярной теории света. Однако имеется важное отличие. Корпускулы, по представлениям Ньютона, могут обладать любой скоростью. Фотоны способны двигаться только со скоростью света.
Какова же подлинная природа света? Или это электромагнитные волны, или поток летящих фотонов? На первый взгляд, кажется, что эти две точки зрения взаимно исключают друг друга. Действительно, частица сконцентрирована в пространстве, а волна – «размыта». Однако развитие квантовой физики показало, что две точки зрения на природу света, волновая (электромагнитная) и квантовая (корпускулярная), взаимно дополняют друг друга. Свет представляет собой поток частиц ‒ фотонов, но они находятся в каждой области пространства с определенной вероятностью, и вероятность этого нахождения носит волновой характер, иными словами, волнообразно меняется при переходе от одной области пространства к другой. Свет имеет двойственную, корпускулярно-волновую природу: обладает одновременно и волновыми свойствами непрерывных электромагнитных волн, и квантовыми свойствами дискретных фотонов.
Такое понимание природы света дал Альберт Эйнштейн[18]. В 1924 году французский физик Луи де Бройль (1892 – 1987) применил его и к частицам вещества – электронам, а впоследствии физики распространили его и на все микрочастицы. Такое толкование природы микрочастиц получило название корпускулярно-волнового дуализма.
3. ПЕРВЫЕ МОДЕЛИ АТОМА
В начале ХХ века были созданы несколько гипотез о строении атома. Только эксперимент мог дать ответ, какая из них в бóльшей степени соответствует действительности.
Одну из гипотез предложил Джозеф Джон Томсон[19] (1856 ‒ 1940) ‒ английский ученый, который открыл электрон. По его модели, атом представляет собой сгусток материи, заряженной положительно, в которую вкраплены отрицательно заряженные электроны. Атом электрически нейтрален. Эта модель получила название «пудинг с изюмом».
В 1909 – 1910 годах английский физик австралийского происхождения Эрнст Резерфорд (1871 ‒ 1937) поставил эксперимент. Приняв модель Томсона, он исследовал, как внутри атома распределен положительный заряд. Для этого он использовал α-частицы – тяжелые, положительно заряженные частицы. Их масса приблизительно в четыре раза превышает массу атома водорода, а заряд – в два раза превосходит заряд электрона. Источник α-частиц находился в свинцовой полости с каналом. Все частицы, кроме движущихся вдоль канала, поглощались свинцом, и поэтому возникал их узкий направленный пучок. Он проходил через сверхтонкую золотую фольгу перпендикулярно ее поверхности и падал на экран, покрытый специальным веществом. α-частица при взаимодействии с веществом давала вспышку, которую можно было наблюдать через микроскоп. Между фольгой и экраном был откачан воздух, чтобы его молекулы не препятствовали движению α-частиц.
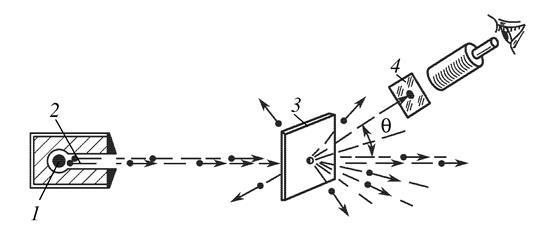
Схема опыта Резерфорда[20]
В свинцовом цилиндре находится источник 1 α-частиц – тяжелых положительно заряженных частиц. В цилиндре имеется узкая щель 2. В различных направлениях α-частицы свинцом поглощаются, а вдоль щели проходят свободно, образуя узкий пучок. Он падает на золотую фольгу 3. Взаимодействуя с атомами золота, α-частицы отклоняются и попадают на экран 4, покрытый специальным веществом. Удары α-частиц об экран производят вспышки света, которые можно наблюдать через микроскоп.
Если принять модель атома Томсона, то все α-частицы должны были проходить сквозь фольгу, сохраняя прежнее направление движения, или отклоняться на очень малые углы. И это действительно происходило с подавляющим большинством частиц. Однако некоторые из них, приблизительно одна из двух тысяч, были видны под углами до 135 – 150˚. Было в высшей степени маловероятно, что такие резкие отклонения могли получиться в результате накопления случайных малых отклонений. Для Резерфорда это было настолько удивительно, как если бы пушечный снаряд попал в папиросную бумагу и отразился от нее! Однако на следующий день он догадался, какой модели атома может соответствовать такое поведение α-частиц.
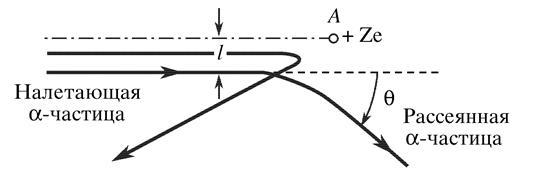
Рассеяние α-частиц[21]
В точке А находится атом золота. При столкновении с ним одна α-частица, находящаяся на значительном расстоянии, отклоняется на угол θ, а другая испытывает лобовое столкновение и отбрасывается назад. Отклонение тяжелых α-частиц на большие углы возможно лишь в том случае, если почти вся масса и почти весь заряд атома заключены в ядре малых размеров по сравнению с размерами всего атома. С помощью этого опыта Резерфорд доказал существование атомного ядра. Впоследствии было открыто, что в состав ядра входят положительно заряженные протоны, а оболочку атома составляют отрицательно заряженные электроны. +Ze – величина заряда ядра: e - элементарный заряд электрона, Z – количество протонов в ядре, Знак «+» показывает, что ядро заряжено положительно.
Резерфорд предположил, что весь положительный заряд и подавляющая часть массы атома сосредоточены в ничтожно малой области его пространства – в ядре. Его величина порядка 10–15 – 10–14 м. Бóльшую часть атома ‒ приблизительно 10–10 м ‒ занимают отрицательно заряженные электроны. Их совокупный заряд нейтрализует положительный заряд ядра.
Можно найти много красивых картинок, изображающих опыт Резерфорда. Сама установка была более прозаична. Она располагалась в подвале, и надо было наклонять голову, чтобы не удариться о трубы. Подсчет вспышек, возникающих при попадании α-частиц на экран, производил Эрнест Марсден (1889 ‒ 1970), каждый день с утра до вечера. За два года кропотливой работы он подсчитал миллионы вспышек. Резерфорд пришел лишь однажды. Его терпения хватило лишь на две минуты. После этого он выругался, вышел и больше не появлялся. Однако знаменитый опыт по праву носит имя Резерфорда. Ведь ему принадлежит идея опыта и его истолкование – ядерная модель атома.
Эту модель Резерфорд предложил в 1911 году. Она напоминает Солнечную систему. Вокруг ядра-солнца вращаются электроны-планеты. Положительный заряд ядра и отрицательный заряд электронов взаимно нейтрализуют друг друга. Эту модель называют планетарной.
Такое представление об устройстве атома хорошо объясняет поведение α-частиц в опыте. Они тяжелые, и поэтому, пролетая мимо легких электронов, не испытывают заметного отклонения. Если же какая-либо α-частица достаточно близко подлетит к ядру, то силы отталкивания должны резко отклонить ее от первоначального направления. Ведь ядро – тяжелое, а оба образования заряжены положительно и поэтому взаимно отталкиваются. Поскольку ядро занимает ничтожный объем атома, такие столкновения весьма редкие.
Планетарная модель атома, несмотря на соответствие опыту, содержала в себе противоречия. Электроны должны двигаться вокруг ядра, иначе под действием электрических сил они быстро упадут на него. Однако по законам классической электродинамики, движущийся электрон должен непрерывно излучать электромагнитные волны, а значит, терять энергию и, следовательно, быстро упасть на ядро. Причем, такое падение произойдет стремительно – за 10–10 с. Однако жизнь показывает, что атомы – очень устойчивые образования.
Таким образом, применение классической физики при исследовании внутриатомных процессов приводило к противоречиям. Необходимо было сохранить важнейшие идеи планетарной модели атома и применить к ним новые физические законы. Созданная в начале XX века квантовая механика позволила построить более совершенную модель атома.
Date: 2015-07-24; view: 1224; Нарушение авторских прав