
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Свойства атомов
|
|
Эта формула иллюстрируется рисунком 1, где параллелепипед изображает область dV.
Волновую функцию ψ(x, y, z), определяющую область наиболее вероятного нахождения электрона в пространстве вокруг ядра и его энергию в атоме, называют атомной орбиталью (АО).
АО – это математические функции, по-разному зависящие от координат электрона в пространстве и его энергии, и определяющие величину и форму
Рис. 1. части пространства, в которой пребывание
электрона наиболее вероятно. Часто орбиталью также называют и саму область наиболее вероятного нахождения электрона в пространстве вокруг ядра. Такие функции еще изображают графически в виде геометрических поверхностей (например, сфера, гантель и более сложные). Графическое изображение этих функций для краткости также называют АО.
Вероятность нахождения электрона в каком то объеме вокруг ядра зависит от его энергии. И вот как раз уравнение Эдвина Шредингера и объединяет волновую функцию электрона и его энергию. В самом общем виде это уравнение можно представить:
(∂2ψ/∂х2 + ∂2ψ/∂y2 + ∂2ψ/∂z2 ) + 8mπ2/h2 (E – U)ψ = 0
U – потенциальная энергия электрона, Е – полная энергия электрона; h – постоянная Планка; m – масса электрона; x,y,z – координаты электрона в трехмерном пространстве; ∂2ψ/∂х2, ∂2ψ/∂y2, ∂2ψ/∂z2 – вторые частные производные волновой функции по координатам x, y, z.
Это очень сложное дифференциальное уравнение, которое дает точные решения лишь для очень простых систем, какой например, является атом водорода. Для него решение уравнения Шредингера позволяет получить волновые функции общего вида:
Ψn,l,m = [N] [Rn,l,(r)] [Φl,m (x/r; y/r; z/r)].
[N] – нормировочный член или постоянная нормировки. Эта постоянная фиксирует наличие электрона, т.е. утверждает, что вероятность нахождения электрона где-нибудь в пространстве равна 1.
Второй член общего решения [Rn,l,(r)] представляет собой радиальную часть волновой функции, квадрат которой определяет вероятность размещения электрона на некотором расстоянии от ядра r. Для нахождения величины радиальной части волновой функции требуется знать два числа – это уже известные вам из школы квантовые числа – главное и орбитальное.
Третий член общего решения [Φl,m (x/r; y/r; z/r)] – это угловая часть волновой функции; она ограничивает некоторым телесным (пространственным, а не плоским) углом часть пространства, вероятность нахождения в котором электрона равна заданной величине (обычно она равна 0,9). Угловая составляющая волновой функции определяется также значениями двух квантовых чисел: орбитального и магнитного.
Таким образом, решением уравнения Шредингера является волновая функция, существующая при разрешенных специальными правилами комбинациях трех квантовых чисел (n,l,m): каждой комбинации этих чисел соответствует одна волновая функция и одна АО.
Принято говорить, что электрон, занимающий данную атомную орбиталь с данными квантовыми числами, также характеризуется этими числами. Квантовые числа также характеризуют энергию электрона в относительных единицах.
Рассмотрим теперь подробнее квантовые числа, как они связаны с энергией электрона и пространственным распределением вероятности его нахождения в атоме.
n – главное квантовое число характеризует энергетический уровень электрона (запас энергии на энергетическом уровне) и среднее расстояние электрона от ядра. Может принимать значения n=1, 2, 3 …∞. При n=1 электрон находится в самом низком по энергии разрешенном состоянии, называемом основным состоянием. По мере возрастания главного квантового числа увеличивается расстояние электрона от ядра и возрастает энергия электрона.
Количество энергетических уровней в атоме определяется номером периода, где находится атом. В 1 периоде – только 1 уровень, во втором – уже 2 и т.д.
l – орбитальное (побочное) квантовое число, определяет запас энергии электрона на подуровне и форму АО. Оно (l) принимает не какие угодно значения, а в зависимости от n: l = от 0 до (n – 1). Таким образом, при n=1 l может принимать только 1 значение равное 0; при n=2 для l возможны 2 значения 0 и 1; при n=3 для l существуют 3 разрешенных значения 0, 1, 2, и т.д.
И каждому значению l соответствует АО (электронное облако) особой формы и только 1 форма АО.
И каждому значению l присвоено буквенное обозначение:
L: 0 1 2 3 4
s p d f g
При l =0, независимо от значения главного квантового числа, электронное облако всегда имеет форму сферы (рис. 2). Значение «0» не означает отсутствие облака, а означает равномерное распределение электронной плотности в занимаемой электроном части пространства, т.е. сфера. Сфера, имеет одну ориентацию, каждая другая будет повторением предыдущей относительно пространственных координат (l = 0).
При l =1 электронное облако принимает форму гантели, так что по обе стороны от ядра располагаются области высокой вероятности нахождения электрона.
При l =2 форма электронного облака напоминает 4 груши, обращенные черенками в сторону ядра.
Различные формы электронных облаков означают различный характер движения электрона, а именно, различную кривизну движения: s-электроны характеризуются наименьшей кривизной движения, p-электроны обладают большей кривизной движения, и d-электроны – еще большей и т.д. Поэтому, из-за неодинаковой кривизны движения энергии электронов одного энергетического уровня, обладающих различными значениями орбитального квантового числа, также неодинаковы. Причем, энергии s p d f g – подуровней последовательно возрастают от s до g.
Таким образом, в пределах одного энергетического уровня (слоя) электроны располагаются на различных АО (т.е. в различных областях внутриатомного пространства). При постоянном взаимном отталкивании электронов такое расположение отвечает наименьшему их приближению друг к другу, и, следовательно, наиболее стабильному состоянию.
Магнитное квантовое число – m - характеризует ориентацию АО в пространстве. Число ориентаций облака – это количество значений магнитного квантового числа (m). Для каждого значения l возможно 2 l +1 значений магнитного числа. Само же магнитное число может принимать следующие значения:
m = от - l, 0, + l
Ясно, что число разрешенных ориентаций связано с формой электронного облака. При l =0 возможна только 1 ориентация, поскольку облако обладает сферической формой, а сферу как ни крути в пространстве, все будет одно и то же положение.
Для р -АО с l =1 возможно три ориентации в пространстве 2 l + 1=2∙1+1=3. Само магнитное число имеет значения m= -1,0,+1. Оси трех соответствующих гантелеобразных орбиталей направлены под углом 90о друг к другу. Поэтому в соответствии с преимущественной концентрацией заряда вдоль одной из трех осей системы координат эти орбитали обозначают px, py, pz. Для d -орбиталей число m имеет 5 разрешенных значений: -2,-1,0,+1,+2. Пять соответствующих орбиталей также обозначаются с помощью индексов, связанных с координатами x, y, z. Например, распределение заряда электрона, находящегося на орбитали dzx, сконцентрировано в плоскости zx.
Все орбитали, относящиеся к одному подуровню, в изолированном атоме при обычных условиях обладают одинаковой энергией. Например, электроны на px, py, pz орбиталях имеют одинаковые энергии, поскольку они отличаются только ориентацией в пространстве, а не формой и размерами. Но! Электроны, находящиеся на р-орбиталях разных энергетических уровней, например, на 2 и 3 (n=2 и n=3) уже будут отличаться энергией: на 3 уровне р-электроны обладают большей энергией, чем на 2 уровне.
|
|
|
|
|
|
|
|
|
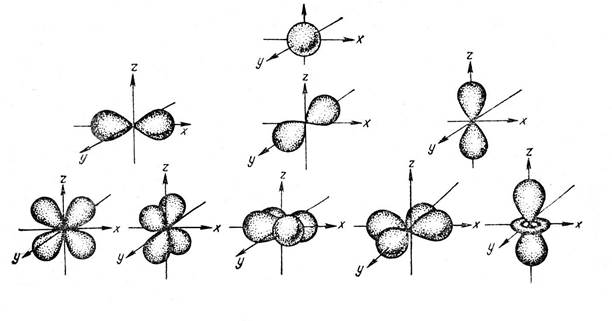
Рис. 2. Формы АО.
Помимо движения относительно ядра электрон еще осуществляет вращение вокруг своей оси как по часовой стрелке так и против нее. Такое вращение получило название «спин» от английского слова spin – веретено. И это движение характеризуется 4-ым квантовым числом – спиновым s.
Сами числовые значения спинового квантового числа выбраны так, чтобы было соблюдено условие: соседние значения квантовых чисел должны отличаться на 1, тогда s =+ ½ и - ½.
Разнонаправленный спин предполагает взаимодействие электронов между собой, т.е. «спаривание», т.к. вращение заряженной частицы приводит к появлению магнитного поля: параллельного или антипараллельного (противоположно направленного). Поэтому электроны принято обозначать стрелками:
 |  |
Два электрона с одинаковыми главным, орбитальным и магнитным квантовыми числами, но разным спиновым называют спаренными или не поделенной парой.
Рассмотренные современные положения о строении атома – это есть всего лишь математическая модель атома! Модель Бора и предшествующие ей модели позволяли дать простые наглядные картины строения атома. Квантово-механическая модель атома к сожалению не дает этого, потому что это – математическая абстракция. Двойственный корпускулярно-волновой характер частиц не имеет никаких аналогий из нашего опыта и его почти невозможно представить себе. Однако квантово-механическая модель до сих пор остается единственной возможностью удовлетворительно описывать свойства атомов, и поэтому она принята и ею до сих пор пользуются, несмотря на то, что человеку свойственно отдавать предпочтение наглядным физическим моделям, а не математическим абстракциям. Даже сам Шредингер признавал, что этой модели не достает наглядности, а наглядность – это ключ к пониманию. Применение квантовой механики к расчетам атома гелия давали результаты, которые на 5% отличались от экспериментальных данных. Таким образом, квантово-механическая модель – не более чем абстрактное описание реального атома.
Электронные формулы:
Полная формула +13Al 1s22s22p63s23p1
Сокращенная 3s23p1 – только для внешнего и предвнешнего уровней.
Графические формулы 
СТРОЕНИЕ МНОГОЭЛЕКТРОННЫХ АТОМОВ
Смысл обсуждения квантовых чисел – они позволяют описать распределение электронов в системе атома, а это позволяет предсказывать свойства элемента.
Волновое уравнение Шредингера для многоэлектронных атомов не удается решить точно прежде всего из-за проблем, возникающих в связи с тем, что необходимо учесть взаимодействие между электронами. Каждый электрон взаимодействует не только с ядром, но и с другими электронами этого атома. И все же распределение электронов по орбиталям многоэлектронного атома может быть достаточно хорошо описано в предположении, что эти орбитали подобны орбиталям атома водорода, только обладают большей энергией.
Распределение электронов в системе атома регламентируется следующими положениями:
1. Принципом запрета Вольфганга Паули - в атоме не может быть двух электронов с одинаковыми значениями всех 4-х квантовых чисел. Паули установил, что максимальное число электронов на уровне: х = 2 n2 и это число ограничено разрешенными комбинациями квантовых чисел.
Пример:
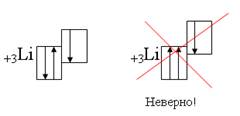
Физический смысл принципа Паули в следующем:
в одной и той же области пространства в один момент времени не могут находиться 2 электрона. Поэтому 2 электрона могут занимать атомную орбиталь только в том случае, если они имеют противоположные спины. Каждая орбиталь может принять максимум 2 электрона.
2. Принцип наименьшей энергии: электроны заполняют АО в атоме в порядке увеличения их энергии.
Пример: 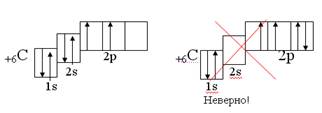
3. Правило Фридриха Хунда (Гунда): Согласно правилу Гунда (1927, Германия) [3] электроны в пределах данного подуровня располагаются сначала по одному в свободных АО, чтобы сумма значений спиновых квантовых чисел была максимальной. Дело в том, что если 2 электрона находятся на различных орбиталях с неодинаковой пространственной ориентацией, энергия атома оказывается наименьшей, чем если бы эта же пара оказалась локализованной на общей орбитали. В последнем случае возрастает энергия кулоновского отталкивания электронов друг от друга и энергия атома в целом тоже возрастает. Поэтому, три электрона на р-подуровне будут размещаться поодиночке на трех имеющихся орбиталях, а не создавать пару на одной орбитали.
Пример:
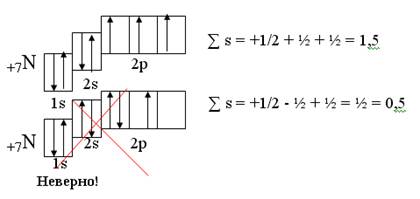
 4. Правила Клечковского.
4. Правила Клечковского.
В 1951 году Всеволод Маврикиевич Клечковский (1900 – 1972) [4] ввел представление об (n+l) группах: «…изучение фактической последовательности заполнения электронных уровней атомов» с увеличением порядкового номера указывает на существование определенной закономерности, соблюдающейся на всём протяжении периодической системы элементов:
А) заполнение электронных уровней с увеличением атомного номера элемента происходит последовательно от группы уровней с меньшим значением суммы (n + l) к группам с большим значением этой суммы;
Б) если сумма(n + l) одинакова для нескольких АО, то сначала заполняется АО с меньшим значением n.
Пример:
3s ∑ n+l = 3+0 = 3
+12Mg 1s22s22p6 или? 3< 4, значит 1s22s22p63s2
3p ∑ n+l = 3+1 = 4
4p ∑ n+l = 4 + 1 = 5
+21Sc 1s22s22p63s23p64s2 или? 5=5, но 3< 4, Þ1s22s22p63s23p64s23d1
3d ∑ n+l = 3 + 2 = 5
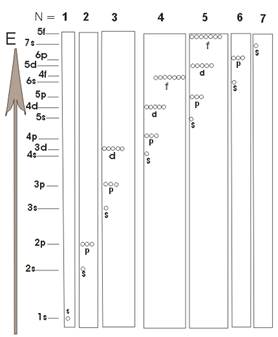 На рис. 3 представлена диаграмма энергетических подуровней многоэлектронного атома. В соответствии с этой диаграммой происходит заполнение электронами энергетических подуровней в многоэлектронных атомах.
На рис. 3 представлена диаграмма энергетических подуровней многоэлектронного атома. В соответствии с этой диаграммой происходит заполнение электронами энергетических подуровней в многоэлектронных атомах.
Однако имеются отклонения от предсказываемого этой диаграммой заполнения подуровней электронами. Например, для атома хрома:
предполагается 24Cr 1s22s22p63s23p64s23d4
Однако на самом деле более низкой энергией обладает конфигурация с полузаполненым 3d подуровнем, характеризующаяся симметричным распределением заряда в пространстве
24Cr 1s22s22p63s23p64s13d5.
Она и наблюдается у атомов хрома в основном состоянии. Еще подобные примеры:
29Cu 1s22s22p63s23p64s13d10
42Mo 1s22s22p63s23p64s23d104p65s14d5.
Свойства атомов.
1) Потенциал (энергия) ионизации.
Электрон может быть удален из атома при столкновении его с другим электроном, быстро движущимся. Этот процесс называется ионизацией:
е* + А0 ↔ А+1 + 2е– [5]
атом превращается в положительно заряженный ион (катион), а электрон теряет энергию, обращаясь в медленный электрон. Ионизация играет важную роль во многих химических превращениях и определяет способность атомов (особенно металлических элементов) образовывать катионы.
Но для того, чтобы это произошло, быстро движущийся электрон е* должен обладать достаточным запасом энергии, потому что для отрыва электрона от атома надо преодолеть силу притяжения электрона к ядру, т.е. надо затратить энергию. Так вот, эта энергия называется энергией ионизации.
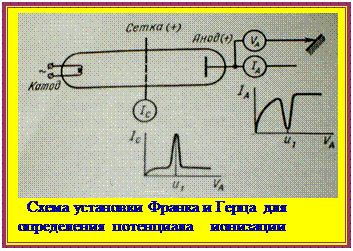 Исторически впервые ионизация атомов была проведена методом электронного удара на установке, разработанной двумя учеными: Франком и Герцем (рис.) [5]. В вакуумной трубке имеются катод – источник электронов, вырывающихся из раскаленной вольфрамовой проволоки, сетка с небольшим положительным потенциалом, способная захватывать медленные электроны; анод с регулируемым напряжением, которое ускоряет движение электронов, эмиттирующих с катода. Когда поток катодных электронов встречает на своем пути атомы и соударяется с ними, происходит ионизация атомов, вследствие чего резко увеличивается количество медленных электронов и на кривой зависимости тока сетки от напряжения появляется резкий пик, а на кривой тока анода – резкий минимум при том же значении напряжения. Напряжение, при котором это происходит, называют потенциалом ионизации. Потенциал ионизации связан с энергией ионизации соотношением
Исторически впервые ионизация атомов была проведена методом электронного удара на установке, разработанной двумя учеными: Франком и Герцем (рис.) [5]. В вакуумной трубке имеются катод – источник электронов, вырывающихся из раскаленной вольфрамовой проволоки, сетка с небольшим положительным потенциалом, способная захватывать медленные электроны; анод с регулируемым напряжением, которое ускоряет движение электронов, эмиттирующих с катода. Когда поток катодных электронов встречает на своем пути атомы и соударяется с ними, происходит ионизация атомов, вследствие чего резко увеличивается количество медленных электронов и на кривой зависимости тока сетки от напряжения появляется резкий пик, а на кривой тока анода – резкий минимум при том же значении напряжения. Напряжение, при котором это происходит, называют потенциалом ионизации. Потенциал ионизации связан с энергией ионизации соотношением
E = eu
е – заряд электрона,
Термин потенциал ионизации применяют гораздо чаще, чем энергия ионизации.
Атом может терять не только 1 электрон, но и 2 и 3, и тогда говорят о первом, втором и третьем потенциалах ионизации. Однако для отрыва 2 электрона требуется больше энергии, а для 3 – еще больше. В следующей таблице приведены значения первых потенциалов ионизации (B) для некоторых элементов [5]:
| № периода | 1 группа | |||||||
| H 13,54 | He 24,48 | |||||||
| Li 5,37 | Be 9,30 | B 8,28 | C 11,24 | N 14,51 | O 13,57 | F 17,46 | Ne 21,47 | |
| Na 5,09 | Mg 7,63 | Al 5,94 | Si 8,14 | P 10,45 | S 10,42 | Cl 13,01 | Ar 15,68 |
Таким образом, видно, что в пределах одной группы с увеличением заряда ядра потенциалы ионизации уменьшаются, а в пределах периода – увеличиваются. Почему это именно так? Какова причина?
Для ответа на этот вопрос рассмотрим формулу: в соответствии с законом Кулона [9] энергия ионизации атома определяется выражением
E = (q1q2) / r = (eZэфф) / r
q1 – заряд электрона е; q2 = Zэфф – эффективный заряд ядра; r – средний радиус нахождения ионизируемого электрона относительно ядра.
Расшифруем понятие Zэфф. Под эффективным зарядом понимается кажущийся заряд ядра, который воздействует на данный рассматриваемый электрон. Величина Zэфф меньше, чем истинный заряд ядра, потому что каждый внешний электрон частично экранируется от действия ядра внутренними электронами. Для самых внешних электронов степень экранирования истинного заряда ядра другими электронами этого же атома можно охарактеризовать постоянной экранирования S, которая определяется как разность между истинным и эффективным зарядами. Таким образом, Zэфф = Z-S. Например, Zэфф атома азота для одного из электронов валентного (внешнего) уровня равен 3,9 (вместо 7); а для атома гадолиния Zэфф равен 3, вместо 64!
При определении степени экранирования руководствуются правилом:
электроны каждого энергетического уровня слабо экранируются другими электронами, находящимися на том же уровне, но существенно экранируются электронами, находящимися на более глубоких уровнях, т.е. ближе к ядру.
Теперь вернемся к приведенному соотношению. Оно показывает, что энергия ионизации (и потенциал тоже) тем меньше, чем меньше эффективный заряд ядра и чем больше средний радиус нахождения электрона относительно ядра. Тогда становится понятным, что в пределах группы с увеличением порядкового номера увеличивается радиус атома, следовательно, увеличивается средний радиус нахождения внешнего электрона, а это приводит к уменьшению потенциала ионизации (табл.2):
| Элемент | Атомный радиус Å | Потенциал ионизации эВ |
| Li Na K Rb Cs | 1,52 1,86 2,31 2,44 2,62 | 5,37 5,09 4,34 4,18 3,89 |
С другой стороны, вместе с увеличением радиуса нахождения электрона увеличивается и общее количество электронов, значит, увеличивается постоянная экранирования, а это значит, что уменьшается Zэфф.
В периоде с увеличением заряда ядра сильно увеличивается и Zэфф, потому что электроны одного и того же уровня очень слабо экранируют друг друга. Вместе с тем радиус нахождения электрона уменьшается, поскольку уменьшается атомный радиус элементов. Эти изменения приводят к увеличению потенциала ионизации.
Таким образом, наименьшим потенциалом ионизации обладают металлы, особенно щелочные и щелочноземельные, т.е. металлы главных подгрупп 1 и 2 групп. А наиболее высокими значениями потенциалов ионизации обладают типичные неметаллы – элементы главных подгрупп с 5 по 8 групп. Максимальный – у инертных газов.
2) Сродство атома к электрону.
Когда к атому присоединяется электрон, образуется отрицательно заряженная частица – анион.
А0 + е → А–.
Энергия, необходимая для присоединения к атому дополнительного электрона, называется сродством атома к электрону. Численно она равна энергии ионизации с обратным знаком:
А– → А0 + е,
Энергия сродства также измеряется в эВ.
Не все атомы легко присоединяют электроны, поэтому такой процесс может быть как экзотермическим (с выделением энергии) так и эндотермическим (с поглощением).
Наибольшим сродством обладают атомы галогенов. Для ряда элементов сродство к электрону близко к 0 или меньше 0. Очень малые значения сродства к электрону имеют все те же щелочные и щелочно-земельные металлы. Это означает, что эти металлы с легкостью могут терять электрон, но присоединяют его с трудом большим. Нулевое или отрицательно значение сродства к электрону означает, что для данного элемента устойчивого отрицательного иона в свободном виде не существует. Например, таким сродством обладают гелий, бериллий, неон, магний, аргон, кальций, марганец, стронций, азот [10].
Положительные значения сродства к электрону указывают на то, что присоединение электрона сопровождается выделением энергии. Например, для процесса
О + ē → О– + 1,48 эВ (энергия выделяется)
Но для того, чтобы к иону О– присоединить еще 1 электрон, необходимо затратить большую энергию:
О– + ē → О2– - 7,3 эВ (энергия поглощается).
Таким образом, 2 энергетические характеристики: ионизационный потенциал и сродство атома к электрону, обусловливают различную способность элементов отдавать и принимать электроны, а также характеризуют способность элемента вступать в химические реакции с другими элементами. Если у одного элемента очень высокое сродство к электрону, а у другого – очень низкий потенциал ионизации, следует ожидать, что такие элементы будут хорошо реагировать друг с другом и образуют устойчивое соединение. Однако практическое использование этих характеристик реакционной способности элементов ограничено тем, что они относятся только к изолированным атомам, т.е. к атомам в газообразном состоянии. Гораздо удобнее пользоваться обобщенной эмпирической характеристикой химических свойств элементов, называемой электроотрицательностью.
Под элеткроотрицательностью элементов понимают относительную способность его атомов притягивать электроны.
В 1931 году Л. Полинг (1901 – 1994) ввёл эту характеристику – электроотрицательность (Э.О.). Поскольку это понятие относится не к изолированным атомам, а к атомам в молекуле, измерить Э.О. практически невозможно. Полинг сопоставил энергии образования молекул типа А2 и В2 с энергией образования молекул типа АВ, допустил при этом некоторые условности и рассчитал первую таблицу электроотрицательностей. Она, правда, потом неоднократно подвергалась исправлениям в соответствии с новыми данными.
В 1934 году Р. Малликен (1896 - 1986) предложил другую версию Э.О.: это полу сумма ионизационного потенциала и сродства к электрону. Линейно эти подходы связаны: Э.О. (Малликен) = 2,78 х Э.О. (Полинг) [11].
В 1958 г. Оллред и Рохов предложили свой способ расчета ЭО, который также имеет ряд допущений, и тоже по существу свели его к ЭО, полученным Полингом.
Таким образом, в настоящее время для оценки ЭО используется условная шкала. Крайние точки этой шкалы соответствуют ЭО цезия = 0,7 и фтора 4,0. ЭО рассматривается как характеристика атомов в любом окружении, независимо от того, свободные это атомы или связанные в молекуле. Периодические изменения ЭО элементов соответствуют изменениям их потенциалов ионизации и сродства к электрону, атомных радиусов. При этом фтор – самый ЭО-й элемент, а цезий – наименее ЭО-й.
Периодический закон в формулировке Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Теперь установлено, что причиной периодичности в изменении различных свойств атомов является послойное заполнение электронами пространства вокруг ядра. Каждый раз через какое-то число элементов повторяется одна и та же ситуация: на внешней оболочке 1 электрон, 2 электрона, 3 электрона и т.д. Периодическое повторение структуры внешней оболочки вызывает периодичность в изменении свойств атомов.
Литература:
- Пиментел Г., Cпратли Р. Как квантовая механика объясняет химическую связь. М.: Мир, 1973. 332 с.
- Pauli W. Über den Zusammenhang des Abschlusses der Electronengruppen im Atom mt der Komplexstruktur der Spekten // Z... phys..., Bd 31, 1925. S. 765 – 783.
- Hund F. LinienSpectren und periodisches System der Elemente. Berlin: Springer, 1927.
- Клечковский В.М. К вопроу о закономерности в порядке заполнения электронных уровней атома с увеличением атомного номера элементы. Рефераты докладов ТСХА, вып. 13, 1951. С. 127 – 133.
- В.В. Фролов. Химия. М.: Высшая школа, 1979. С. 45 – 46.
- Менделеев Д.И. Соотношение свойств с атомным весом элементов // Жур. Русск. хим. общ., т.1, вып. 2-3, 1869. С. 60 -77.
- Hittorf I. Über die Elektrizitätstellung der gase // Ann. Phys., Bd. 1, 1869. S. 136 -157.
- Rydberg I. Om de kemista Grundämnenas periodiska sistem // Bihang. Till. K. Svenska Vet. Akad. Handlingen, Bd. 10, Nr. 2, 1884. S. 3 – 31.
- Слейбо У., Персонс Т. Общая химия. М. Мир. 1979. 550с.
- Химическая энциклопедия. М.: Большая Российская энциклопедия. 1995. Т.4. с.411.
| <== предыдущая | | | следующая ==> |
| Почему закат красного цвета | | | Методи дослідження |
Date: 2015-07-24; view: 698; Нарушение авторских прав