
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Визначення рн води
|
|
Для визначення рН існує два головних методи: колориметричний та електрометричний.
Колориметричний метод ґрунтується на використанні спеціальних одно- або двокольорових індикаторів, при додаванні яких до розчину останній набуває забарвлення. Ці індикатори (найчастіше – мета-нітрофеноли) являють собою слабкі кислоти, які забарвлені в дисоційованому стані, а в недисоційованому безбарвні. При цьому інтенсивність забарвлення пропорційна ступеню дисоціації індикатора, який залежить від рН розчину.
Точність колориметричних методів обмежена і ними користуються в разі відсутності можливості використання приладів (в польових умовах).
При визначенні користуються набором ампул-еталонів з відомими значеннями рН розчинів, в які введений відповідний індикатор. Визначення виконують підбором ампули-еталона з відомим рН, колір якого збігається з кольором досліджуваної проби води. Визначення кольорів проводять у компараторі.
Електрометричний рН = 0,05 чи менше (цей метод визначення рН ґрунтується на вимірюванні електрорушійної сили (ЕРС) електрохімічного ланцюжка, складеного з проби води, скляного електрода і електрода порівняння.
Під час електрометричного визначення рН використовують лабораторний рН-метр зі скляним електродом вимірювання та хлор-срібним електродом порівняння. При зануренні скляного електрода у розчин між поверхнями кульки скляного електрода і розчину виникає обмін іонами, внаслідок якого іони літію в зовнішніх шарах скла заміщуються іонами водню, скляний електрод стає водневим. Між поверхнею скла і аналізованим розчином виникає різниця потенціалів (ЕРС), пропорційна рН розчину.
Вимірювання рН води необхідно проводити якнайскоріше після відбору проби, оскільки рН швидко змінюється через протікання різних хімічних, фізичних і біохімічних процесів у пробі.
Для вимірів застосовують лабораторний рН-метр.
Перед визначенням електроди ретельно промивають дистильованою водою та просушують паперовим фільтром.
Визначають температуру за показаннями термометра рН-метра і ручкою “Температура розчину” виставляють її значення. Опускають електроди в склянку з досліджуваною водою, натискають кнопку діапазону вимірювання “1 – 14” та за нижньою шкалою приладу визначають рН в першому наближенні (грубо). Натискають кнопку відповідного діапазону рН та знаходять його значення за однією з верхніх шкал з точністю до 0,05. Після закінчення визначення рН електроди занурюють в склянку з дистильованою водою.
1) Аналіз мінеральної води на вміст НСО3- та СО32- титриметричним методом
Карбонатна лужність визначається вмістом у воді тільки аніонів вугільної кислоти, тобто іонів НСО3- і СО32-, Вона відповідає кількості кислоти, витраченої на титрування проби води до рН-4,5. Карбонатну лужність виражають у ммоль-eкв НСОз-/дм3 або в мг НСО3-/дм3.
рН-Потенціометричне визначення
Принцип методу: Іони CО32- та НСО3- переводять у молекули вугільної кислоти титруванням розчином сильної кислоти:
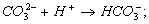
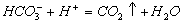
Відповідно до значення першої константи дисоціації вугільної кислоти, практично повністю (на 99 %) утворюється H2CO3 при досягненні рН 4,4, що відповідає точці еквівалентності. Якщо досліджувана вода має рН > 8,3 (в разі добавляння фенолфталеїну з'являється рожеве забарвлення), то титрується сума іонів 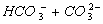 . Якщо ж вода має рН < 8,3, то цим методом визначається концентрація тільки іонів НСО3-.
. Якщо ж вода має рН < 8,3, то цим методом визначається концентрація тільки іонів НСО3-.
Метод потенціометричного титрування придатний для аналізу безбарвних, забарвлених і каламутних вод лужністю від 0,5 мг НСО3-/дм3 і більше.
Методика визначення: готують рН-метр до роботи, як описано в інструкції до приладу. Перед вимірюванням склянку для титрування, електроди, термометр та магнітні мішалки споліскують досліджуваною водою. Для аналізу беруть 100 см^ води. Якщо лужність досліджуваної води більша за 200 мг НСО3-/дм3. то для аналізу беруть 10, 25 або 50 см^ води і доводять її об'єм до 100 см3 прокип'яченою бі-дистильованою водою, вільною від СО2.
Пробу води титрують розчином соляної кислоти концентрацією 0,05 або 0,02 моль-екв./дм3 із мікробюретки за перемішування її магнітною мішалкою. Титрування закінчують, коли досягається значення рН 4.0 ± 0,05.
Лужність води обчислюють за рівняннями:
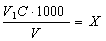 ммоль-екв НСО3-/дм3
ммоль-екв НСО3-/дм3
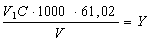 мг НСО3-/дм3
мг НСО3-/дм3
де V1 — об'єм розчину соляної кислоти, витрачений на титрування, см3; С — концентрація розчину соляної кислоти, витраченої на титрування, моль-екв/дм3; V— об'єм проби води, см3; 61.02 — молярна маса еквівалента гідрокарбонат-іонів.
Визначення зворотним титруванням
Принцип методу: під дією надлишку сильної кислоти аніони СО32- та НСО3- повністю переходять у молекули СО2 (Н2СО3). Останні видаляють із розчину продуванням повітря, вільним від СО2. Залишок сильної кислоти відтитровують стандартним розчином бури за наявності змішаного індикатору;
2НС1 + Na2B4O7 + 5Н2O = 4Н3BO3 + 2NаСІ.
За різницею еквівалентів добавленої сильної кислоти та витраченої на титрування бури обчислюють концентрацію іонних форм вугільної кислоти, виражену в моль-екв, НСО3-/дм3
Методика визначення: 100 см3 проби води наливають у колбу місткістю 250 см3, добавляють 10 крапель змішаного індикатору і з бюретки таку кіль кість розчину соляної кислоти концентрацією 0,05 моль-екв/дм3, щоб проба забарвилася в малиновий колір. Потім добавляють що 1 - 2 см3 розчину соляної кислоти і видаляють діоксид вуглецю продуванням крізь пробу води повітря, вільного від СО2. Не припиняючи продування повітрям, пробу титрують розчином бури до появи стійкого зеленого забарвлення.
Лужність води обчислюють за рівняннями:
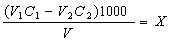 ммоль-екв НСО3-/дм3
ммоль-екв НСО3-/дм3
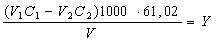 мг НСО3-/дм3
мг НСО3-/дм3
де V1 — об'єм розчину соляної кислоти, добавлений до проби води, см3; С1 — концентрація розчину соляної кислоти, добавленої до проби води, моль-екв/дм3; V2 — об'єм стандартного розчину бури, витрачений на титрування залишку соляної кислоти, см3; С2 — концентрація стандартного розчину бури, витраченого на титрування залишку соляної кислоти, моль-екв/дм3; V— об'єм проби води, см; 61,02 — молярна маса еквівалента гідрокарбонат-іонів.
Date: 2015-07-24; view: 1119; Нарушение авторских прав