
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

В2. Установите соответствие между солью и реакцией среды раствора. А Б В Г
| Соль | Среда раствора |
| А) Na2CO3 | 1) Кислая |
| Б) NH4Cl | 2) Щелочная |
| В) K2SO4 | 3) Нейтральная |
| Г) Al2S3 |
| А | Б | В | Г |
В3. Установите соответствие между названием соли и отношением ее к гидролизу:
| Соль | Отношение к гидролизу |
| А) K2CO3 | 1) гидролиз по катиону |
| Б) CaI2 | 2) гидролиз по аниону |
| В) (NH4)2S | 3) гидролиз по катиону и аниону |
| Г) Na3PO4 | 4) гидролизу не подвергается |
| А | Б | В | Г |
| Для задания С1 дайте полный развернутый ответ. |
С1(3 балла). Используя метод электронного баланса, составьте уравнение реакции:
KMnO4 + NH3 → MnO2 + N2 + KOH + H2O
Определите окислитель и восстановитель.
С2(4 балла). Вычислите рН раствора, в котором концентрация ионов ОН– (в моль/л) равна 4•10–2.
С3 (5 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
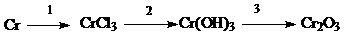
Для перехода 3 составьте полное и сокращенное ионное уравнение.
Ответы к Варианту №1
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 |
| В1 | В2 | В3 | ||||||||||||||||||||||||
|
|
|
С1.
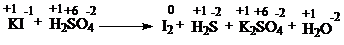
| 1 балл |
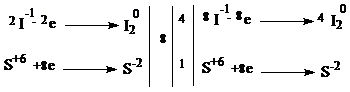
| 1 балл |
| 8KI + 5H2SO4 → 4I2 + H2S + 4K2SO4 + 4H2O | |
| Окислитель - H2SO4 Восстановитель - KI | 1 балл |
С2.
| pH = –lg[H+] | 1 балл |
| [H+]•[OH–] = 10–14 | 1 балл |
| [H+] = 10–14/[ОH–] = 10–14/10–7 = 10–7 | 1 балл |
| pH = –lg[H+] = –lg10–7 = 7 | 1 балл |
С3.
| Fe + 2HCl = FeCl2 + H2 | 1 балл |
| 2Fe + 3Cl2 = 2FeCl3 | 1 балл |
| FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl | 1 балл |
Ответы к Варианту №2
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 |
| В1 | В2 | В3 | ||||||||||||||||||||||||
|
|
|
С1.

| 1 балл |
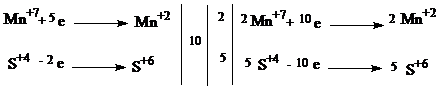
| 1 балл |
| 2KMnO4 + 5Na2SO3+ 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O | |
| Окислитель - KMnO4 Восстановитель - Na2SO3 | 1 балл |
С2.
| pH = –lg[H+] | 1 балл |
| [H+]•[OH–] = 10–14 | 1 балл |
| [H+] = 10–14/[ОH–] = 10–14/5•10–6= 0,2•10–8 | 1 балл |
| pH = –lg[H+] = –lg0,2•10–8= 8– lg0,2 | 1 балл |
С3.
| Cu + Cl2 = CuCl2 | 1 балл |
| Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O | 1 балл |
| CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl | 1 балл |
Ответы к Варианту №3
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 |
| В1 | В2 | В3 | ||||||||||||||||||||||||
|
|
|
С1.
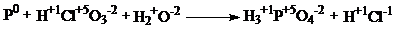
| 1 балл |
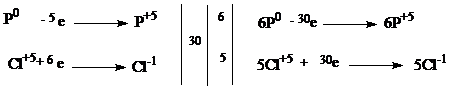
| 1 балл |
| 6P + 5HClO3 + 9H2O→ 6H3PO4 + 5HCl | |
| Окислитель - HClO3 Восстановитель - P | 1 балл |
С2.
| pH = –lg[H+] | 1 балл |
| [H+]•[OH–] = 10–14 | 1 балл |
| [H+] = 10–14/[ОH–] = 10–14/2•10–9= 0,5•10–5 | 1 балл |
| pH = –lg[H+] = –lg0,5•10–5= 5– lg0,5 | 1 балл |
С3.
| Fe + Cl2 = FeCl2 | 1 балл |
| FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl | 1 балл |
| Fe(OH)2 + H2SO4 = FeSO4 + 2H2O | 1 балл |
Ответы к Варианту №4
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 |
| В1 | В2 | В3 | ||||||||||||||||||||||||
|
|
|
С1.
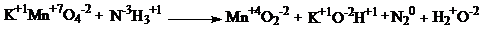
| 1 балл |
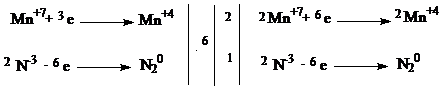
| 1 балл |
| 2KMnO4 + 2NH3 → 2MnO2 + N2 + 2KOH + 2H2O | |
| Окислитель - KMnO4 Восстановитель - NH3 | 1 балл |
С2.
| pH = –lg[H+] | 1 балл |
| [H+]•[OH–] = 10–14 | 1 балл |
[H+] = 10–14/[ОH–] = 10–14/4•10–2= 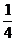 •10–12 •10–12
| 1 балл |
pH = –lg[H+] = –lg 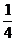 •10–12= 12– lg •10–12= 12– lg 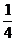
| 1 балл |
С3.
| 2Cr + 3Cl2 = 2CrCl3 | 1 балл |
| CrCl3 + 3NaOH = Cr(OH)3 + 3NaCl | 1 балл |
| 2Cr(OH)3 = Cr2O3 + 3H2O | 1 балл |
Date: 2015-07-22; view: 1635; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |