
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Работа с реактивами
|
|
Если к работе не дано указаний относительно дозировки реактивов, то брать их для проведения опытов необходимо в возможно меньшем количестве (экономия материалов и времени, которое затрачивается на опыт).
Избыток реактива нельзя высыпать и выливать обратно в сосуд, из которого он был взят.
После расходования реактива банку или стакан необходимо сразу закрыть пробкой и поставить на место.
Сухие реактивы брать с помощью лопаток, пластмассовых или металлических шпателей. Шпатель должен быть всегда сухим и чистым. После расходования следует его тщательно обтереть.
Когда реактив отбирается пипеткой, ни в коем случае нельзя той же пипеткой, не вымыв ее, брать реактив с другой емкости.
При наливании реактивов нельзя наклоняться над сосудом, предотвращая попадания брызг на лицо или одежду.
Нельзя держать банку или стакан с реактивом, которую нужно открыть, держа в руках, ее надо поставить на лабораторный стол и только после этого открывать.
3.2 Методика выполнения анализа
Рассчитывать навеску анализируемого образца, необходимо для приготовления раствора приблизительной той же нормальности, как и рабочий раствор AgNo3.
mNaCl =  (3.1)
(3.1)
где:M – молекулярная масса вещества;
С – молярная концентрация вещества;
V – объем колбы.
На аналитических весах точно взвешивают навеску в количестве, близком к рассчитанному. Навеску аккуратно переносят в мерную колбу и растворяют дистиллированной воде, объём раствора доводят до метки, колбу плотно закрывают пробкой. Раствор хорошо перемешивают.
Точный объём раствора поваренной соли перенести пипеткой в коническую колбу, добавить к нему 1-2 мл. раствора индикатора K2CrO4 и оттитровать рабочим раствором.
При титровании раствор AgNO3 добавлять осторожно по каплям, энергично перемешивая содержимое колбы. Титрование ведут до появления неисчезающего красного осадка Ag2CrO4.
Чтобы правильно уловить момент окончания титрования, последние капли AgNO3 необходимо добавить медленно, сильно перемешивая осадок. Титрование повторяют 2-3 раза и из отсчётов берут средний результат.
3.3 Результаты анализа
Масса навески рассчитывается по формуле:
mNaCl =  (3.2)
(3.2)
Таблица 3.1 - Данные взятия навески
| № | Масса бюкса | Масса бюкса с навеской | Масса навески |
| m1 | 5,2614 г. | 5,8461г. | 0,5847г. |
| m2 | 5,2614 г. | 5,8460г. | 0,5846г. |
| m3 | 5,2614 г. | 5,8458г. | 0,5844г. |
| № | Объем пипетки | V1 | V2 | V3 |
| m1 | 10мл. | 9,80 мл. | 9,70 мл. | 9,71 мл. |
| m2 | 10 мл. | 9,70 мл. | 9,69 мл. | 9,77 мл. |
| m3 | 10 мл. | 9,75 мл. | 9,71 мл. | 9,70 мл. |
Таблица 3.2 - Результаты аргентометрического титрования пробы поваренной соли
Таблица 3.3–Средние результаты аргентометрического титрования пробы поваренной соли
| № | Объем пипетки | Vср мл. |
| m1 | 10мл. | 9,75мл. |
| m2 | 10 мл. | 9,70мл. |
| m3 | 10мл. | 9,70мл. |
Масса NaClрассчитывается по формуле:
(3.3)
где: М э – молярная концентрация;
Vср – средние данные титрования;
С э – концентрация вещества.
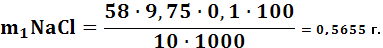
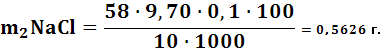
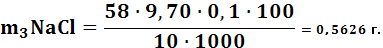
По результатам титрования рассчитываем процентное содержание NaCl по формуле:
Таблица 3.3 – Процентное содержание NaCl
| m,г NaCl | % NaCl |
| m1 | 96,71% |
| m2 | 96,23% |
| m3 | 96,26% |
3.4 Математическая обработка результатов анализа
Находим среднюю арифметическую для небольшого количества параллельных измерений:
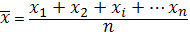 (3.5)
(3.5)
где: Х1, Хn– результаты отдельных вычислений;
n – количество отдельных вычислений.
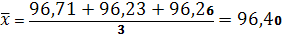
Находим отклонение (погрешность) единичного результата от среднего:
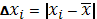 (3.6)
(3.6)
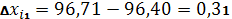
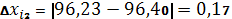
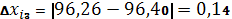
Рассчитываем абсолютную погрешность (среднюю арифметическую):
(3.7)

Находим относительную погрешность:
(3.8)

Вычисляем среднеквадратичную абсолютную погрешность (стандартное отклонение):

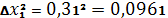
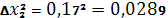
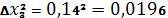
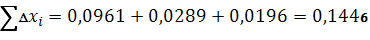
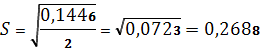
Рассчитываем относительную среднеквадратичную погрешность (коэффициент вариации):

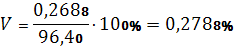
Вычисляем точность измерения:
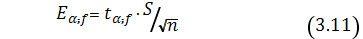
где:t – табличное значение коэффициента Стьюдента;
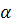 – доверительная вероятность;
– доверительная вероятность;
f– число степеней свободы.
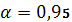
f = 2
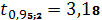
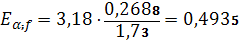
Находим доверительный интервал – границы в которых находится истинное значение определяемого параметра:
 , т.е.
, т.е. 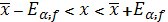
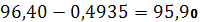
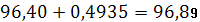
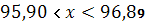
Таблица 3.4 - Математическая обработка результатов анализа
| Найден-ный% | 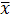
| 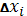
| 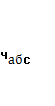
| 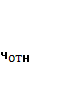
| 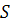
| 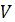
| Е0,95;2 | 
|
| 96,71% | 96,40 | 0,31 | 0,206 | 0,2137% | 0,2688 | 0,2788% | 0,4935 | 96,40 – 0,4935 |
| 96,23% | 0,17 | 96,40 + 0,4935 | ||||||
| 96,26% | 0,14 |
ВЫВОД
В курсовой работе я провела анализ поваренной соли на содержание основного вещества аргентометрическим методом. Изучила физические и химические свойства хлорида натрия. Рассмотрела существующие химические и инструментальные методы определения хлорид ионов: меркуриметрический метод, роданометрический метод, метод Фольгарда, нефелометрический метод, турбидиметрический метод и кондуктометрический метод. В экспериментальной части изложила сущность и теоретические основы аргентометрического метода анализа, правила техники безопасности. Представила данные результатов анализа. Выполнила математическую обработку полученных результатов анализа.
Основное содержание соли хлорида натрия находится в интервале значений: 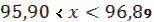
ЛИТЕРАТУРА
1 Крешков А.П., Ярославцева А.А. Курс аналитической химии. Количественный анализ. – М.: Химия, 1982.
2 Петров М.М., Михивев Л.А., Кукушкин Ю.Н. Неорганическая химия. – М.: Химия 1989.
3 Бабко А.К., Пилипенко А.Т., Пятницкий И.В., Рябушко О.П. Физико - химические методы анализа. – М.: Высшая школа 1968.
4 http://www.ximuk.ru/bse/3008.html.
5 http://multiring.ru.
Date: 2015-07-24; view: 517; Нарушение авторских прав