
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Способы получения
|
|
ХИНОЛИН
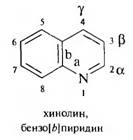
Хинолин представляет собой биниклическую систему, содержащую конденсированные пиридиновое и бензольное кольца. Его также можно рассматривать как гетероциклический аналог нафталина (1-азанафталин).
В пиридиновом кольце положения обозначаются греческими буквами
α (2), β (3), γ (4). Хинолин — бесцветная жидкость с неприятным запахом (tкип 237 °С), хорошо смешивается с водой, этанолом, диэтиловым эфиром, перегоняется с водяным паром.
Способы получения
Хинолин и его метильные производные получают из продуктов перегонки каменноугольной смолы.
Среди синтетических способов получения хинолина и его производных важнейшими являются синтез Скраупа и синтез Дебнера — Миллера.
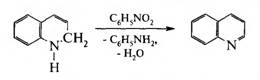
1. Синтез Скраупа. Для получения хинолина по методу Скраупа нагревают анилин с глицерином и конц. H2S04в присутствии окислителя — нитробензола:
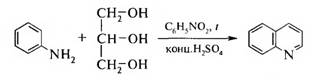
Механизм реакции включает три последовательные стадии.
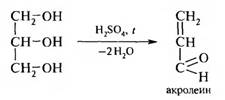
На первой стадии глицерин под действием конц. H2S04 подвергается дегидратации с образованием акролеина:
На второй стадии образовавшийся акролеин вступает в реакцию конденсации с анилином:
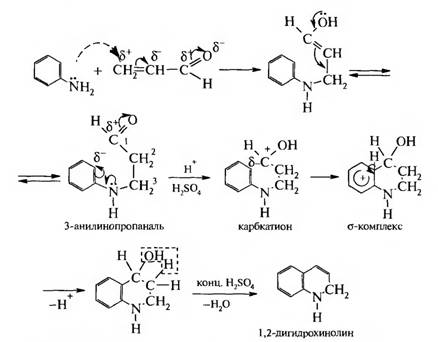
На третьей стадии реакции 1,2-дигидрохинолин окисляется нитробензолом в хинолин:
Для получения производных хинолина, содержащих заместители в бензольном кольце, вместо анилина используют его соответствующие производные со свободным орто-положением.
Реакция была открыта в 1881 г. австрийским химиком-органикомЗ.Х. Скраупом. В литературе эту реакцию иногда называют скраупированием.
2. СинтезДебнера — Миллера (реакция открытав 1881 году). Является модификацией синтеза Скраупа.
Его применяют для получения производных хинолина, содержащих алкильный заместитель в пиридиновом кольце.
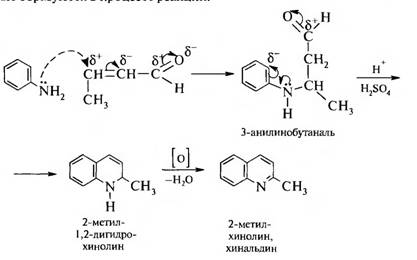
В качестве исходных веществ используют ароматический амин и альдегид, который может вступать в реакцию кротоновой конденсации. Синтез проводят в присутствии хлорида цинка (II), хлороводородной или другой минеральной кислоты.
Например, для получения 2-метилхинолина (хинальдина) используют анилин и ацетальдегид.
На первой стадии происходит кротоновая конденсация двух молекул альдегида с образованием α,β-ненасыщенного альдегида:
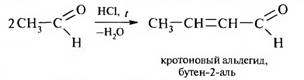
Далее происходит взаимодействие кротонового альдегида с анилином. Окислителями выступают азометины С6Н5—N=CH—R, которые образуются в процессе реакции:
Химические свойства
Хинолин является ароматическим соединением: его молекула имеет плоское строение и единую сопряженную 10π-электронную систему.
По химическим свойствам хинолин схож с пиридином. Для него характерны реакции:
• с участием гетероатома;
• электрофильного и нуклеофильного замещения;
• окисления;
• восстановления.
1. Реакции по гетероатому. Наличие в молекуле хинолина атома азота пиридинового типа обуславливает основные свойства. Как основание хинолин немного слабее пиридина.
 Хинолин образует соли с сильными кислотами, алкил- и ацилгалогенидами:
Хинолин образует соли с сильными кислотами, алкил- и ацилгалогенидами:
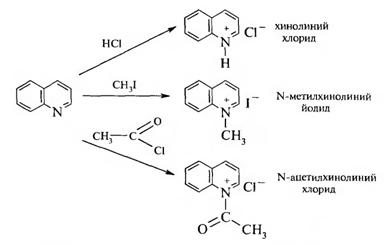
2. Реакции электрофильного и нуклеофильного замещения. В результате электроноакцепторного влияния гетероатома в молекуле хинолина электронная плотность распределена неравномерно: в пиридиновом кольце она ниже, чем в бензольном. Поэтому при действии электрофильных реагентов замещение проходит по бензольному кольцу, а нуклеофильное — по пиридиновому.
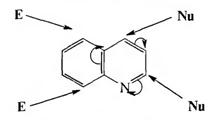
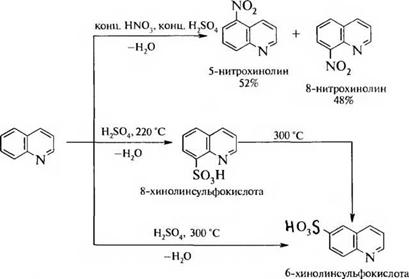
Реакции электрофильного замещения в молекуле хинолина протекают преимущественно по положению 5 и 8.
При обработке нитрующей смесью образуются 5- и 8-нитрохинолины. Сульфирование концентрированной серной кислотой при 220 °Сприводит к образованию 8-хинолинсульфокислоты, а при 300 °С — 6-хинолинсульфокислоты (в этих условиях происходит перегруппировка 8-изомера в более термодинамически выгодный 6-изомер):
|
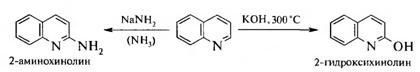
В реакции нуклеофильного замещения хинолин вступает значительно легче, чем пиридин. При этом реакции протекают по положению 2
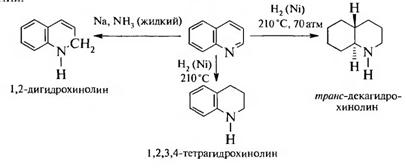
3. Реакции восстановления и окисления. При восстановлении хинолина в первую очередь восстанавливается пиридиновое ядро. Образование продуктов реакции зависит от катализатора и условий проведения.
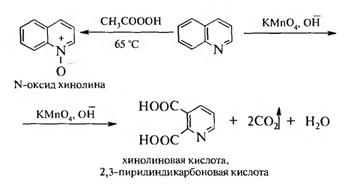
Окисление хинолина перманганатом калия в щелочной среде приводит к расщеплению бензольного кольца и образованию хинолиновой (2,3-пиридиндикарбоновой) кислоты. В присутствии пероксикислот хинолин образует N-оксид:
Важнейшие производные хинолина
Хинолиновое ядро является структурным фрагментом многих алкалоидов и лекарственных препаратов.
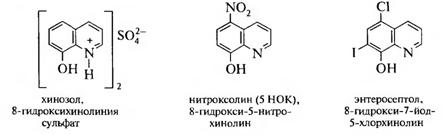
8-ГИДРОКСИХИНОЛИН
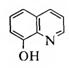
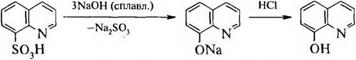
Бесцветное кристаллическое вещество с tпл 75—76 °С и характерным запахом, мало растворимо в воде, диэтиловом эфире, бензоле. Его получают нагреванием орто-аминофенола с глицерином в присутствии концентрированной серной кислоты (синтез Скраупа) или сплавлением 8-хинолинсульфокислоты со щелочью:
|
С катионами многих металлов (Mg2+, Al3+, Zn2+ и т. д) 8-гидрокси- хинолин способен образовывать нерастворимые координационные комплексы — хелаты, что используется в качественном анализе:
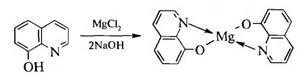
Это свойство 8-гидроксихинолина также лежит в основе его применения в медицине.
Множество производных этого соединения (хинозол, нитроксолин (5-НОК), энтеросептол) обладают антибактериальной и противогрибковой активностью
Date: 2015-07-22; view: 7565; Нарушение авторских прав