
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Проліферація
|
|
Даний процес принципово не залежить від типу пошкоджуючого фактора. Механізми репаративної регенерації грунтуються на механізмах фізіологічної, прикладом якої може бути регенерація слизової оболонки матки в постменструальний чи післяродовий період. Проліферативна фаза запалення одночасно є і фазою репаративної регенерації, а тому запалення і регенерація розділяються лише умовно.
Відновлення тканин залежить від тісної взаємодії клітин сполучної тканини між собою (ендотеліоцити, фібробласти, моноцити, макрофаги, лаброцити, лімфоцити), від взаємодії клітин сполучної тканини з міжклітинним матриксом (колагеном, протеогліканами, фібронектином), від взаємодії клітин сполучної тканини з клітинами крові і паренхіматозними елементами на грунті зворотнього зв’язку. Віддалена, короткодистантна і контактна міжклітинна взаємодія здійснюється за участю розчинних медіаторів (цитокінів), нерозчинних чи імобілізованих медіаторів (колаген, фібронектин, протеоглікани), прямих міжклітинних контактів, продуктів розпаду клітин та колагену (активні пептиді, нуклеотиди).
Процес проліферації у вогнищі запалення регулюється речовинами, які можуть стимулюваи (мітогени) чи пригнічувати (кейлони) розмноження клітин. Тканинними джерелами регенераційного матеріалу є камбіальні клітини – родоначальники усіх інших диференційованих клітинних компонентів конкретної тканини. Роль камбіальних клітин різних тканин відіграють стовбурові клітини, які знайдені не тільки в кровотворній системі, але й у кістковій тканині, у сім’яниках, лімфоїдній тканині та інших. Ці клітини знайдені в органах, що швидко відновлюються, камбіальний шар яких складається не тільки зі стовбурових клітин, але й з клітин-нащадків (наприклад, бласти в органах кровотворення).
Пошкодження тканин викликає інтенсивний поділ стовбурових клітин. Здатність деяких чинників викликати пошкодження, які важко загоюються (рентгенівське опромінення) пов’язане з загибеллю стовбурових, напівстовбурових та камбіальних клітинних елементів. Крім стовбурових клітин усі органи мають і сполучнотканинні елементи (строму), до яких належать фібробласти та гістіоцити. Останні в умовах запалення перетворюються в макрофаги.
Репаративна стадія запалення починається вже на етапі активного поглинання фагоцитами збудника чи пошкоджених тканин. В процесі розвитку запальної реакції клітини-учасники проліферативних процесів можуть відігравати головну або другорядну роль.
В фазі мікроциркуляторних реакцій головними клітинами проліферації є лаброцити. Вони здатні до активної взаємодії з макрофагами, фібробластами, міжклітинним матриксом, згортальною системою крові. Взаємодія цих клітин сприяє виділенню мітогенів. Зокрема, тромбоцити виділяють речовини, що підсилюють проліферацію та хемотаксис фібробластів до вогнища запалення: тромбоцитарний фактор росту фібробластів (PDGF), трансформуючий фактор росту (TGFβ), фактор росту епідермісу та фібробластів (EGF), пептид, що активує сполучну тканину (CTAP-3). Враховуючи, що лаброцити через гістамін та лейкотрієн В4 впливають на фібробласти, слід вважати, що підготовка репаративної фази запалення починається на самих ранній етапах патологічного процесу. Вплив нейтрофілів на репаративні процеси досить різноманітний. Відомо, що вони виділяють пептид, який активую ріст фібробластів (CTAP-PMN) і лейкотрієн, який активує фібробласти та фактор інгібіції міграції. Результати наукових досліджень довели, що проліферація фібробластів гальмується як надлишком нейтрофілів (гнійне запалення), так і їхнім дефіцитом (лазерне опромінення рани). Обробка міжклітинного матриксу нейтрофільними ферментами (колагеназа, еластаза) сприяє зміні властивостей колагену. Встановлено, що колаген і його пептиди стимулюють хемотаксис макрофагів і фібробластів.
Починаючи з макрофагальної фази запалення головними клітинами, що регулюють реперативні процеси, стають макрофаги. Вони відмежовують вогнище пошкодження від оточуючих тканин, формують нейтрофільно-макрофагальний, макрофагальний і макрофагально-фібробластичний бар’єр, який передує утворенню грануляційної тканини. Взаємодія макрофагів і фібробластів регулює ріст і інволюцію сполучної тканини, яка грунтується на принципі зворотнього зв’язку між розпадом та продукцією колагену. Продукти розпаду колагену, які утворюються при пошкодженні тканин протеазами, стимулюють хемотаксис макрофагів. Ці клітини фагоцитують продукти розпаду, що викликає їхню активацію і виділення фактора росту фібробластів та індукторів синтезу кколагену. Ці речовини передаються фібробластам, в тому числі за допомогою прямих міжклітинних контактів.
На сьогоднішній день відомі такі фактори:
1. Індуктори проліферації фібробластів: макрофагальний фактор росту (MDGF), фактор альвеолярних макрофагів (AMDGF), інтерлейкін-1 (IL-1), фактор некрозу пухлин (кахектин). Макрофаги здатні продукувати тромбоцитарні фактори росту (PDGF, TGFβ);
2. Індуктори хемотаксису фібробластів: фібронектин, PDGF, TGFβ, IL-1, кахектин;
3. Індуктори синтезу колагену: макрофагальний стимулятор ситезу (CEMF), кахектин, IL-1, TGF.
Взаємодія макрофагів і фібробластів викликає міграцію та прискорену проліферацію фібробластів, їхнє диференціювання, синтез та секрецію колагену та інших компонентів матриксу.
Активну участь у процесах репарації приймають лімфоцити. Серед лімфокінів, що виділяються ними, важливе місце займає Т-клітинний фактор (активує проліферацію клітин та продукцію колагенази), лімфоцитарний хемотаксичний фактор для фібробластів (LDGF-F), колагенсинтезуючий фактор (CPF), В-клітинний інгібітор продукції колагену, фібробласт-інгібуючий фактор (FIF), інгібуючий фактор росту. Виділення γ-інтерферону і α-інтерферону викликає гальмування хемотаксису, проліферацію клітин та синтез колагену. Регуляторна функція лімфоцитів на цьому етапі запалення залежить від взаємодії з макрофагами. Накопичення фібробластів у вогнищі запалення гальмує їхній ріст в результаті зупинки поділу зрілих клітин, які починають біосинтез колагену. Нові клітини вже не включаються в цей процес, внаслідок виснаження ростових факторів (на цьому етапі кількість клітин інфільтрації стає значно меншою), а також завдяки синтезу самими фібробластами при контактній взаємодії інібіторів росту – кейлонів. Встановлено, що фібробласти також синтезують речовини, які здатні стимулювати та інгібувати інші клітини, особливо макрофаги.
Синтез міжклітинного матриксу не є наслідком діяльності лише фібробластів. Ця функція здійснюється кооперативно. Так фібробласти здатні синтезувати колагени 1-го, 3-го, 5-го типів та фібронектин. Останній виробляється також макрофагами. Колагени 1-го, 3-го, 4-го, 5-го, 6-го та 8-го типів синтезуються епітеліальними клітинами печінки, легень та ін. органів, а колагени 4-го та 5-го типів – макрофагами, лімфоцитами та нейтрофілами.
Подальший етап авторегуляції росту сполучної тканини характеризується тим, що функціонально-надлишкові колагенові волокна в фазі рубцювання тісно взаємодіють з цитолемою фібробластів і викликають інгібування синтезу та секрецію колагену. Це також сприяє деструкції мембран фібробластів, руйнує більшість з них, а також викликає перетворення тих, що залишилися, в малоактивні фіброцити. Одночасно з цим активується процес фіброклазії, що передбачає знищення або фагоцитування самими фібробластами колагенових волокон та виділення колагенази. Таке контактне інгібування припиняє ріст сполучної тканини, а потім сприяє її перебудові (ремоделюванню). Ремоделювання сполучної тканини характеризується тим, що в одних ділянках вогнища запалення (функціонально активних) продовжується накопичення волокон, а в інших (функціонально інертних) відбувається лізис, а потім часткова (неповна) інволюція рубця. Активну участь у стимуляції лізису колагену приймають еозинофіли, лімфоцити, макрофаги.
На останньому етапі репаративного процесу у вогнищі запалення дуже важливою є паренхіматозно-стромальна взаємодія. Наприклад, епітелій продукує колагеназу, а стромальні клітини (лімфоцити, макрофаги і фібробласти) секретують фактори індукції та інгібіції регенерації епітелію і м’язів. Елементи колагенів 1-го, 3-го, 4-го, 5-го, 8-го та 13-го типів, протеогліканів і фібронектин впливають на паренхіматозні елементи пошкодженого органа (на функцію та архітектоніку) епітеліальної та м’язової тканини в молочній та підшлунковій залозах, в печінці, в шкірі, в нервовій системі.
Ще одним важливим продуктом репаративного процесу у вогнищі запалення є грануляційна тканина - молода сполучна тканина з великою кількістю судин. Ця тканина заповнює раньову поверхню, виразки шкіри, утворюється при пошкодженні слизових оболонок, внутрішніх органів, при переломах кісток, організації гематом, у вогнищах некрозу чи інфаркту, в ділянці формування запального ексудату, а також при хронічному запаленні. Грануляційна тканина – своєрідний “тимчасовий орган”, який утворюється в ділянці пошкодження з метою виконання певних функцій і зникає після їх виконання.
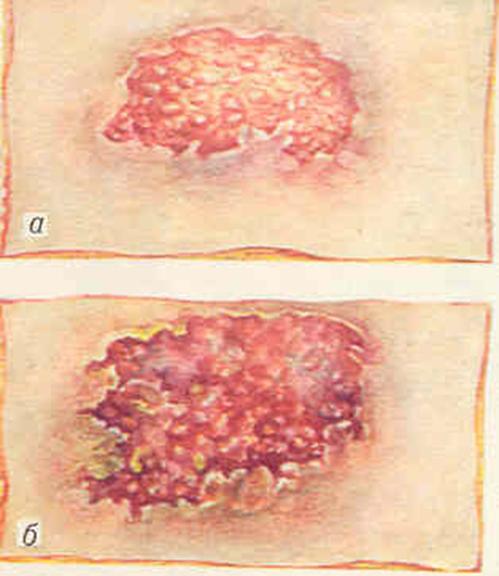
Функції цієї тканини наступні: механічна (заповнення дефекту), трофічна (регуляція мікроциркуляції, транспорт кисню і поживних речовин, вибіркова фільтрація речовин), морфогенетична (вплив на диференціювання епітелію та м’язової тканини). Проте головною функцією грануляційної тканини вважається захист від неблагоприємних впливів зовнішнього середовища, від інфекції та інтоксикації, інкапсуляція вогнища некрозу та чужорідних тіл, а також відновлення анатомічної та функціональної цілісності тканин шляхом повної чи неповної регенерації.
Слід пам’ятати, що ушкоджена тканина вогнища запалення в період активації проліферативних процесів та високої чутливості до мітогенів стає чутливою до дії канцерогенних речовин. Це є дуже небезпечним фактором у випадку хронічного запалення, яке може спровокувати розвиток пухлини.
Тривалість загоєння рани залежить від віддаленості її країв. Потилежні краї рани при її загоєнні направляються до центру. Механізм з’днання країв рани залежить від діяльності спеціалізованих клітин – міофібробластів, які містять плазму з контрактильними білками, подібно до м’язових клітин. Ці клітини завжди знаходяться на периферії рани і в центрі грануляційної тканини і дуже чутливі до зміни стану оточуючих ткани і парціального тиску кисню. Кінцевий механізм стягування країв рани характеризується синтезом колагену і основної речовини, тобто синтезом фіброзного рубця (колаген надає рубцю міцності).
Процес загоєння вогнища запалення супроводжується збільшенням споживання кисню внаслідок активації метаболічних процесів, а також вуглеводів, жирів, амінокислот, мінеральних солей, води. Процес заживлення тканинного дефекту (особливо, якщо він значний) ставить організм в складні умови, пов’язані з максимальним забезпеченням ділянки репарації всіма необхідними речовинами. Складність цієї вимоги викликана порушенням структури та функції системи мікроциркуляції пошкодженої ділянки. Саме грануляційній тканині, яка багата на судини, відводиться значна роль у процесі заживлення рани. Ріст мікросудин відбувається одночасно з проліферацією фібробластів. Макрофаги в цих умовах виділяють не тільки фактори росту, міграції фібробластів та синтезу колагену, але й синтезують фактор росту судин. Ріст капілярів стимулються деякими лімфокінами, тромбоцитарним фактором росту (PAF), β-трансформуючим фактором росту фібробластів (TGFβ), простагландином Е2. Синхронізація росту фібробластів і судин залежить від їхньої взаємодії. Фібробласти секретують фібронектин і колагени, які також необхідні для регуляції ангіогенезу. Встановлено, що капіляри ростуть в напрямку зменшення концентрації кисню в тканині, що пояснюється необхідністю метаболічного та енергетичного забезпечення клітин. Усунення гіпоксії тканин припиняє ріст судин.
Диференціювання фібробластів, біосинтез, фібрилогенез і фіброгенез колагену, взаємодія волокон з фібробластами, що зумовлює зупинку проліферації, руйнування клітин і фіброклазію, - все це приводить до дозрівання, перебудови і фіброзно-рубцевої трансформації грануляційної тканини, яка починається в глибоких її шарах. В цих умовах утворюються артеріо-венозні анастомози, а більшість капілярів грануляційної тканини починають регресувати.
Date: 2015-07-23; view: 1132; Нарушение авторских прав