
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Строение атома и периодический закон Д. И. Менделеева
|
|
Атомы состоят из атомного ядра и электронных оболочек. Атомное ядро включает протоны нейтроны с массовыми числами, равными единице. Массовое число ядра равно сумме протонов и нейтронов. Нейтроны электронейтральны, поэтому заряд ядра определяется только числом протонов. Так как химические свойства элементов зависят только от заряда ядра, то атомы с одинаковыми химическими свойствами и различными массами ядер называют изотопами. Существующие в природе элементы являются смесью изотопов, а атомная масса их выражает массу изотопов. Поэтому массовые числа атомов имеют нецелочисленные значения. Если один из изотопов наиболее распространен в природе, то атомная масса элемента примерно равна массе этого изотопа.
Число протонов в атоме равно числу электронов и равно порядковому номеру элемента.
Состояние электрона в атоме характеризуется четырьмя квантовыми числами. Главное квантовое число “n” определяет энергию уровня, на котором находится электрон и принимает целочисленные значения: 1, 2, 3, и т.д.
Орбитальное квантовое число l определяет форму электронного облака и принимает значения от 0 до (n-1). Так при n=4 орбитальное квантовое число может принимать значения 0, 1, 2, 3, а электроны с этими l называют s-, p-, d-, f -электронами.
Магнитное квантовое число m l определяет наклон электронного облака относительно магнитной оси атома в слабых магнитных или электромагнитных полях. Оно изменяется от - l до + l. Так при l =0, m l =0, а при l =4, m l может принимать значения -4, -3, -2, -1, 0, +1, +2, +3, +4.
Спиновое квантовое число ms характеризуется собственным механическим моментом электрона и принимает только два значения +1/2 и -1/2.
Заполнение энергетических уровней электронами происходит в порядке возрастания энергии уровней и подуровней в соответствии с правилами Клечковского. Поскольку сумма двух квантовых чисел (n+ l) определяет энергию электрона в атоме, то их и используют для указания энергетического состояния электрона. Сначала заполняется уровень 1s, затем 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d.
Энергетические уровни обозначаются цифрами 1, 2, 3 и т.д., рядом записываются буквами s, p, d, f-подуровни, на которых находятся электроны. Цифровой индекс в степени буквенного обозначения показывает количество электронов на данном подуровне. Это основа принципа написания структуры атома с помощью электронных формул. Например, структуру атома хлора можно изобразить с помощью электронной формулы: 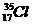 1s2, 2s2, 2p6, 3s2, 3p5, где показан символ элемента, его порядковый номер, относительная атомная масса, распределение электронов по уровням и подуровням. Валентные электроны подчеркнуты.
1s2, 2s2, 2p6, 3s2, 3p5, где показан символ элемента, его порядковый номер, относительная атомная масса, распределение электронов по уровням и подуровням. Валентные электроны подчеркнуты.
Для определения состояния электрона в многоэлектронных атомах важное значение имеет запрет Паули, согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. Каждая атомная орбиталь, характеризующаяся определенными значениями n, l, m l квантовых чисел, может быть занята только двумя электронами, спиновые характеристики которых имеют противоположные значения. Принцип Паули позволяет определить максимальное число электронов на различных энергетических уровнях и подуровнях атома. Два электрона, находящиеся на одной орбитали, называются спаренными, в отличие от одиночных электронов (неспаренных).
Если электроны заполняют подуровни с одинаковой энергией, то по правилу Гунда они распределяются так, чтобы число неспаренных электронов было максимально. Устойчивому состоянию атома способствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. При этом заполненный наполовину или полностью заполненный подуровень имеет повышенную устойчивость, но если недостает одного-двух электронов для такого типа заполнения, то обычно этот электрон переходит с другого энергетического уровня. Это явление названо “проскок” или “провал” электрона.
Менделеев считал, что основной характеристикой элементов являются их атомные веса, и в 1869г. впервые сформулировал Периодический закон: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Данные о строении ядра и о распределении электронов в атомах позволяют по-новому рассмотреть периодический закон и Периодическую систему элементов. На базе современных представлений периодический закон формулируется так: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Из рассмотрения электронных конфигураций атомов наглядно проявляется периодичность свойств элементов.
По мере роста заряда ядра периодически повторяются сходные электронные структуры элементов, а следовательно, и повторяются их свойства, зависящие от строения электронной оболочки атомов.
Элементы, в зависимости от того, какой подуровень в атоме заполняется в последнюю очередь (s-, p-, d-, f-подуровень), делятся на s-, p-, d-, и f-элементы.
Химические элементы по строению электронных оболочек невозбужденных атомов объединяются в естественные совокупности, которые представлены в Периодической системе горизонтальными и вертикальными рядами – периодами и группами.
По числу энергетических уровней в Периодической системе элементы подразделяются на семь периодов, три из которых (первый, второй и третий) малые, а остальные – большие периоды (седьмой период незавершен). Различная длина периодов объясняется различием в последовательности заполнения электронных уровней (внешних и более близких к ядру). Первый период состоит из 2-х элементов (два s- элемента). Второй и третий периоды содержат по 8 элементов (два s- и шесть р-элементов). Четвертый и пятый периоды содержат по 18 элементов (два s-, десять d- и шесть р-элементов). Шестой период содержит 32 элемента (шесть s-, четырнадцать f-, десять d- и шесть p-элементов). В седьмом периоде имеются два s-элемента, четырнадцать f- и десять d-элементов, это элементы 106-110. В противоположность предыдущему периоду седьмой период не завершен.
d- и f-элементы данного периода объединяются в семейства. В четвертом, пятом, шестом периодах эти семейства состоят из десяти 3d- (Sс – Zn), 4d- (Y – Cd) и 5d- (La, Hf – Нg) элементов. В шестом, седьмом периодах это семейства – из четырнадцати 4f - элементов-лантаноидов (Ce – Lu) и 5f-элементов (Th – Lr).
Элементы Периодической системы подразделяются на восемь групп. Это соответствует максимальному числу электронов на внешнем уровне их невозбужденных атомов.
Элементы групп подразделяются на подгруппы: s- и р-элементы составляют главную подгруппу или подгруппу А, d- и f-элементы – побочные или подгруппу В.
Свойства элементов, определяемые электронной оболочкой атома, закономерно изменяются по периодам и группам Периодической системы. Химическая природа элемента обусловлена способностью его атома терять и приобретать электроны. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону.
Энергией ионизации называется количество энергии, необходимое для отрыва электрона от невозбужденного атома. Наименьшей энергией ионизации обладают s-элементы I группы, наибольшей – s- и p-элементы VIII группы.
Сродством к электрону называется энергетический эффект присоединения электрона к нейтральному атому с превращением его в отрицательный ион. Наибольшим сродством к электрону обладают р-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar).
Электроотрицательность – это способность атома оттягивать на себя электронную плотность (по сравнению с атомами других элементов в соединении). В периодах с увеличением порядкового номера элемента наблюдается общая тенденция роста электроотрицательности элементов, а в группах – ее падение. Наименьшая электроотрицательность у s-элементов I группы, а наибольшая – у р-элементов VII группы.
КОНТРОЛЬНЫЕ ВОПРОСЫ
Кто, где, когда впервые заговорил об атоме?
Что такое атом, нуклоны? Дать им характеристику. Какие атомы называются изотопами?
Назвать имена ученых, давших первые значимые модели атома, указать положительные и отрицательные стороны этих моделей.
Что значит двойственная природа материальной частицы? Что такое волна Де-Бройля?
Что изучает наука квантовая механика? Что такое уравнение состояния квантовой механики (уравнение Шредингера, волновое уравнение)?
Дать понятие атомной орбитали (электронного облака).
Какие квантовые числа вы знаете, зачем они нужны?
Что такое главное квантовое число? Сформулировать понятие энергетического уровня, спектра атомов.
Что такое орбитальное квантовое число? Дать понятие s-, p-, d-, f-
подуровней. Какова форма электронных облаков?
Что такое магнитное квантовое число, спиновое квантовое число? Что они характеризуют?
Каков порядок заполнения электронами энергетических уровней и подуровней в многоэлектронных атомах?
Сформулировать правило Гунда. Дать понятие атомного остова, валентных электронов, основного и возбужденного состояния атомов.
Зачем нужно знание электронных структур атомов элементов?
Как был открыт Д. И. Менделеевым периодический закон? Дать формулировку периодического закона, предложенную Д. И. Менделеевым.
Какой вклад внес Мозли в современную трактовку периодического закона?
Какова структура Периодической системы элементов Д. И. Менделеева? Дать понятие периода, группы, подгруппы.
В чем причина периодического изменения свойств элементов и их соединений?
Как по положению элемента в таблице Д. И. Менделеева предсказать состав ядра, структуру электронной оболочки, число валентных электронов, свойства его самого и его основных соединений?
Дать понятие атомных и ионных радиусов элементов, энергии ионизации, сродства к электрону, электроотрицательности.
ВАРИАНТЫ КОНТРОЛЬНЫХ ЗАДАНИЙ
Вариант 1
| Какой из элементов имеет ns2,(n-1)d5 конфигурацию валентных электронов? | А 24Cr Б 25Mn В 17Cl Г 33As | |
| Какую валентность проявляет хлор 17Сl в состоянии максимального возбуждения валентных электронов? | А 5 Б 3 В 7 Г 9 | |
| Какова структура шестого уровня (n=6) невозбужденного атома вольфрама 74W? | А 6s24f145d4 Б 6s2 В 6s24f145p4 Г 6s25d4 | |
Определить количество электронов, протонов и нейтронов в структуру атома 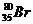 ? ?
| А 45, 35, 80 Б 35, 35, 45 В 35, 35, 80 Г 80, 35, 45 | |
| Какую максимальную степень окисления может проявлять хром 24Cr? | А 6 Б 4 В 8 Г 2 | |
| Сколько энергетических уровней занимают электроны у атома свинца 82Pb? | А 6 Б 4 В 7 Г 2 | |
| В каком из приведенных рядов расположены только изотопы? | А 16О, 32S, 12C Б 39K, 40Ca, 45Sc B 40Ar, 39K, 40Ca Г 16O, 17O, 18O, | |
| Распределите по энергетическим ячейкам электроны атома элемента с порядковым номером 25. Сколько неспаренных d-электронов в этом атоме? | А 3 Б 5 В 6 Г 7 | |
| Написать электронную формулу атома ртути 80Hg | ||
| Сформулировать правило Гунда. Показать графическое распределение электронов для невозбужденного и возбужденного атома серы. |
Вариант 2
| Какой из элементов имеет ns2,(n-1)d8 конфигурацию валентных электронов? | А 28Ni Б 27Co В 54Xe Г 36Kr | |
| Какую валентность проявляет йод 53I в состоянии максимального возбуждения? | А 7 Б 1 В 4 Г 5 | |
| Какова структура пятого уровня (n=5) невозбужденного атома гафния 72Hf? | А 5s2d10 5p6 Б 5s25p65d2 В 5s25p64f14 Г 5s2 5p64d6 | |
Определить количество электронов, протонов и нейтронов у атома платины 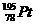 ? ?
| А 195, 78,78 Б 78, 78, 117 В 117, 195, 78 Г 195, 78, 117 | |
| Составьте электронную формулу атома элемента с порядковым номером 16 и укажите число неспаренных электронов в максимально возбужденном состоянии. | А 1 Б 2 В 4 Г 6 | |
| Какие значения принимает магнитное квантовое число для орбиталей d-подуровня? | А 0, 1, 2 Б -1, 0, +1 В -2, -1, 0, +1, +2 Г 1, 2, 3 | |
| Сколько электронов на подуровне 5d у атома рения 75Re? | А 5 Б 10 B 8 Г 6 | |
| Сколько энергетических уровней у атома радия 88Ra? | А 5 Б 7 В 6 Г 3 | |
| Написать электронную формулу атома плутония 94 Pu. | ||
| Что такое орбитальное квантовое число? Дать понятие s-, p-, d, f-подуровней. Какова форма электронных облаков? |
Вариант 3
| Какой из элементов имеет ns2,(n-2)f14,(n-1)d10,np2 конфигурацию валентных электронов? | А 82 Pb Б 50 Sn В 83 Hf Г 73 Zr | |
| Сколько энергетических уровней у атома ртути 80Hg? | А 7 Б 6 В 5 Г 4 | |
Определите количество электронов, протонов и нейтронов в структуре атома галлия 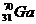 ? ?
| А 31,39,31 Б 70,31,31 В 70,31,39 Г 31,31,39 | |
| Какое квантовое число характеризует направление электронного облака в пространстве? | А n Б l В m l Г ms | |
| Сколько химических элементов в главной подгруппе четвертой группы? | А 4 Б 5 В 6 Г 7 | |
| Сколько электронов на подуровне 4р у атома германия 32Ge? | А 5 Б 6 В 2 Г 4 | |
| Какую максимальную положительную степень окисления имеет атом фосфора 15Р? | А 4 Б 5 B 6 Г 7 | |
| Какова структура третьего уровня (n=3) для атома никеля 28Ni? | А 4s23d84p6 Б 3s23p63d8 В 3s24p63d10 Г 3s23p63d10 | |
| Написать электронную формулу атома висмута 83Bi. | ||
| Что такое главное квантовое число? Дать понятие энергетического уровня. Каковы спектры атомов? |
Вариант 4
| Какой из элементов имеет ns2,(n-2)f11 конфигурацию валентных электронов? | А 80Hg Б 67 Ho В 75 Re Г 81 Tl | |
| Какую валентность проявляет атом хлора 17Cl в состоянии максимального возбуждения? | А 5 Б 7 В 6 Г 4 | |
| Какова электронная структура пятого уровня (n=5) для невозбужденного атома олова 50Sn? | А 5s24d105p2 Б 5s25p2 В 4d105s25p3 Г 5s24f14 | |
| Сколько химических элементов в пятом периоде? | А 8 Б 9 В 18 Г 32 | |
Определите количество электронов, протонов и нейтронов у атома полония 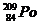 . .
| А 8,209,84,84 Б 6,84,84,125 В 10,84,84,209 Г 16,125,209,84 | |
| Какое квантовое число характеризует энергию электрона на уровне? | А n Б l В m l Г m l | |
| Какую максимальную степень окисления проявляет атом хрома 24Cr? | А 3 Б 4 B 6 Г 8 | |
| Сколько энергетических уровней у атома ртути 80Hg? | А 7 Б 6 В 4 Г 5 | |
| Написать электронную формулу атома гафния 72Hf. | ||
| Сформулировать принцип Паули. Каков порядок заполнения электронами энергетических уровней и подуровней в многоэлектронных атомах? |
Вариант 5
| Какой из элементов имеет ns2,(n-2)f14, (n-1)d1 конфигурацию валентных электронов? | А 39 Y Б 49 In В 57 La Г 29 Cu | |
| Какую валентность проявляет хром 24 Cr в состоянии максимального возбуждения? | А 5 Б 8 В 7 Г 6 | |
| Какова структура третьего уровня (n=3) для невозбужденного атома ванадия 23 V? | А 3s23p63d10 Б 3s23p63d3 В 4s2 3d104p6 Г 4s24d104p6 | |
Определить количество электронов, протонов и нейтронов у атома иттрия 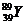 . .
| А 29,39,39,89 Б 89,39,89,50 В 60,89,89,39 Г 88,39,39,50 | |
| Какое квантовое число характеризует вращение электрона вокруг своей оси? | А n Б l В m l Г ms | |
| У какого элемента начинает заполняться 3d- подуровень? | А 21 Sc Б 39 Y В 29 Cu Г 47 Ag | |
| Сколько электронов на подуровне 4d у атома серебра 47 Ag? | А 9 Б 10 B 6 Г 2 | |
| Сколько энергетических уровней у атома радия 88Ra? | А 5 Б 6 В 7 Г 4 | |
| Написать электронную формулу атома франция 87 Fr. | ||
| Что такое магнитное квантовое число? Какова ориентация электронных облаков в пространстве? Чему равно максимальное число электронов на атомной орбитали? |
Вариант 6
| Какую валентность проявляет теллур 52Te в состоянии максимального возбуждения? | А 4 Б 6 В 7 Г 5 | |
| Какова структура четвертого уровня (n=4) для атома осмия 76Os? | А 4s24p64d104f2 Б 4s24d104p64f14 В 4s24p64f8 Г 4s24p64d104f14 | |
| Какой элемент имеет ns2,(n-2)f14,(n-1)d2 конфигурацию валентных электронов? | А 74 W Б 43 Tc В 40 Zr Г 72 Hf | |
Сколько электронов, протонов и нейтронов в структуре атома хлора 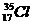 ? ?
| А 35,17,17,18 Б 18,17,35,18 В 14,35,35,17 Г 17,17,18,35 | |
| Какую отрицательную степень окисления проявляет азот 7 N? | А -5 Б -3 В -2 Г -1 | |
Как изменяется устойчивость гидридов в ряду?
H2O 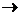 H2S H2S 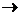 H2Se H2Se 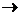 H2Te H2Te
| А падает Б возрастает В не изменяется | |
| Сколько электронов у атома серебра 47Ag на 4d-подуровне? | А 7 Б 6 B 10 Г 9 | |
| Сколько подуровней включает уровень при значении главного квантового числа n=4? | А 1 Б 3 В 5 Г 4 | |
| Написать электронную формулу атома молибдена 42 Mo. | ||
| Какова современная формулировка периодического закона. Дать понятие периода, группы, подгруппы в периодической системе Д. И. Менделеева. |
Вариант 7
| Какой из элементов имеет конфигурацию валентных электронов 4s2, (n-1)d10, np4 | А 24Cr Б 34 Se В 23 V Г 16 S | |
| Какую валентность проявляет атом фосфора 15Р в состоянии максимального возбуждения? | А 5 Б 6 В 7 Г 4 | |
| Какова структура пятого уровня (n=5) для наиболее распространенного изотопа атома астата 85At? | А 5s25p65d106p5 Б 5s25p65d105f14 В 6s24f145d10 Г 6s24f145d106p5 | |
Сколько электронов, протонов и нейтронов в структуре атома бария 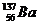 ? ?
| А 56,81,81,56 Б 138,137,56,56 В 139,56,56,137 Г 83,56,56,81 | |
| Распределить по энергетическим ячейкам электроны атома элемента с порядковым номером 24. Сколько неспаренных d-элементов в этом атоме? | А 3 Б 4 В 5 Г 6 | |
| Какое водородное соединение наименее устойчиво? | А Hf Б HBr В HCl Г HI | |
| Сколько энергетических ячеек на подуровне 4f? | А 14 Б 7 B 10 Г 5 | |
| Сколько электронов у атома вольфрама 74W на пятом уровне (n=5)? | А 18 Б 12 В 14 Г 32 | |
| Написать электронную формулу атома свинца 82 Pb. | ||
| Как электронографический метод изображает распределение электронов в атоме? Сформулировать правило Гунда. Что такое атомный остов и валентные электроны? |
Вариант 8
| Сколько энергетических уровней занимают электроны в атоме рения 75Re? | А 6 Б 4 В 5 Г 7 | |
| Какова структура шестого уровня (n=6) атома платины 78Pt? | А 6s26p6 Б 6s2 В 6s1 Г 6s26p4 | |
| Сколько электронов находится на третьем уровне (n=3) у атома кобальта 27Со? | А 15 Б 10 В 8 Г 18 | |
| Какую валентность проявляет бром 35Br в состоянии максимального возбуждения? | А 56,81, Б 138,137,56,56 В 139,56,56,137 Г 83,56,56,81 | |
| Какой элемент имеет ns2(n-1)d3 конфигурацию валентных электронов? | А 23 V Б 27 Co В 7 N Г 73 Ta | |
| Какую отрицательную степень окисления проявляет сера 16 S? | А -4 Б -6 В -2 Г -3 | |
| Сколько электронов у тербия 65Tb на уровне с n=4, учитывая проскок электрона с подуровня 5d? | А 31 Б 27 B 24 Г 26 | |
| Сколько энергетических ячеек на подуровне f? | А 3 Б 6 В 5 Г 7 | |
| Написать электронную формулу атома эрбия 68 Er. | ||
| Какова формулировка закона Мозли? Как построено ядро атома? Какова современная формулировка периодического закона? |
Вариант 9
| Какой из элементов имеет ns2(n-2)f4 конфигурацию валентных электронов? | А 61Pm Б 60 Nd В 57 La Г 81 Tl | |
| Какую валентность проявляет селен 34Se в состоянии максимального возбуждения? | А 7 Б 6 В 5 Г 8 | |
| Какова структура четвертого уровня (n=4) для невозбужденного атома висмута 83Bi? | А 4s23d104p6 Б 4s24d104p64f14 В 4s24d104f14 Г 6s25d104f145p3 | |
Сколько электронов, протонов и нейтронов в структуре атома циркония 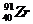 ? ?
| А 91,91,91,40 Б 40,40,40,51 В 51,40,51,91 Г 92,40,40,91 | |
| Чему равно число электронов у иона Zn2+? | А 28 Б 30 В 32 Г 34 | |
| Чему равно число электронов в ионе Р3-? | А 15 Б 12 В 15 Г 18 | |
| Сколько электронов на подуровне 3р у атома аргона 18Ar? | А 7 Б 4 B 8 Г 6 | |
| Сколько энергетических уровней у атома радона 86Rn? | А 5 Б 6 В 7 Г 8 | |
| Написать электронную формулу атома вольфрама 74W. | ||
| Какова структура Периодической системы Д. И. Менделеева? В чем причина периодического изменения свойств элементов и их соединений? |
Вариант 10
| Какой из элементов имеет ns2(n-2)f7,(n-1)d1 конфигурацию валентных электронов? | А 65Tb Б 64 Gd В 63 Eu Г 72 Hf | |
| Сколько энергетических уровней у атома курчатовия 104Ku? | А 5 Б 6 В 7 Г 4 | |
| Составьте электронную формулу элемента с порядковым номером 17. Укажите число неспаренных электронов в максимально возбужденном состоянии. | А 2 Б 4 В 6 Г 7 | |
| Какие значения принимает магнитное квантовое число для орбиталей f-подуровня. | А 0,1,2,3,4 Б -1,0,+1 В -2,-1,0,+1,+2 Г -3,-1,0,+1,+2,+3 | |
Сколько электронов, протонов и нейтронов в ядре атома меди 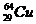 ? ?
| А 63,29,29,64 Б 64,29,64,35 В 29,35,29,64 Г 35,29,29,35 | |
| Сколько электронов на подуровне 5d у атома вольфрама 74W? | А 5 Б 10 В 4 Г 6 | |
| Какую максимальную положительную степень окисления имеет атом йода 53I? | А 5 Б 6 B 7 Г 4 | |
| Какова структура четвертого уровня (n=4) для атома лантана 57La? | А 6s25d1 Б 5s25p65d1 В 4s24p64d104f14 Г 4s24p64d10 | |
| Написать электронную формулу атома таллия 81Tl. | ||
| Дать понятие атомных и ионных радиусов элементов, энергии ионизации. Как они изменяются по Периодической системе Д. И. Менделеева? |
Вариант 11
| Какой из элементов имеет ns2,(n-2)f14,(n-1)d6 конфигурацию валентных электронов? | А 26 Fe Б 76 Os В 78 Pt Г 46 Pd | |
| Какую валентность проявляет атом хрома 24Cr в состоянии максимального возбуждения? | А 7 Б 6 В 5 Г 4 | |
| Какова структура четвертого уровня (n=4) для наиболее распространенного изотопа атома гадолиния 64Gd? | А 6s24f145d10 Б 6s25f145d10 В 4s24p64d104f7 Г 6s24f7 | |
Сколько электронов, протонов и нейтронов в структуре атома кальция 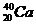 ? ?
| А 20,20,20,40 Б 40,20,20,20 В 22,20,40,20 Г 24,40,20,20 | |
| В каком из приведенных рядов элементов электроотрицательности возрастает (слева направо) | А 9F ® 17Cl ® 35Br Б 3Li ® 11Na ®19K В 16S ® 34Se ®52 Te Г 14Si® 15P ® 16 S | |
| Какой из следующих элементов находится в четвертой группе? | А Fe Б C В Cr Г K | |
| Сколько энергетических ячеек на подуровне 4f? | А 14 Б 10 B 7 Г 5 | |
| Сколько электронов у атома молибдена 42Mo на четвертом уровне (n=4), учитывая проскок электрона? | А 18 Б 13 В 16 Г 12 | |
| Написать электронную формулу атома нептуния 93Np. | ||
| В чем заключается принцип минимума энергии при заполнении электронами уровней и подуровней в атоме? Каково отличие идеального и реального порядка заполнения электронами орбиталей? |
Вариант 12
| Какой из элементов имеет ns2,(n-1)d10,np4 конфигурацию валентных электронов? | А 16 S Б 81Tl В 33As Г 34Se | |
| Сколько энергетических уровней занимают электроны в атоме олова 50Sn? | А 6 Б 5 В 4 Г 7 | |
| Какова структура четвертого уровня (n=4) атома молибдена 42Mo? | А 4s24р44d7 Б 4s24p64d5 В 4s24p64d4 Г 4s24p64d6 | |
| Сколько энергетических ячеек на подуровне d? | А 3 Б 7 В 4 Г 5 | |
| У какого атома с приведенным строением энергетических уровней сильнее выражены неметаллические свойства? | А 3s23p2 Б 3s23p4 В 3s23p6 Г 3s2 | |
| Какая валентность характерна для атома азота 7N в невозбужденном состоянии? | А 3 Б 5 В 2 Г 1 | |
| Какую отрицательную степень окисления проявляет германий 32Ge? | А -6 Б -4 B -2 Г -3 | |
Сколько электронов, протонов и нейтронов в ядре атома цинка 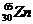 ? ?
| А 35,30,30,65 Б 30,30,35,65 В 40,30,30,35 Г 28,65,30,30 | |
| Написать электронную формулу атома полония 84Ро. | ||
| Как рассчитать максимальное число электронов на энергетическом уровне и энергетическом подуровне? |
Вариант 13
| Сколько энергетических уровней занимают электроны в атоме осмия 76Os? | А 5 Б 6 В 4 Г 7 | |
| Какой элемент имеет конфигурацию валентных электронов ns2,(n-2)f12. | А 69Tm Б 68 Er В 58 Ce Г 84 Po | |
| Сколько электронов находится у атома радона 86Rn на пятом уровне (n=5)? | А 32 Б 18 В 10 Г 14 | |
| Определить положительную и отрицательную степень окисления у атома висмута 83Bi? | А +3, -5 Б +4, -4 В +5, -3 Г +1, -7 | |
| На каких энергетических уровнях нет d-подуровней? | А 1, 2 Б 1, 3 В 6, 7 Г 4, 5 | |
| В каком из предложенных рядов элементов сродство к электрону практически отсутствует? | А 9Li ®11Na ®19K Б 16S ® 34Se ® 52Te В 14S i®15P ® 16 S Г 6C ® 7N ® 8O | |
| Сколько энергетических ячеек на подуровне 4f? | А 14 Б 7 B 6 Г 3 | |
Сколько электронов, протонов и нейтронов в структуре атома криптона 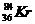 ? ?
| А 84,84,84,36 Б 36,36,36,48 В 47,36,48,84 Г 83,36,36,84 | |
| Написать электронную формулу атома урана 92U. | ||
| Как по положению элемента в таблице Д. И. Менделеева предсказать состав ядра, структуру электронной оболочки атома, число валентных электронов? |
Вариант 14
| Какой из элементов имеет конфигурацию валентных электронов ns1,(n-1)d5? | А 43Tc Б 42 Mo В 44 Ru Г 75 Re | |
| Какую валентность проявляет бром 35Br в состоянии максимального возбуждения? | А 5 Б 6 В 7 Г 4 | |
| Какова структура пятого уровня (n=5) для наиболее распространенного изотопа атома свинца 82Pb? | А 6s24f145d10 Б 6s24f145d106p2 В 5s25p65d10 Г 5s25p65d105f14 | |
Сколько электронов, протонов и нейтронов в структуре атома урана 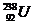 ? ?
| А 92,92,92,176 Б 238,92,176,238 В 237,92,92,238 Г 146,238,92,92 | |
| Чему равно число орбиталей на f-подуровне? | А 1 Б 3 В 5 Г 7 | |
| Атомы какого элемента имеют электронную конфигурацию внешнего слоя:...4s24p6? | А 35Br Б 7 N В 33As Г 23 V | |
| Сколько энергетических ячеек на подуровне 3d? | А 10 Б 5 B 3 Г 6 | |
| Сколько электронов у атома празеодима 59Pr на уровне с n=4, учитывая проскок электрона? | А 22 Б 21 В 18 Г 24 | |
| Написать электронную формулу атома диспрозия 66Dy. | ||
| Что такое волновое уравнение Шредингера, волновая функция электрона? Дать понятие атомных орбиталей. |
Вариант 15
| Какую валентность проявляет теллур 52Te в состоянии максимального возбуждения? | А 4 Б 6 В 7 Г 5 | |
| Какой из элементов имеет ns2,(n-1)d5 конфигурацию валентных электронов? | А 24Cr Б 25 Mn В 17 Cl Г 33 As | |
| Какова структура четвертого уровня (n=4) для атома осмия 76Os? | А 4s24d84p64f2 Б 4s2 4d104p6 4f14 В 4s24p64f8 Г 4s24p64d104f14 | |
Сколько электронов протонов и нейтронов в структуре атома брома 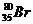 ? ?
| А 24,35,35,80 Б 35,35,45,80 В 54,80,35,35 Г 79,35,35,45 | |
| У какого атома,с приведенным строением энергетических уровней сильнее выражены металлические свойства? | А...3s23p1 Б...3s23p4 В...3s23p6 Г...3s2 | |
| Сколько подуровней включает четвертый уровень с n=4? | А 1 Б 2 В 5 Г 4 | |
| Какую отрицательную степень окисления проявляет сера 16S? | А -4 Б -2 B -6 Г -3 | |
| Сколько элементов в шестом периоде? | А 32 Б 18 В 8 Г 2 | |
| Написать электронную формулу атома цезия 55Cs. | ||
| Как изменяются радиусы атомов в четвертом периоде с увеличением атомной массы? |
Вариант 16
| Какой из элементов имеет ns2,(n-2)f7 конфигурацию валентных электронов? | А 63Eu Б 104Ku В 81Tl Г 50Sn | |
| Какую валентность проявляет теллур 52Te в состоянии максимального возбуждения? | А 5 Б 6 В 7 Г 4 | |
| Какова структура шестого уровня (n=6) для невозбужденного атома ртути 80Hg? | А 6s2 Б 6s2 4f145d10 В 6s26f146d10 Г 6s26p6 | |
| Сколько элементов в главной подгруппе пятой группы? | А 3 Б 4 В 5 Г 8 | |
Как изменяется устойчивость гидридов в ряду?
H2O 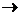 H2S H2S 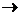 H2Se H2Se 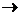 H2Te H2Te
| А падает Б возрастает В не меняется | |
Сколько электронов протонов и нейтронов в структуре атома астата 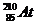 ? ?
| А 210,85,125,210 Б 85,210,85,85 В 125,85,85,125 Г 86,210,210,85 | |
| Сколько электронов на подуровне 4f у атома неодима 60Nd? | А 4 Б 3 B 7 Г 14 | |
| Сколько энергетических уровней у атома радия 88Ra? | А 3 Б 5 В 7 Г 4 | |
| Написать электронную формулу атома осмия 76Os. | ||
| Что такое волновая функция электрона? Сформулировать принцип неопределенности Гейзенберга. |
Вариант 17
| Какое максимальное валентное состояние может проявлять атом брома 35Br? | А 5 Б 7 В 9 Г 1 | |
| Какова структура невозбужденного атома свинца 82Pb на шестом (n=6) энергетическом уровне? | А 6s26p2 Б 6s26p3 В 6p4 Г 6s26d2 | |
| Какое значение может принимать магнитное квантовое число при орбитальном квантовом числе l =1. | А -1,0,+1 Б -2,-1,0,+1,+2 В -1,0 Г -2,-1,0 | |
| Определите количество электронов у атома железа 26Fe на третьем энергетическом уровне (n=3)? | А 16 Б 14 В 10 Г 20 | |
| Сколько энергетических уровней у атома платины 78Pt? | А 5 Б 7 В 6 Г 3 | |
| Каково максимально возможное число подуровней на пятом энергетическом уровне? | А 4 Б 5 В 7 Г 3 | |
| Какой элемент имеет конфигурацию валентных электронов ns2,(n-1)d4? | А 42Mo Б 43Tc B 74W Г 41Nb | |
| Сколько нейтронов в ядре у атома рения 75Re? | А 75 Б 186 В 111 Г 101 | |
| Составьте электронную формулу атома ксенона 54Хе. | ||
| Назвать четыре квантовых числа, охарактеризовать их физический смысл. |
Вариант 18
| Какой из элементов имеет конфигурацию валентных электронов ns2,(n-2)f9? | А 72Hf Б 63Eu В 65Tb Г 83Bi | |
| Какую валентность проявляет атом сурьмы 51Sb в состоянии максимального возбуждения? | А 6 Б 5 В 4 Г 3 | |
| Какова структура шестого уровня (n=6) для наиболее распространенного изотопа золота 79Au? | А 6s1 Б 6s26p6 В 6s24f145d10 Г 6s26p66d10 | |
Сколько электронов, протонов и нейтронов у атома теллура 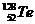 ? ?
| А 127,52,52,128 Б 128,52,128,76 В 52,76,76,52 Г 76,52,52,76 | |
| Какие значения принимает орбитальное квантовое число для второго энергетического уровня? | А 0,1,2 Б -2,-1,0,+1,+2 В 0,1 Г 1 | |
| У какого атома большее число неспаренных электронов в нормальном состоянии? | А 11Na Б 14Si В 15P Г 16S | |
| Сколько энергетических ячеек на подуровне 5f? | А 5 Б 7 B 14 Г 10 | |
| Сколько электронов у атома палладия 46Pd на четвертом уровне (n=4), учитывая проскок электрона? | А 20 Б 16 В 18 Г 14 | |
| Написать электронную формулу атома бария 56Ва. | ||
| В чем причина периодического изменения свойств элементов и их соединений? Какие элементы мы называем электронными и химическими аналогами. |
Вариант 19
| Сколько энергетических уровней занимают электроны в атоме астата 85 At? | А 4 Б 6 В 5 Г 7 | |
| Какой элемент имеет конфигурацию валентных электронов ns2,(n-2)f14,(n-1)d5? | А 84Po Б 75Pe В 52Te Г 72Hf | |
| Сколько электронов находится у атома тантала 73Ta на четвертом уровне (n=4)? | А 18 Б 32 В 10 Г 16 | |
| Какова положительная и отрицательная степень окисления у атома селена 34Se? | А +6,-2 Б +5,-3 В +4,-4 Г +7,-1 | |
| Чему равно число электронов в ионе Cl-? | А 7 Б 12 В 18 Г 20 | |
| Сколько рядов в периодической системе? | А 7 Б 8 В 9 Г 10 | |
| Сколько энергетических ячеек на подуровне 3р? | А 4 Б 3 B 5 Г 2 | |
Сколько электронов, протонов и нейтронов в структуре атома кремния 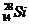 ? ?
| А 14,14,14,14 Б 28,14,28,14 В 12,28,28,14 Г 10,14,14,28 | |
| Написать электронную формулу атома гадолиния 64Gd. | ||
| Что такое главное квантовое число? Дать понятие энергетического уровня, спектра атомов. Каково максимальное число электронов на уровне?. |
Вариант 20
| Сколько нейтронов в ядре наиболее распространенного изотопа атома лантана 57La? | А 57 Б 83 В 82 Г 92 | |
| Какое валентное состояние характерно для невозбужденного атома селена 34Se? | А 6 Б 4 В 2 Г 0 | |
| На скольких энергетических уровнях расположены электроны в атоме сурьмы 51Sb? | А 3 Б 5 В 6 Г 4 | |
| Сколько энергетических состояний возможно на подуровне 4f? | А 5 Б 10 В 14 Г 7 | |
| Сколько электронов находится на четвертом уровне (n=4) у атома европия 63Eu с учетом проскока электрона с подуровня 5d? | А 19 Б 25 В 16 Г 28 | |
| Какова структура четвертого уровня (n=4) у атома родия 45Rh, учитывая проскок электрона с 5s орбитали? | А 4s24d45p6 Б 4s24p64d7 В 4s24f74p6 Г 4s24p64d8 | |
| Какой элемент имеет следующую конфигурацию валентных электронов: ns2,(n-1)d7? | А 27Co Б 44Ru B 24Cr Г 76Os | |
| Сколько протонов в ядре у атома никеля 28Ni? | А 58 Б 31 В 28 Г 40 | |
| Написать электронную формулу атома платины 78 Pt. | ||
| Какова взаимосвязь между орбитальным и магнитным квантовыми числами? Каково расположение орбиталей в пространстве? |
Вариант 21
| Какой из элементов имеет конфигурацию валентных электронов ns2,(n-1)d10,np2? | А 82Pb Б 33As В 17Cl Г 50Sn | |
| Какую валентность проявляет атом германия в состоянии максимального возбуждения 32Ge? | А 6 Б 4 В 5 Г 3 | |
| Какова структура пятого уровня (n=5) для наиболее распространенного изо атома цезия 55Cs? | А 5s25p65d10 Б 6s26d106p6 В 5s25p6 Г 6s2 | |
Сколько электронов, протонов и нейтронов в структуре атома титана 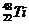 ? ?
| А 29,22,48,26 Б 64,22,22,26 В 35,48,48,22 Г 63,22,22,48 | |
| Какую высшую и низшую степень окисления проявляет углерод 6С? | А +4, -2 Б +4, -4 В +2, -4 Г +6, +2 | |
| Сколько периодов в Периодической системе? | А 2 Б 3 В 7 Г 8 | |
| Сколько энергетических ячеек на подуровне 4d? | А 10 Б 5 B 3 Г 6 | |
| Сколько электронов у атома стронция 38Sr на четвертом уровне (n=4)? | А 12 Б 18 В 8 Г 10 | |
| Написать электронную формулу атома калифорния 98Cf. | ||
| Что такое орбитальное квантовое число? Какова форма электронных облаков? Как рассчитать максимальное число электронов на подуровне? |
Вариант 22
| Какой из элементов имеет конфигурацию валентных электронов ns2,(n-1)d10,np3? | А 7N Б 33As В 31Ga Г 83Bi | |
| Какую валентность проявляет бром 35Br в состоянии максимального возбуждения? | А 5 Б 7 В 1 Г 4 | |
| Какова структура четвертого уровня (n=4) для невозбужденного атома сурьмы 52Sb? | А 4s24p64d10 Б 5s24d104p3 В 5s25p65d10 Г 4s24p64f14 | |
Сколько электронов, протонов и нейтронов в структуре атома рения 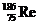 ? ?
| А 186,75,111,186 Б 75,75,75,186 В 111,75,75,111 Г 76,186,75,111 | |
| Чем отличаются атомы изотопов одного элемента? | А кол. протонов Б кол. электронов В кол. нейтронов Г зарядом ядра | |
| Чему равно общее число s-элементов в Периодической системе? | А 7 Б 14 В 22 Г 11 | |
| Сколько электронов на подуровне 4f у атома диспрзия 66Dy? | А 7 Б 9 B 10 Г 14 | |
| Сколько энергетических уровней в структуре атома берклия 97Bk? | А 4 Б 5 В 7 Г 10 | |
| Написать электронную формулу атома нобелия 102 NO. | ||
| Что такое магнитное квантовое число? Как расположены орбитали в пространстве? Как посчитать максимальное электронов на орбитали? |
Вариант 23
| Какую валентность проявляет фосфор 15Р в состоянии максимального возбуждения? | А 7 Б 5 В 6 Г 3 | |
| Какой элемент имеет ns2,(n-2)f14,(n-1)d2 конфигурацию валентных электронов? | А 72Hf Б 57La В 75Re Г 22Ti | |
| Какова структура четвертого уровня (n=4) у атома мышьяка 33As? | А 4s24d104p3 Б 4s24p3 В 4s23d104p3 Г 4s24d10 | |
| Чему равно число электронов у иона S-2? | А 16 Б 18 В 20 Г 32 | |
Сколько электронов, протонов и нейтронов в структуре атома титана 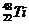 ? ?
| А 47,22,22,48 Б 22,22,26,48 В 25,26,26,22 Г 30,22,22,26 | |
| Сколько энергетических уровней у атома сурьмы 51Sb? | А 5 Б 4 В 6 Г 7 | |
| Чему равен порядковый номер элемента, который находится в четвертом периоде, в главной подгруппе второй группы? | А 10 Б 20 B 30 Г 40 | |
| Какую отрицательную степень окисления проявляет фосфор 15Р? | А -5 Б -3 В -4 Г -7 | |
| Написать электронную формулу атома рения 75Re. | ||
| Сформулировать принцип Паули и следствия из него. Каков порядок заполнения электронами энергетических уровней и подуровней в атоме? |
Вариант 24
| Сколько энерегтических уровней занимают электроны в атоме серебра 47Ag? | А 5 Б 7 В 6 Г 4 | |
| Какой элемент имеет ns2,(n-2)f5 конфигурацию валентных электронов? | А 62Sm Б 61Pm В 82Pb Г 76Os | |
| Сколько электронов находится у атома палладия 46Pd на четвертом уровне (n=4)? | А 8 Б 10 В 6 Г 18 | |
| Какова положительная и отрицательная степень окисления у атома cурьмы 51Sb? | А +4,-3 Б +5,-3 В +3,-5 Г +4,-4 | |
| Какую валентность атом серы проявлять не может? | А 2 Б 3 В 4 Г 6 | |
| У какого атома большее число неспаренных электронов в нормальном состоянии? | А 11Na Б 14Si В 15P Г 17Cl | |
| Сколько энергетических ячеек на подуровне 5d? | А 5 Б 4 B 10 Г 7 | |
Сколько электронов, протонов и нейтронов в структуре атома мышьяка 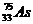 ? ?
| А 75,33,42,75 Б 42,75,75,33 В 33,33,33,75 Г 74,33,33,42 | |
| Написать электронную формулу атома рения 75Re. | ||
| В чем причина периодичности изменения свойств элементов и их соединений? Что такое элементы - аналоги? |
Вариант 25
| Сколько энергетических уровней занимают электроны в атоме кадмия 48Сd? | А 6 Б 8 В 5 Г 4 | |
| Какой элемент имеет ns2,(n-1)d2 конфигурацию валентных электронов? | А 72Hf Б 57 La В 78 Pt Г 22Ti | |
| Сколько электронов находится у атома таллия 81Tl на четвертом уровне (n=4)? | А 18 Б 14 В 32 Г 42 | |
| Какова положительная и отрицательная степень окисления у атома германия 32Ge? | А +3,-5 Б +4,-4 В +2,-6 Г +1,-7 | |
| Какой из атомов относится к р-элементам? | А Mg Б Zn В Al Г Fe | |
| Чему равно число электронов в ионе Al3+? | А 7 Б 10 В 13 Г 27 | |
| Сколько энергетических ячеек на подуровне 5f? | А 3 Б 7 B 10 Г 14 | |
Сколько электронов, протонов и нейтронов в структуре атома марганца 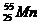 ? ?
| А 45,25,25,30 Б 23,25,25,55 В 21,55,30,25 Г 40,30,30,55 | |
| Написать электронную формулу атома тория 90Th. | ||
| Какова структура Периодической системы Д.И. Менделеева? Что такое периоды, группы, подгруппы? |
Вариант 26
Сколько электронов, протонов и нейтронов в структуре атома золота 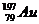 ? ?
| А 44,79,118,197 Б 41,79,79,197 В 21,79,79,118 Г 23,197,197,79 | |
| Чему равен порядковый номер элемента, который находится в пятом периоде, в побочной подгруппе VI группы? | А 42 Б 52 В 73 Г 83 | |
| Как обозначается подуровень для которого n=4 и l =3? | А 4s Б 4p В 4d Г 4f | |
| Какую отрицательную степень окисления проявляет хлор 17Cl? | А -7 Б -3 В -1 Г -2 | |
| Какова структура шестого уровня (n=6) для атома золота 79Au? | А 6s Б 6s26p6 В 6s24f145d10 Г 6s25d9 | |
| Какой из элементов имеет ns2,(n-1)d10 конфигурацию валентных электронов? | А 80Hg Б 23V В 30Zn Г 38Sr | |
| Сколько энергетических уровней занимают электроны у атома актиния 89Ac? | А 5 Б 6 B 3 Г 7 | |
|
Date: 2015-07-22; view: 5302; Нарушение авторских прав |