
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Конденсация
|
|
Широкое распространение в химической технике имеют процессы конденсации (ожижения) паров различных веществ путем отвода от них тепла. Конденсация осуществляется в аппаратах, называемых конденсаторами.
Различают два вида конденсации:
1) поверхностную (или просто конденсацию), при которой конденсирующиеся пары и охлаждающий агент разделены стенкой, и конденсация паров происходит на внутренней или внешней поверхности холодной стенки;
2) конденсацию смешением, при которой конденсирующиеся пары непосредственно соприкасаются с охлаждающим агентом.
Поверхностная конденсация осуществляется в различных теплообменниках — поверхностных конденсаторах. В общем случае в поверхностный конденсатор поступает перегретый пар. Очень часто охлаждающим агентом является вода. В частности, кожухотрубчатый теплообменник, изображенный на рисунке 4.24, может быть использован и как конденсатор, когда в межтрубное пространство поступает перегретый пар.
Конденсация смешением. Если конденсации подвергаются пары нерастворимых в воде жидкостей или пар, являющийся неиспользуемым отходом того или иного процесса, охлаждение и конденсацию этих паров можно проводить путем непосредственного смешения с водой в аппаратах, называемых конденсаторами смешения. Эффективность работы таких аппаратов находится в прямой зависимости от поверхности соприкосновения охлаждающей воды и пара. Поэтому поверхность соприкосновения увеличивают, распыляя охлаждающую воду при помощи различных устройств.
5. ВЫПАРИВАНИЕ
5.4.5. Выпаривание
Выпаривание — процесс концентрирования растворов твердых нелетучих веществ путем удаления жидкого летучего растворителя в виде паров. Сущность выпаривания заключается в переводе растворителя в парообразное состояние и отводе полученного пара от оставшегося сконцентрированного раствора. Выпаривание обычно проводится при кипении, т. е. в условиях, когда давление пара над раствором равно давлению в рабочем объеме аппарата. Пар, образующийся над кипящим раствором, называется в технике выпаривания вторичным паром.
Процесс выпаривания относится к числу широко распространенных. Последнее объясняется тем, что многие вещества, например едкий натр, едкое кали, аммиачная селитра, сульфат аммония и др., получают в виде разбавленных водных растворов, а на дальнейшую переработку и транспорт они должны поступать в виде концентрированных продуктов.
Научный анализ процессов выпаривания был дан впервые в 1915 г. проф. И. А. Тищенко в монографии «Современные выпарные аппараты и их расчет»; ему же принадлежат работы, посвященные изучению свойств кипящих водных растворов.
Технические процессы выпаривания растворов. В химической технике используются следующие основные способы выпаривания: простое выпаривание, проводимое как непрерывным, так и периодическим методами, многократное выпаривание, осуществляемое только непрерывно, и выпаривание с применением теплового насоса. Два последних способа проведения процесса обеспечивают значительную экономию тепла и поэтому имеют преобладающее значение.
Все перечисленные процессы проводят как под давлением, так и под вакуумом, в зависимости от параметров греющего пара и свойств выпариваемых растворов.
Простое выпаривание. Простое выпаривание осуществляется на установках небольшой производительности, когда экономия тепла не имеет особого значения и может проводиться как периодически, так и непрерывно.
В периодическом процессе с единовременной загрузкой исходный раствор помещается в выпарной аппарат, где нагревается до температуры кипения и выпаривается. Образовавшийся вторичный пар поступает в конденсатор. Конденсат выводится из системы, упаренный раствор перекачивается в сборник готового продукта.
Многократное выпаривание. Многократное выпаривание — процесс, при котором в качестве греющего используют вторичный пар и, следовательно, достигается значительная экономия тепла. Проведение подобного процесса возможно либо при использовании греющего пара высокого давления, либо при применении вакуума.
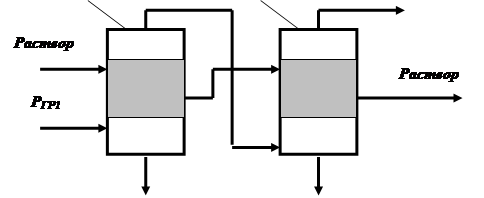
Сущность многократного выпаривания состоит в том, что процесс выпаривания проводится в нескольких соединенных последовательно аппаратах, давление в которых поддерживают так, чтобы вторичный пар предыдущего аппарата мог быть использован как греющий пар в последующем аппарате. Например (рис. 4.25), вторичный пар давлением РВТ1, образовавшийся в аппарате 1, используется как греющий пар давлением РГР2 в аппарате 2 (РВТ1 ≈ РГР2,).
|
|
 | ||||||
|
|
Рис. 4.25. Схема многократного выпаривания (прямоточная).
Cопоставим прямоточную и противоточную схемы. Очевидним преимуществом прямоточной схемн является возможность перемещения раствора из корпуса в корпус без применения насосов, работающих на горячих потоках. К недостаткам прямоточной схемы можно отнести неблагоприятные для теплопередачи условия..
В [3] показано, что преимуществом противоточной схеми является меньшая поверхность нагрева, а недостатком — необходимость включення в схему насосов, работающих на горячих потоках.
Недостатки прямоточних схем менее существеннн, чем противоточннх, позтому первне получили значительно большее распространение в промышленности.
4.6. Массообменные процессы
Технологические процессы, скорость протекания которых определяется скоростью переноса вещества (массы) из одной фазы в другую называются массообменными процессами, а аппаратура, предназначенная для проведения этих процессов, — массообменной аппаратурой.
Массообменные процессы занимают особое место среди химико-технологических процессов.
В подавляющем большинстве случаев производственные установки химической промышленности создают по схеме, приведенной на рис. 4.26. Исходное сырье поступает в реактор, где лишь частично превращается в продукты реакции. Выходящая из реактора смесь продуктов реакции и непрореагировавшего сырья направляется в массообменную разделительную аппаратуру, в которой производится разделение смеси на продукты реакции и непрореагировавшее сырье. Последнее возвращается в реактор, а продукты реакции поступают на дальнейшую переработку.
Из изложенного следует, что между реакционными и разделительными аппаратами существует тесная технологическая связь. Общий закон этой связи таков: чем меньше нагрузка на реакционный аппарат, т. е. чем меньше превращение исходного сырья в продукты реакции, тем больше нагрузка на разделительный агрегат, и наоборот.
Очевидно, что оптимальное сочетание нагрузок на реакционный и разделительный аппараты и приводит к минимальным производственным затратам — к оптимизированному процессу. Следовательно, основа химического производства — реакционный аппарат — работает оптимально только в сочетании с оптимально работающим разделительным агрегатом и работа последнего имеет в химической промышленности не меньшее значение, чем работа самого реакционного аппарата.
В разделительном агрегате могут производиться разнообразные процессы. Основными и важнейшими из них являются абсорбция, экстракция, ректификация, адсорбция и сушка.
Абсорбция – избирательное поглощение газов или паров жидкими поглотителями - абсорбентами. Процесс используется во многих производствах, где из смеси газов необходимо извлечь какой-либо компонент или группу компонентов В этом процессе имеет место переход вещества или группы веществ из газовой или паровой фаз в жидкую.
Экстракция [11] — извлечение растворенного в одной жидкости вещества или группы веществ другой жидкостью. Процесс используется в случаях, когда из раствора необходимо извлечь растворенное вещество или группу веществ. В этом процессе имеет место переход вещества из одной жидкой фазы в другую жидкую фазу.

|
|
|


|

|

|
Рис. 4.26. Связь реактора с разделительной аппаратурой
Ректификация — разделение жидкой смеси на чистые или обогащенные составляющие в результате противоточного взаимодействия потоков пара и жидкости. Процесс имеет большое значение в тех производствах, где необходимо частичное или полное разделение жидких однородных смесей на чистые компоненты или их группы. Очевидно, в этом процессе имеет место переход вещества из жидкой фазы в паровую, и наоборот.
Адсорбция — избирательное поглощение газов, паров или растворенных в жидкостях веществ твердым поглотителем — адсорбентом, способным поглощать одно или несколько веществ из их смеси. Процесс используется во многих производствах, где из смеси газов, паров или растворенных веществ необходимо извлечение того или другого вещества. В этом процессе вещества переходят из газовой и. жидкой фаз в твердую.
Сушка — удаление влаги из твердых влажных материалов путем испарения. Процесс имеет большое значение во многих производствах, где влажные природные вещества до их переработки должны предварительно обезвожены или должен быть обезвожен готовый продукт, получающийся в последней стадии производства. Нетрудно видеть, что в этом процессе имеет место переход влаги.твердого влажного материала в паровую или газовую фазу.
Из приведенной краткой характеристики следует, что для всех перечисленных процессов общим является переход вещества из одной фазы в другую, или массопередача. Переход вещества из одной фазы в другую связан с явлениями конвективного переноса и молекулярной диффузии, поэтому перечисленные выше процессы получили название массообменных или диффузионных процессов. Массопередачей называют переход вещества (или нескольких веществ) из одной фазы в другую в направлении достижения равновесия.
В массообмене участвуют как минимум три вещества: распределяющее вещество (или вещества), составляющее первую фазу, распределяющее вещество (или вещества), составляющее вторую фазу; распределяемое вещество (или вещества), которое переходит из одной фазы в другую (рис. 4.27).
Назовем первую фазу G, вторую L, а распределяемое вещество M. Поскольку все рассматриваемые массообменные процессы обратимы, распределяемое вещество может переходить из фазы G в фазу L и наоборот, в зависимости от концентрации этого вещества в распределяющих фазах.
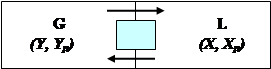 |
Рис. 4.27. Схема массобмена
G – распределяющее вещество 1-ой фазы; L - распределяющее вещество 2-ой фазы;
М – распределяемое вещество; Х (Y) – концентрация распределяемого вещества в фазе.L (G); Xp (Yp) – равновесная концентрация распределяемого вещества в фазе L (G)
Допустим, что распределяемое вещество находится вначале только в фазе G и имеет концентрацию Y. В фазе L в начальный момент распределяемого вещества нет и, следовательно, концентрация его в этой фазе X = 0.
Если распределяющие фазы привести в соприкосновение, начнется переход распределяемого вещества из фазы G в фазу L и в последней обнаружится определенная концентрация распределяемого вещества X > 0. С момента появления вещества М в фазе L начинается и обратный переход его в фазу G, но до некоторого момента число частиц М, переходящих в единицу времени через единицу поверхности соприкосновения из фазы G в фазу L, больше, чем число частиц, переходящих из фазы L в фазу G; конечным итогом процесса является переход М из фазы G в фазу L.
Через определенный промежуток времени скорости перехода распределяемого вещества из фазы G в фазу L и обратно становятся одинаковыми. Такое состояние называется равновесным. В состоянии равновесия в каждом конкретном случае существует строго определенная зависимость между концентрациями распределяемого вещества, которые при равновесии системы называются равновесными, а достигнутые концентрации – равновесными.
Date: 2015-06-11; view: 2069; Нарушение авторских прав