
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Участие клеток неспецифической защиты в противоинфекционном иммунитете
|
|
1. Виды инфекционных агентов и их локализация в организме.
Все известные инфекционные агенты, вызывающие заболевания у человека, разделяются на 5 групп: вирусы, бактерии, грибы, протозойные, гельминты. Их можно обнаружить в разных участках тела. Уничтожение их происходит с помощью разных механизмов иммунологической защиты хозяина. С патогенетической точки зрения важно разделение инфекционных агентов по месту их преимущественного роста и размножения. С этих позиций выделяют 2 основные группы микроорганизмов:
1. Интрацеллюлярные (внутриклеточные).
2. Экстрацеллюлярные (внеклеточные).
Следует отметить, что фактически все патогены проходят экстрацеллюларную фазу, где они становятся уязвимы для действия антител. В то же время интрацеллюларная фаза развития микроорганизмов остается недоступной для антител и в этом случае основная роль в защите отводится атаке Т - лимфоцитов.
2. Виды иммунного ответа на первичную инфекцию в зависимости от локализации микроорганизмов
Таблица 1. Преимущественная локализация микроорганизмов и основные механизмы иммунитета (Р.Я.Мешкова /Руководство по иммунопрофилактике для врачей. Смоленск.1998)
| Локализация возбудителя | |||
| Интрацеллюлярные | Экстрацеллюлярные | ||
| Цитоплазматические | Везикулярные | Интерстициальное пространство, кровь, лимфа | Эпителиальная поверхность |
| Вирусы Хламидии Риккетсии Листерии Протозойные | Микобактерии Сальмонеллы Лейшмании Листерии Трипаносомы Легионелла Криптококки Гистоплазмы Иерсиния пестис | Вирусы Бактерии Протозойные Грибы Гельминты | Гонококки Гельминты Микоплазмы Пневмококки Холерный вибрион E.coliCandida alb.Helicobacter |
| Протективный ответ на первичную инфекцию | |||
| СД 8 Т-клетки | Т-клеточный иммунитет | Антитела | Антитела (особенно IgA) |
| NK-клетки | Активированные макрофаги | Комплемент | |
| АЗКЦ (антитело-зависимая клеточная цитотоксичность) | Фагоцитоз |
Механизмы протективного иммунитета различны при разных инфекционных заболеваниях, что следует учитывать не только при назначении этиотропной терапии, но и при проведении специфической профилактики, в частности, при вакцинации.
Следует подчеркнуть, что в элиминации внеклеточных, в основном пиогенных микроорганизмов (пневмококки, стафилококки, стрептококки и др.) главная роль принадлежит триаде: нейтрофилу, иммуноглобулину и комплементу, причем гибель микроба происходит в нейтрофиле, а комплемент и иммуноглобулины (опсонины) усиливают этот процесс.
В элиминации внутриклеточных возбудителей главная роль так же принадлежит триаде: Т-лимфоцитам, NK-клеткам и макрофагам, причем все эти 3 группы клеток обладают способностью синтезировать цитокины (IFN-g, ИЛ-1, ИЛ-2, ФНО-a, и др.), резко усиливающих их функциональные свойства.
В ответе на впервые попавшую в организм человека инфекцию выделяют 3 фазы иммунного ответа, отличающиеся как механизмами распознавания антигена, так и эффекторными механизмами.
3. Фазы иммунного ответа
При первом попадании возбудителя в организм человека включаются механизмы врожденного и адаптивного иммунного ответа (табл. 2).
Таблица 2 -Фазы иммунного ответа (Р.Я.Мешкова /Руководство по иммунопрофилактике для врачей. Смоленск.1998)
|
В соответствии со временем возникновения выделяют следующие фазы:
Таблица 3 - Последовательность фаз иммунного ответа (Р.Я.Мешкова /Руководство по иммунопрофилактике для врачей. Смоленск.1998)
| – | в первые 0-4 часа после попадания возбудителя активируются механизмы врожденного иммунитета. Инфекционные агенты распознаются неспецифическими эффекторами (предсуществующими) и происходит удаление части инфекционного агента; |
| – | спустя 4-96 часов развивается ранний индуцированный ответ адаптивного иммунитета, который сопровождается рекрутированием эффекторных клеток, наступлением стадии распознавания антигена и активации эффекторных клеток, что также приводит к удалению возбудителя; |
| – | позже 96 часов имеет место поздний адаптивный ответ на инфекцию, который проявляется в транспортировке антигена к лимфоидным органам, распознавании антигена наивными Т- и В-клетками, клональной селекции и дифференцировке их в эффекторные клетки, способные к удалению возбудителя. |
В случае повторного попадания того же самого возбудителя, т.е. при реинфицировании, удаление возбудителя может происходить с большей скоростью за счет сохранения протективного иммунитета и иммунологической памяти.
Протективный иммунитет – это ответ на реинфицирование путем распознавания антигена предсуществующими нтителами (преформированными) и эффекторными Т-клетками с последующим удалением возбудителя.
Иммунологическая память – проявляется в том, что в ответ на реинфицирование происходит распознавание антигена с помощью В- и Т-лимфоцитов памяти. Это приводит к быстрой экспансии антигенспецифических лимфоцитов, дифференцировке их в эффекторные клетки и удаление инфекционного агента.
4. Течение острой инфекции
Таблица 4 - Течение острой инфекции (Р.Я.Мешкова / Руководство по иммунопрофилактике для врачей. Смоленск.1998)
| 1. | Заражение. |
| 2. | Становление инфекции. Происходит увеличение уровня антигена в результате репликации возбудителя. Когда уровень возбудителя достигает пороговой дозы, требуемой для активации адаптивного иммунитета, происходит его инициирование. Возбудитель продолжает накапливаться, ограничиваясь только благодаря врожденной защите и раннему неадаптивному ответу. |
| 3. | Индукция адаптивного ответа. Спустя 4-5 дней эффекторные клетки и молекулы адаптивного ответа стартуют для реализации иммунного ответа на антиген и очистки организма от инфекции. |
| 4. | Адаптивный иммунный ответ. Выработка антител и активация Т-клеточно-опосредованного иммунитета. Адаптивный иммунный ответ становится эффективным только после нескольких дней, требуемых для антиген-специфической Т- и В-пролиферации и дифференцировки в эффекторные клетки. |
| 5. | Иммунологическая память. Когда инфекция уничтожена и доза антигена падает ниже порогового уровня, ответ прекращается. Однако антитела, резидуальные эффекторные клетки и лимфоциты иммунологической памяти обеспечивают длительную протективную защиту против реинфицирования |
5. Механизмы разрушения тканей патогенами
Любая "естественная инфекция" сопровождается воздействием на клетки и ткани больного. В результате такого воздействия патогенов на организм происходит разрушение клеток и тканей, которое может осуществляться либо путем прямого воздействия, либо косвенно с привлечением факторов иммунной защиты. Рассмотрим возможные механизмы разрушения:
Прямое разрушение тканей патогенами
Этот процесс происходит за счет:
а) продукции экзотоксинов. Экзотоксины, выделяемые микроорганизмами, действуют на поверхность хозяйской клетки, связываясь с соответствующими рецепторами и проникая внутрь клетки, разрушают ее. Примеры: Streptococcus pyogenes, Staphylococcus aureus, Corynebacter diphteriae, Clostridium tetani. Указанные возбудители могут вызвать различные заболевания, такие как тонзиллиты, токсический шок, дифтерию, столбняк;
б) выделение эндотоксинов. Эндотоксины, выделяемые при разрушении ряда возбудителей, являются триггерами для синтеза макрофагами цитокинов, которые в свою очередь вызывают локальные или общие симптомы. Примеры: E.coli, Haemophilis influenzae, Shigella, Pseudomonas aeruginosa, Yersinia pestis. Перечисленные возбудители являются этиологическими факторами в развитии сепсиса, менингита, тифа, инфекции органов дыхания, чумы;
в) прямого цитопатического действия. Некоторые микроорганизмы способны оказывать прямое разрушающее действие на клетки. В качестве примеров таких возбудителей можно привести: Variola, Varicella zoster, Hepat. B virus, Polio-virus, Measles virus, Influenza virus, Herpes simplex. В результате инфицирования у человека развиваются гепатит В, полиомиелит, корь, подострый склерозирующий панэнцефалит, грипп, герпетическое поражение.
Непрямое разрушение тканей патогенами
Адаптивный иммунный ответ к инфекционным агентам может сопровождаться образованием иммунных комплексов, синтезом перекрестно-реагирующих антител, которые связываются с хозяйскими тканями, а также индукцией Т-клеток, разрушающих инфицированную клетку человека. Это все приводит как к удалению возбудителя, так и к разрушению клеток хозяина. Укажем лишь некоторые примеры подобного действия (табл. 4).
Таблица 4. Некоторые механизмы непрямого повреждения тканей факторами иммунной системы (Р.Я.Мешкова /Руководство по иммунопрофилактике для врачей. Смоленск.1998)
|
Таким образом, при рассмотрении вопроса о возможности нежелательных реакций вакцинации следует помнить, что переболевание вакцинуправляемой инфекцией несет в себе не меньшую, а значительно большую опасность в плане разрушающего воздействия на органы и ткани больного.
6. Участие клеток неспецифической защиты в противоинфекционном иммунитете
К основным клеткам, реализующим механизмы врожденного иммунитета, относятся макрофаги, нейтрофилы, естественные киллеры.
Макрофаги происходят из циркулирующих в крови моноцитов.
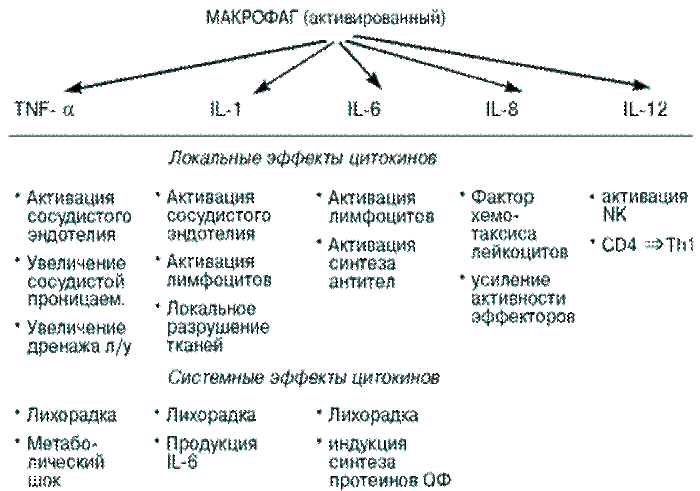
Макрофаги поглощают и разрушают в основном Гр (–) бактерии, при этом активируются с помощью ЛПС бактерий и вследствие этого начинают секретировать монокины – интерлейкины 1, 6, 8, 12 и TNF-a.
Монокины, выделяемые макрофагами в ответ на бактериальную инфекцию, вызывают следующие эффекты:
–индуцируют продукцию протеинов острой фазы печенью;
–усиливают адаптивный иммунный ответ;
–повышают температуру тела человека;
–индуцируют воспаление, при котором изменяется проницаемость сосудистой стенки, рекрутируются фагоциты, иммунные клетки и молекулы в зону воспаления.
Рассмотрим более подробно локальные и системные эффекты монокинов – цитокинов, выделяемых макрофагами (рис. 1).
Рис. 1. Эффекты монокинов (Р.Я.Мешкова /Руководство по иммунопрофилактике для врачей. Смоленск. 1998)
Помимо макрофагов, в реализации механизмов врожденного иммунитета большую роль играют нейтрофилы. Эти клетки преобладают в раннем клеточном инфильтрате в месте воспаления. Они находятся в крови и практически отсутствуют в нормальных тканях. Нейтрофилы – это коротко живущие клетки. В среднем срок их жизни равен 3-4-м дням. При реализации врожденного иммунного ответа продуцируются разные факторы, часть из которых является хемоаттрактантами для нейтрофилов и они быстро эмигрируют из крови и входят в очаг инфекции. В очаге нейтрофилы способны элиминировать многие патогены путем фагоцитоза.
Нейтрофилы способны фагоцитировать как опсонизированные бактерии, т.е. в соединении с антителами (опсонинами), так и в отсутствии антител. Таким образом, нейтрофилы осуществляют первую линию защиты. Компоненты бактериальной клетки могут быть связаны напрямую с нейтрофилами или опосредовано через липополисахариды – LPS, которые вначале связываются с протеинами сыворотки, образуя липополисахаридсвязанный протеин – LBP. Комплексы LPS и LBP затем соединяются с СД 14 на поверхности нейтрофила. Нейтрофилы могут также фагоцитировать комплексы бактерий, соединенные с С3b компонентом комплемента. Это соединение в свою очередь инициирует альтернативный путь активации комплемента. (С3b – опсонин, С3a С5b – факторы воспаления
Нейтрофилы способны элиминировать Гр(–) и Гр(+) бактерии, грибы и даже некоторые оболочечные вирусы. В то же время многие нейтрофилы погибают в очагах воспаления. Часть микроорганизмов фагоцитируется нейтрофилами, но не убивается ими. Но даже такая секвестрация микроорганизмов важна для хозяйской защиты, так как позволяет контролировать инфекцию в ранний период, а секвестрированные частицы вновь рефагоцитируются другими нейтрофилами или макрофагами, которые аккумулируются в зоне воспаления. Из сказанного следует, что нейтрофилы – это важная составная часть врожденного иммунного ответа хозяина на инфекцию.
Естественные киллеры (NK-клетки) служат в качестве самой ранней защиты против интрацеллюлярных микроорганизмов. NK-клетки были идентифицированы по их способности убивать определенные опухолевые клетки in vitro без предварительной активации. Однако известна их роль в ранней фазе защиты от инфицирования интрацеллюлярными патогенами, особенно Herpes virus и Listeria monocytogenes.
Активность естественных киллеров увеличивается в 20-100 раз, когда на них воздействуют цитокины, в частности, INF-a, INF-b или IL-12. IL-12 называется также NK-активирующим монокином, который продуцируется в раннюю фазу инфекции. ИЛ-12 в сочетании с INF-a могут вызвать усиление продукции INF-g естественными киллерами.
Поскольку NK-клетки опосредуют в основном защиту человека против вирусов, они должны иметь некие механизмы для дифференцировки инфицированной и неинфицированной клетки. Окончательно этот вопрос не решен, однако установлено, что NK-клетки избирательно убивают клетки-мишени, имеющие низкий уровень молекул MHC класса 1 на своей поверхности. Это предполагает следующий механизм действия NK-клеток: молекулы МНС класса 1 на нормальных клетках распознаются NK-клетками с помощью рецептора Ly49. В результате такого распознавания посылается отрицательный сигнал и происходит ингибиция активации NK-клетки. Иными словами, если рецептор Ly49 на естественных киллерах распознает молекулы МНС класса 1 на поверхности хозяйской клетки, то происходит ингибиция активации NK-клеток и последующего киллинга клетки-мишени не происходит.
Если клетки-мишени не экспрессируют молекулы МНС класса 1, то происходит киллинг их и клетка-мишень погибает. IFN-a и IFN-b усиливают экспрессию молекул МНС класса 1 на поверхности нормальных неинфицированных клеток, тем самым предотвращая атаку на них NK-клеток. Вирус-инфицированные клетки экспрессируют значительно меньшее количество молекул МНС класса 1, либо на их поверхности отсутствуют эти молекулы. В ряде случаев молекулы МНС класса 1 становятся измененными. В этих случаях рецептор Ly49 не распознает молекулы МНС класса 1 (НLA-B аллели) и нет подачи негативного сигнала. В результате NK-клетка активируется и убивает клетку-мишень.
Активация NK-клетки происходит через поверхностный рецептор NK R-P1 – это лектин-подобный рецептор, распознающий карбогидратные молекулы, являющийся триггером киллинга NK-клеток.
С другой стороны, известно, что вирус-инфицированная клетка распознается NK-клеткой даже, когда МНС экспрессия не нарушена вирусом. Люди с дефицитом NK-клеток очень чувствительны к ранней фазе герпес-инфекции.
Подводя итоги, следует сказать, что ранний неадаптивный ответ (врожденный иммунитет) на инфекцию вовлекает широкий круг эффекторных механизмов, направленных на разные классы патогенов. Все ответы становятся возможными благодаря рецепторам, которые являются в основном неспецифичными.
Лекция № 7
Тема лекции: Аллергия. Иммунологическая толерантность. Иммунный статус макроорганизма и методы его оценки.
План лекции:
Date: 2015-07-02; view: 1339; Нарушение авторских прав