
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глоссарий. - Термодинамическая система (ТДС) (thermodinamic system (TDS)) - тело или совокупность тел, способных обмениваться с другими телами или между собой
|
|
- Термодинамическая система (ТДС) (thermodinamic system (TDS)) - тело или совокупность тел, способных обмениваться с другими телами или между собой, энергией и (или) веществом.
- Открытая ТДС (Open TDS) - ТДС, способная обмениваться веществом с другими системами.
- Закрытая ТДС (closed TDS) - ТДС, которая не может обмениваться веществом с другими системами.
- Изолированная ТДС (Isolated TDS) - ТДС, которая не может обмениваться энергией и веществом с другими системами.
- Адиабатная ТДС (Adiabatic TDS) - ТДС, которая не может обмениваться теплотой с другими системами.
- Гетерогенная ТДС (Heteroqeneous ТDS) - ТДС, состоящая из отдельных частей, разграниченных поверхностями раздела.
- Гомогенная ТДС (Homoqeneous TDS) - ТДС, между любыми частями которой нет поверхностей раздела.
- Фаза (phase) - гомогенная часть гетерогенной ТДС, ограниченная поверхностью раздела.
- Конденсированная ТДС (condensed TDS) - ТДС, состоящая только из твердых и (или) жидких фаз.
- Термодинамический параметр (Thermodynamic parameter) - одна из совокупностей термодинамических величин, характеризующих состояние ТДС
- Стационарное состояние (Stationary state; Steady state) - состояние ТДС, при котором значения параметров во всех частях ее остаются неизменными во времени благодаря внешнему воздействию потоков вещества, энергии, импульса, заряда и т.п.
- Нестационарное состояние (Nonsteady state) - состояние ТДС, при котором значения параметров изменяются во времени.
- Равновесное состояние (Equilibrium state) - состояние ТДС, характеризующееся при постоянных внешних условиях неизменностью параметров во времени и отсутствием в системе потоков. (Состояние ТДС не удовлетворяющее данному определению, называется «неравновесным состоянием»).
- Устойчивое равновесное состояние (PC) - (Stable equilibrium) - состояние ТДС, при котором всякое бесконечно малое воздействие вызывает бесконечно малое изменение ее состояния, а при устранении этого воздействия система возвращается в исходное состояние.
- Неустойчивое PC - (Nonstable equilibrium) - состояние ТДС, при котором бесконечно малые воздействия вызывают изменения состояния, которые не исчезают при устранении этих воздействий.
- Метастабильное PC (Metastable equilibrium) - состояние ТДС, при котором бесконечно малые воздействия вызывают бесконечно малые изменения состояния, а некоторые малые конечные воздействия - конечные изменения состояния, которые не исчезают при устранении этих воздействий.
- Термическое равновесие системы (Thermal equilibrium) – состояние ТДС, при котором во всех ее частях температура одинакова.
- Фазовое равновесие (phase equilibrium) - равновесное состояние ТДС, состоящей из двух или большего числа фаз.
- Теплота (heat) - энергия, передаваемая более нагретым телом менее нагретому, не связанная с переносом вещества или совершением работы.
- Работа (work) - энергия, передаваемая одним телом другому, не связанная с переносом теплоты и (или) вещества.
- Уравнение состояния (Equation of state) - уравнение, связывающее любой термодинамический параметр (свойство) системы с параметрами, принятыми в качестве независимых переменных, (уравнение состояния, связывающее для однородного тела давление, объем и температуру, называется «термическим уравнением состояния»).
- Идеальный газ (Perfect qas. Jdeal qas) - газ, подчиняющийся уравнению состояния p 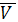 =RT, где р- давление,
=RT, где р- давление, 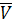 - мольный объем, R - универсальная газовая постоянная, Т - термодинамическая температура.
- мольный объем, R - универсальная газовая постоянная, Т - термодинамическая температура.
- Нормальные термодинамические условия (Normal jhermodynamic couditious)- температура 0°С и давление равное 101 325 Па.
- Индивидуальное вещество (Individual substance) - вещество, состоящее из частиц (молекул, атомов, ионов и т.д.) одинакового вида.
- Стандартное состояние (Standard state) - состояние ТДС, при котором значения некоторых термодинамических функций принимаются за начало отсчета для этих функций.
- Многокомпонентная ТДС (Multikomponents System) - ТДС, состоящая из двух или более индивидуальных веществ (компонентов ТДС).
- Экстенсивный термодинамический параметр (Extensive thermodynamic parameter) - Термодинамический параметр, пропорциональный количеству вещества или массе данной ТДС. (Экстенсивными термодинамическими параметрами являются, например, объем, энтропия, внутренняя энергия, энтальпия, энергия Гельмгольца, энергия Гиббса.
- Интенсивный термодинамический (ТД) параметр (Ehtensive thermodynamic parameter) - ТД параметр, не зависящий от количества вещества или массы ТДС. (Интенсивными ТД параметрами являются, например, давление, термодинамическая температура, концентрация, мольные и удельные термодинамические величины).
- Мольная термодинамическая величина (Mole Value) -ТД параметр (экстенсивный), относящийся к одному молю.
- Удельная ТД величина (Specific value) - ТД параметр (экстенсивный), относящийся к одному килограмму вещества.
- Термодинамические степени свободы (Thermodynamic degrees of freedom) - Независимые ТД параметры, определяющие состояние каждой фазы равновесной системы, (число ТД степеней свободы определяется формулой:
f = т-п + 2,
где т - число компонентов системы,
п - число равновесно существующих фаз.
- Плотность (Density) - масса вещества, заключенного в одном кубическом метре. (Величина, обратная плотности, называется «удельным объемом»).
- Приведенный термодинамический параметр (Reduced thermodynamic parameter) - Отношение ТД параметра в данном состоянии системы к этому параметру в некотором выбранном состоянии (в частности, в критическом состоянии).
- Концентрация - (concentration) - Величина, характеризующая относительное содержание данного компонента в многокомпонентной ТДС.
- Массовая концентрация (Mass concentration) - Концентрация, выраженная отношением массы компонента к массе всей многокомпонентной ТДС.
- Мольная концентрация (Mole concentration. Mole fraction) - концентрация, выраженная отношением числа молей компонента к общему числу молей многокомпонентной ТДС.
- Моляльная концентрация (Molal concentration) - Концентрация, выраженная числом молей растворенного вещества, приходящихся на 1 кг растворителя.
- Термодинамическая температура (Absolute temperature) - Температура, отсчитываемая по термодинамической шкале температур от абсолютного нуля.
- Температура фазового равновесия (Phase equilibrium temperature) -температура, при которой существует фазовое равновесие вещества при заданном давлении.
- Температура плавления (Melting temperature. Fusion temperature). -Температура системы «кристаллическое тело - жидкость» в состоянии фазового равновесия.
- Температура насыщения (Saturation temperature) - температура системы «пар - жидкость» или «пар - кристалл» в состоянии фазового равновесия.
- Давление насыщения (Saturation pressure. Vapour pressure) - Давление в системе «пар-жидкость» или «пар-кристалл» в состоянии фазового равновесия.
- Критическое давление (Critical pressure) - давление вещества в критическом состоянии.
- Критический удельный объем (critical volume) - удельный объем вещества в критическом состоянии.
- Критическая температура (critical temperature) - температура вещества в критическом состоянии.
- Универсальная газовая постоянная - (Universal gas constant) - Постоянная (R) в уравнении состояния для Моля идеального газа (PV = RT), одинаковая для всех веществ.
- Удельная газовая постоянная (Specific gas constant) - Универсальная газовая постоянная, отнесенная к 1 кг вещества. Теплоемкость (Heat capacity) - Производная от количества теплоты по температуре в каком-либо ТД процессе (Cx=dQ/dtx) (В изохорном процессе - «изохорная теплоемкость», в изобарном процессе - «изобарная теплоемкость»)
- Изобарный коэффициент расширения (Volyme expansion coefficient) - коэффициент, выраженный формулой
 .
.
- Адиабатный коэффициент сжимаемости (Adiabatic compressibility) -коэффициент, выражаемой формулой:
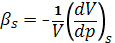 .
.
- Изотермический коэффициент сжимаемости (Jsothermic compressibility) – коэффициент, выражаемый формулой:
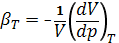 .
.
- Изохорный коэффициент давления (Jsochoric pressure coefficient) – коэффициент выраженный формулой:
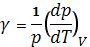 .
.
- Фактор сжимаемости (Kompressibility factor) – Величина (Z), определяемая уравнением
Z=PV/RT.
- Состояние насыщения (Saturation condition) - Состояние системы «пар - жидкость» или «пар - кристалл» при фазовом равновесии.
- Влажный пар (Wet vapour) - равновесная смесь, состоящая из паровой и жидкой фаз.
- Степень сухости влажного пара (Vapour quality) - Массовая доля насыщенного пара во влажном паре.
- Перегретый пар (Superheated vapour) - Пар, имеющий температуру более высокую, чем температура насыщенного пара при том же давлении.
- Влагосодержание (Moisture content) - Величина, определяемая соотношением
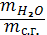 ,
,
где 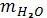 - воды или водяного пара;
- воды или водяного пара;
mс.г. - масса сухого газа.
- Критическое состояние (Critical state) -состояние ТДС, характеризующееся исчезновением различия между фазами, находящимися в равновесии друг с другом: между жидкостью и паром, между двумя жидкостями.
- Характеристическая функция (characteristic function) - функция состояния ТДС соответствующих независимых ТД параметров, характеризующаяся тем, что посредством этой функции и производных ее по этим параметрам могут быть выражены в явном виде все ТД свойства системы (Наиболее часто используются следующие характеристические функции:
1) энтропия, 2) внутренняя энергия, 3) энтальпия, 4) энергия Гельм-гольца, 5) энергия Гиббса.
- Термодинамический потенциал (Thermodynamic potential) - характеристическая функция (ХФ), убыль которой в равновесном процессе, протекающем при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе.
- Энтропия (Entropy) - функция состояния тем, что ее дифференциал (dS) при элементарном равновесном (обратимом) процессе равен отношению бесконечно малого количества теплоты (dQ), сообщенной системе, к ТД температуре (Т) системы:
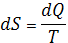 .
.
- Внутренняя энергия (Jnteqral enerqy) - функция состояния закрытой ТДС, определяемая тем, что ее приращение в любом процессе, происходящем в этой системе, равно сумме теплоты, сообщенной системе, и работы, совершенной над ней.
- Энтальпия (Enthalpy) - функция состояния ТДС, равная сумме внутренней энергии и произведения объема на давление.
- Энергия Гельмтольца (Helmholtz enerqy) - функция состояния ТДС, равная разности между внутренней энергией и произведением ТД температуры на энтропию.
- Энергия Гиббса (Gibbs enerqy) - функция состояния ТДС, равная разности между энтальпией и произведением ТД температуры на энтропию.
- Химический потенциал (chemical potential) - Частная производная от ХФ по массе компонента при постоянных соответствующих независимых параметрах и массах остальных компонентов.
- Термодинамический процесс (Thermodynamic process) - изменение состояния ТДС, характеризующееся изменением ее параметров.
- Равновесный процесс (Equilibrium process) - ТД процесс, представляющий собой непрерывную последовательность равновесных состояний.
- Неравновесный процесс (Nonequilibrium process) - ТД процесс, представляющий собой последовательность состояний, среди которых не все являются равновесными.
- Обратимый процесс (Reversible process) - ТД процесс, после которого система и взаимодействующие с ней системы (окружающая среда) могут возвратиться в начальное состояние без того, чтобы в системе и окружающей среде возникали какие-либо остаточные изменения.
- Необратимый процесс - (Irreversible process) - ТД процесс, после которого система и взаимодействующие с ней системы (окружающая среда) не могут возвратиться в начальное состояние без возникновения остаточных изменений в системе или окружающей среде.
- Изобарный процесс (constant-pressure process. Jsobaric process) - ТД процесс, происходящий при постоянном давлении в системе.
- Изохорный процесс (Constant-Volume process. Jsochoric process) -ТД процесс, происходящий при постоянной температуре системы.
- Адиабатный процесс (Adiabatic process) - ТД процесс, в котором система не обменивается теплотой с окружающей средой.
- Изоэнтропный процесс (Jsoentropic process) - ТД процесс, происходящий при постоянной энтропии системы.
- Политропный процесс (Polytropic process) -ТД процесс, удовлетворяющий соотношению:
pVn = const,
где п - показатель политроны (постоянная величина).
- Изоэнтальпийный процесс (constant - tnthalpy process. Jsoenthalpic process) - ТД процесс, происходящий при постоянной энтальпии системы.
- Дросселирование (throttlinq process Throttlinq) - протекание жидкости, пара или газа через дроссель - местное гидродинамическое сопротивление потоку (сужение трубопровода, вентиль, кран и др), при котором происходит изменение давления и температуры (эффект Джоуля - Томсона).
- Адиабатное дросселирование (Aqiabafic throttlinq) – дросселирование, протекающее без теплообмена с окружающей средой.
- Абсорбция - поглощение веществ из газовой смеси жидкостями. В технике абсорбция обычно пользуются для извлечения из газовой смеси какого-либо компонента.
- Адиабатический процесс - термодинамический процесс, который осуществляется в системе без теплообмена с окружающей средой.
- Амфолитные ПАВ - поверхностно-активные вещества, образующие в водном растворе в зависимости от условий анионоактивные или катионоактивные вещества.
- Ангренаж - основная кинематическая цепь механических приборов времени.
- Анионные ПАВ - поверхностно-активные вещества, функциональные группы которых в результате ионизации в растворе образуют отрицательно заряженные органические ионы, обусловливающие поверхностную активность
- Катионные ПАВ - поверхностно-активные вещества, функциональные группы которых в результате ионизации в растворе образуют положительно заряженные органические ионы, обусловливающие поверхностную активность.
- Барабан стиральной машины - полый цилиндр, боковая поверхность которого называется обечайкой. Обечайка барабана перфорирована круглыми отверстиями, обеспечивающими проникновение воды и моющего раствора внутрь барабана к обрабатываемому белью.
- Гидрофильность - способность вещества смачиваться водой.
- Зеебека эффект - термоэлектрический эффект, заключающийся в возникновении электродвижущей силы в электрической цепи, состоящей из последовательно соединённых разнородных проводников, контакты между которыми находятся при различных температурах.
- Карно цикл - обратимый круговой процесс, в котором совершается превращение теплоты в работу (или работы в теплоту). Состоит из последовательно чередующихся двух изотермических и двух адиабатических процессов.
- Катионные ПАВ - поверхностно-активные вещества, функциональные группы которых в результате ионизации в растворе образуют положительно заряженные органические ионы, обусловливающие поверхностную активность.
- Кипение - это интенсивное испарение жидкости, происходящее не только с поверхности, но и во всем ее объеме
- Конвективный теплообмен - процесс переноса теплоты, происходящий в движущихся текучих средах (жидкостях либо газах) и обусловленный совместным действием двух механизмов переноса тепла - конвективного переноса и теплопроводности.
- Конденсация - переход вещества из газообразного состояния в жидкое.
- Коэффициент длины барабана - отношение длины барабана к его диаметру.
- Моющие средства (детергенты) - вещества, усиливающие моющее действие воды. Первыми детергентами были мыла, полученные из встречающихся в природе веществ. В настоящее время под детергентами обычно понимают синтетические вещества.
- Неионогенные ПАВ - поверхностно-активные вещества, не образующие в водном растворе ионов.
- Необратимый термодинамический процесс - термодинамический процесс, не удовлетворяющий условиям обратимости. Все реальные процессы необратимы.
- Обратимый термодинамический процесс - термодинамический процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающих телах остались какие-либо изменения. Все обратимые процессы являются равновесными.
- Парамагнетик - вещество, намагничивающееся во внешнем магнитном поле по направлению поля. В отсутствие внешнего магнитного поля парамагнетик немагнитен. Атомы (ионы) парамагнетика обладают собственным магнитным моментом.
- Пельтье эффект - выделение или поглощение теплоты при прохождении электрического тока через контакт (спай) двух различных проводников. Выделение тепла сменяется поглощением при изменении направления тока.
- Перегретый пар - пар, имеющий температуру выше температуры насыщения при том же давлении.
- Поверхностно-активные вещества (ПАВ) - вещества, способные накапливаться на поверхности соприкосновения двух фаз, называемой поверхностью раздела фаз, или межфазной поверхностью.
- Сублимация - возгонка, переход вещества из кристаллического состояния непосредственно в газообразное, минуя жидкое.
- Теплоотдача - теплообмен между поверхностью твёрдого тела и соприкасающейся с ней средой - теплоносителем (жидкостью, газом и т. д.).
- Фактор разделения или коэффициент центробежного ускорения - безразмерная величина, которая определяется отношением центробежного ускорения к ускорению свободного падения.
- Холодильный агент, хладагент - рабочее вещество холодильной машины, которое при кипении или в процессе расширения отнимает теплоту от охлаждаемого объекта и затем после сжатия передаёт её охлаждающей среде (воде, воздуху и т. п).
- Холодильный коэффициент - безразмерная величина (обычно больше единицы), характеризующая энергетическую эффективность работы холодильной машины; равна отношению холодопроизводительности к потребляемой мощности.
- Холодильный цикл - циклический процесс, в котором расширение рабочего тела происходит при более низкой температуре, чем сжатие. Холодильные циклы используются для искусственного охлаждения.
Date: 2015-07-02; view: 846; Нарушение авторских прав