
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Чому різні фізичні величини виражають глибину дисоціації ?
|
|
1. Сильні електроліти дисоціюють майже повністю. В розчині практично не за-лишається молекул що не продисоціювали: NaCI  Na+ + CI --.
Na+ + CI --.
2. При дисоціації слабких електролітів, в розчині встановлюється динамічна рівновага між молекулами та йонами. Чим вище значення Кд тим в більшій мірі речовина розпалася на йони.
3. По силі електроліти класифікують на:
сильні – процент розпаду > 30 % H2SO4, HCI, NaCI
середньої сили – процент розпаду >3 % < 30 % CH3COOH, NH4OH
слабкі – процент розпаду < 3 % CH3CH(OH)COOH
Кислоти у водних розчинах дисоціюють (розпадаються) на катіони (протони) водню та аніони кислотного залишку:
HCI  H+ + CI – = 100 %; HF
H+ + CI – = 100 %; HF  H+ +F – Kд =7.0 .10 –4 ;
H+ +F – Kд =7.0 .10 –4 ;
СН3СООН  СН3СОО – + Н+ Кд=1.7.10 –5 ; HCN
СН3СОО – + Н+ Кд=1.7.10 –5 ; HCN  H+ + CN – Kд =6.2.10—10
H+ + CN – Kд =6.2.10—10
Багатоосновні кислоти дисоціюють ступінчасто з різною силою:
Н3РО4  Н+ + Н2РО4 – Кд = 7.1. 10 –3;
Н+ + Н2РО4 – Кд = 7.1. 10 –3;
Н2РО4 --  Н+ + НРО4 2– Кд = 6.2. 10 –8;
Н+ + НРО4 2– Кд = 6.2. 10 –8;
НРО42--  Н+ + РО4 3– Кд = 4.4 .10 –13.
Н+ + РО4 3– Кд = 4.4 .10 –13.
Основи у водних розчинах дисоціюють з утворенням катіону металу та аніону гідроксилу:
NaOH  Na+ + OH –
Na+ + OH – 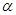 = 100%;
= 100%;
Ca(OH)2  Ca2+ + 2OH –
Ca2+ + 2OH – 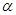 = 30 %;
= 30 %;
NH4OH  NH4+ + OH – Кд = 1.79 .10 –5 .
NH4+ + OH – Кд = 1.79 .10 –5 .
Солі у водних розчинах дисоціюють з утворенням катіону металу та аніону кислотного залишку.
NaCI  Na+ + CI –
Na+ + CI – 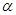 = 100 %
= 100 %
Na2SO4  2Na+ + SO42–
2Na+ + SO42– 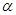 = 100 %
= 100 %
Майже всі солі є сильними електролітами, бо утворені за допомогою йонного зв′язку.
Отже: сила електроліту (глибина розпаду молекули) залежить від типу зв‘язку в молекулі, який визначається різницями електронегативностей елементів що його утворюють:
Розрізняють
Ковалентний неполярний 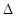 Е.Н. = 0 – 0.9 Н2; СІ2; О2
Е.Н. = 0 – 0.9 Н2; СІ2; О2
Ковалентний полярний 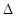 Е.Н. = 0.9 –1.9 НСІ =0.9; HF =1.9
Е.Н. = 0.9 –1.9 НСІ =0.9; HF =1.9
Йонний 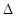 Е.Н. = 1.9 – 3.3. NaF = 3.1
Е.Н. = 1.9 – 3.3. NaF = 3.1
Таблиця електронегативності деяких хімічних елементів
Елемент K Na Li Mg AL Si H C N CI Br I O F
E.H. 0.8 0.9 1.0 1.2 1.5 1.8 2.1 2.5 3.0 3.0 2.8 2.5 3.5 4.0
Молекули води маючи великі дипольні моменти, в невеликій кількості і самі розпадаються на йони згідно рівняння:
Н2О  Н+ + ОН – або 2Н2О
Н+ + ОН – або 2Н2О  Н3О+ + ОН – .
Н3О+ + ОН – .
Виходячи із значення константи дисоціації Кд=[H+].[OH–]/ [H2O] = 1.86.10 –16 можна зробити висновок, що вода слабкий електроліт (із 55 млн. молекул во-ди, що містяться в одному літрі дисоціює тільки одна). Отже, при постійній температурі концентрація недисоційованої форми величина постійна і стано-вить:
[ H2O] = 1000/18 = 55.56 (моль/літр), де 1000 г/л – маса одного літра води, 18 г/моль – маса одного моля води. З рівняння, що визначає константу дисоціації води отримуємо вираз добутку двох констант:Кд. [ H2O] = [H+].[OH –], який називають іонним добутком води.
1.86 .10 –16 . 55.56 = [ H+] . [OH –]
10 –14 = [ H+] .[ OH –]
Іонний добуток води показує, що: зміна концентрацій одного йону не може проходити без зміни концентрації іншого; співвідношення концентрацій вільних водневих та гідроксильних йонів визна-чає активну реакцію розчину:вільні водневі йони визначають активну кислот-ність, а вільні гідроксильні йони визначають активну лужність середовища.
Розчини в яких [ H+] = [ OH –] називають нейтральними;
Розчини в яких [H+] > [ OH –] називають кислими;
Розчини в яких [ H+]< [ OH –] називають лужними.
Виходячи з рівняння дисоціації води та виразу іонного добутку можна вста-новити активну реакцію води:
Н2О  Н+ + ОН –
Н+ + ОН –
[ H+] .[ OH –] = 10 –14
Поскільки при дисоціації утворюється однакова кількість протонів водню та гідроксильних аніонів, то позначивши концентрацію протонів водню через Х, приймаємо і концентрацію гідроксильних аніонів теж рівну Х.
Маємо:
Х 2 = 10 --14
X = [ H+] =[ OH --] = 10 --7
Отже: вода має нейтральну реакцію.
Поскільки значення молярної концентрації протонів водню та аніонів гідрокси-лу є числа з від‘ємними показниками ступеня, то в розрахунках користуватися ними незручно. Тому, нім. вчений Зьоренсен ввів поняття водневого показни-ка рН (potens hidrojen), що означає в дослівному перекладі «сила водню»:
Водневий показник являє собою десятковий логарифм концентрації водневих іонів з від‘ємним знаком: рН = – Lg [H+].
Якщо [H+] = 10 –7 , то рН = – Lg [ 10 –7] = 7; [ H+] = 10 -11 то рН = 11.
Отже: для нейтральних розчинів рН = 7, для кислих розчинів рН  7, для луж-них розчинів рН > 7.
7, для луж-них розчинів рН > 7.
Біохімічні процеси проходять при строго визначених значеннях рН. Зміна цих значень може не тільки прискорити чи загальмувати їх протікання, а і повністю змінити напрямки перебігу. Не дивлячись на те, що проміжні продукти біохі-мічних процесів мають різні значення рН, в ході обмінних реакцій кардиналь-ної зміни активної реакції середовища не відбувається завдяки наявності в ор-ганізмі речовин, що володіють буферними властивостями.
Буферні властивості проявляються у зв‘язуванні надлишку вільних водневих чи гідроксильних йонів у малодисоційовані чи менш дисоційовані молекули.
Приклад: При бігові на довгі дистанції організм перебуває у стані кисневого голоду. В нор-мі вуглеводи розпадаючись до СО2 та Н2О забезпечують м‘язи енергією розпаду АТФ. Проте при окисленні в умовах дефіциту кисню розпад вуглеводів проходить лише до стадії молоч-ної кислоти. Остання, будучи досить сильною кислотою Кд = 1.38 .10 -- 4, відчутно закислює внутріклітинне середовище (порушує баланс між концентраціями протонів водню і гідрок-сильних аніонів у сторону збільшення концентрацій перших). Нервові рецептори фіксуючи зміну рН викликають відчуття болю. Через деякий час біль проходить внаслідок нормалізації клітинного та тканинного рН завдяки дії буферних систем.
В рівняннях описаний випадок виглядить слідуючим чином:
Date: 2015-07-01; view: 450; Нарушение авторских прав