
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Схема 22. Регуляция функции щитовидной железы в норме (а) и при диффуз- ном токсическом зобе (б)
|
|
Стимулирующее действие ЛАТС, ЛАТС-протектора, стимулятора щитовидной железы человека опосредуется через повышение образования количества цАМФ и далее путем увеличения биосинтеза и высвобождения тироидных гормонов, т.е. через тот же механизм, который известен для действия ТТГ. Как показали исследования E. Laurent и соавт. (1991), тироидстимулирующие антитела не влияют на активирование фосфолипазы С, а только стимулируют аденилатциклазу и образование цАМФ. Тем не менее исследования на клетках яичника китайского хомячка с рекомбинантным рецептором ТТГ продемонстрировали, что в этих условиях тироидстимулирующие антитела активировали как аденилатциклазу, так и фосфолипазу С (J. Van Sande и соавт., 1992), вызывая такие же конформационные изменения рецептора, как и при действии ТТГ.
Иммуноглобулины, угнетающие связывание ТТГ с рецептором, выявляются у некоторых больных с аутоиммунной (отечной) офтальмопатией при эутироидном и гипотироидном состоянии. Как указывалось выше, в отдельных случаях отсутствует взаимосвязь между уровнем антител к рецептору ТТГ и функциональной активностью щитовидной железы. Это несоответствие между уровнем тироидстимулирующих иммуноглобулинов в крови и функциональным состоянием щитовидной железы, вероятно, можно объяснить наличием иммуноглобулинов, оказывающих как стимулирующее действие на функцию щитовидной железы, так и не обладающих такими свойствами. По этим свойствам антитела к рецептору ТТГ можно разделить на два типа: стимулирующие аденилатциклазу и не стимулирующие, которые, взаимодействуя со щитовидной железой, блокируют рецептор, и такая щитовидная железа становится рефрактерной к действию ТТГ. Такой тип антител (ТТГ-ингибирующий или ТТГ-антагонистический тип) приводит к снижению биосинтеза тироидных гормонов и развитию гипотироза.
При диффузном токсическом зобе и особенно при аутоиммунном тироидите в щитовидной железе выявляется лимфоидная инфильтрация. Лимфоциты и плазматические клетки продуцируют антитела, часть которых взаимодействует с рецептором ТТГ, а возможно, и с другими структурами мембраны и лишь после этого – с рецепторами к ТТГ. Только часть образовавшихся антител попадает в лимфатическое и кровяное русло. Выявляются они различными методами исследования (см. выше).
Тироидстимулирующие иммуноглобулины принадлежат к классу G. При обработке протеолитическими ферментами этих антител удалось установить, какая часть молекулы отвечает за связывание ТТГ с рецепторами и какая – за стимулирующее действие на щитовидную железу.
К настоящему времени антиген, к которому при диффузном токсическом зобе образуются тироидстимулирующие антитела, не установлен. Однако показано, что образование тироидстимулирующих иммуноглобулинов лимфоцитами, взятыми от больных с диффузным токсическим зобом, стимулируется гомогенатами нормальной щитовидной железы человека.
Таким образом, наличие в сыворотке крови больных различных тироидстимулирующих иммуноглобулинов не объясняет полностью патогенез диффузного токсического зоба. Надо полагать, что в механизме его развития, помимо гуморального иммунитета, большое место занимают нарушения клеточно-опосредованного иммунитета.
Установлено, что при диффузном токсическом зобе значительно снижена супрессорная активность мононуклеарных клеток периферической крови, подобно тому, как это имеет место у больных системной красной волчанкой. У больных аутоиммунным тироидитом и раком щитовидной железы супрессорная функция лимфоцитов не была изменена по сравнению с группой практически здоровых лиц. Сниженная супрессорная функция лимфоцитов у больных с диффузным токсическим зобом не восстанавливается до уровня, наблюдаемого в группе практически здоровых лиц даже после достижения у них эутироидного состояния в результате применения тиростатических препаратов. Эта сниженная активность Т-супрессоров является врожденным специфическим нарушением у лиц, предрасположенных к развитию этого заболевания.
В соответствии с теорией Вольпе (1978), аутоиммунные заболевания (аутоиммунный тироидит, диффузный токсический зоб) развиваются в организме, имеющем дефект в системе “иммунологического выживания”. В этих условиях выживают и пролиферируют Т-лимфоциты, возникающие в результате спонтанной мутации и обладающие способностью реагировать с органоспецифическими антигенами (антигены щитовидной железы), т.е. появляются форбидные (“запрещенные”) клоны Т-лимфоцитов. Это обусловлено снижением другой субпопуляции Т-лимфоцитов Т-супрессоров, количество которых у больных диффузным токсическим зобом снижено. Некоторые из этих Т-лимфоцитов ведут себя как Т-помощники (хельперы) и, взаимодействуя с В-лимфоцитами, способствуют образованию ими органоспецифических антител. В одном случае такие подтипы Т- и В-лимфоцитов вовлечены в образование иммуноглобулинов, не оказывающих стимулирующего влияния на функцию щитовидной железы (аутоиммунный тироидит), в другом – в образование иммуноглобулинов, способных оказывать такое действие (диффузный токсический зоб).
Кроме того, Т-лимфоциты могут непосредственно участвовать в цитотоксических процессах (цитотоксические Т-лимфоциты) или продуцировать низкомолекулярные вещества – лимфокины, опосредующие иммунный ответ, например, фактор, подавляющий миграцию лейкоцитов, секретируемый Т-лимфоцитами при условии повторного контакта их с антигеном, к которому ранее эти лимфоциты были сенсибилизированы. К лимфокинам относятся также и другие специфические белки: интерлейкины, интерферон, фактор некроза опухолей, которые принимают, как показано исследованиями последних лет, непосредственное участие в механизмах иммунного ответа.
Иммуноглобулины сыворотки крови больных с диффузным токсическим зобом и офтальмопатией могут вызывать у экспериментальных животных экзофтальм в отличие от иммуноглобулинов больных, у которых диффузный токсический зоб протекает без офтальмопатии (R. Stienne и соавт., 1976). Эти и другие данные послужили основанием для вывода о том, что диффузный токсический зоб и аутоиммунная (отечная) офтальмопатия являются двумя различными аутоиммунными заболеваниями, которые могут развиваться у одного и того же больного. Кроме того, антиген щитовидной железы больных диффузным токсическим зобом и антиген из ретроорбитальных мыщц больных офтальмопатией в случае применения их в пробе на угнетение (ингибицию) миграции лейкоцитов проявляют себя по-разному.
Образующийся на мембране тироцита комплекс антиген-антитело-комплемент обладает цитотоксическими свойствами, что приводит к повреждению щитовидной железы. Клетки-убийцы (киллеры, К-клетки), взаимодействуя с клетками-мишенями, которые прореагировали с иммуноглобулинами, осуществляют деструкцию этих клеток. Возникает как бы замкнутая патологическая цепная реакция, конечным результатом которой является в одном случае диффузный токсический зоб, в другом – аутоиммунный тироидит. Роль аутоиммунных механизмов в развитии диффузного токсического зоба подтверждается сочетанием заболевания с носительством антигенов HLA-B8 и HLA-Dw3 иHLA-DR3, которые располагаются на шестой хромосоме рядом с геном, отвечающим за иммунореактивность организма.
Проведенные к настоящему времени многочисленные исследования по уточнению механизма патогенеза диффузного токсического зоба позволили получить данные, проливающие свет на патогенез диффузного токсического зоба, которые объясняют лишь отдельные звенья, но не весь механизм образования антител к рецептору ТТГ.
Как отмечалось выше, наличие врожденной недостаточности антигенспецифических Т-супрессоров создает нарушение равновесия между субпопуляциями Т-лимфоцитов и условия, при которых происходит нерегулируемый синтез тироидстимулирующих антител. Этому способствует нарушенная реакция угнетения миграции макрофагов и лимфоцитов, наблюдаемая у больных диффузным токсическим зобом.
A. Weetman и соавт. (1985) cчитают, что первичный дефект имеется в тироцитах, способнх экспрессировать антигены II класса (HLA-DR), активируя таким образом Т-хельперы с последующим образованием тироидстимулирующих антител. Однако не исключено, что экспрессия генов HLA-DR является вторичной в ответ на образование лимфоцитами интерлейкина-2.
Еще в 1974 г. N.K. Jerne и соавт. высказали предположение о том, что первичное наличие антител (иммуноглобулинов) к антигенам щитовидной железы приводит к инициации образования вторичных антител – антиидиотипических антител, которые комплексируются с рецептором ТТГ и оказывают стимулирующее влияние на функцию щитовидной железы. Такие антиидиотипические антитела, комплексируясь с рецептором ТТГ, опосредуют (осуществляют) связывание как ТТГ, так и тироидстимулирующих антител.
Инициации образования антител к рецептору ТТГ могут способствовать некоторые бактерии, в частности, Yersinia enterocolitica, которая обладает способностью специфически комплексироваться с ТТГ (M. Weiss и соавт. 1983). Было показано, что помимо Yersinia enterocolitica, другие бактерии, например, микоплазма (J. Sack и соавт. 1989), также имеют белковую структуру (ТТГ-подобный рецептор), которая способна комплексироваться с ТТГ, что и инициирует образование антител к рецептору ТТГ. Не исключено, что перечисленные бактерии способны взаимодействовать с ТТГ рецептором и инициировать образование соответствующих антител лишь при участии макрофагов и лимфокинов, секретируемых этими макрофагами.
В литературе, посвященной диффузному токсическому зобу, неоднократно подчеркивалась роль психической травмы, эмоционального стресса в развитии заболевания. Многолетние наблюдения позволили В. Г. Баранову (1977) сформулировать представление о нейроциркуляторной дистонии как предстадии диффузного токсического зоба. Нейроциркуляторная или вегетососудистая дистония является самостоятельным заболеванием, имеет ряд симптомов (раздражительность, общую слабость, быструю утомляемость, сердцебиение и др.), которые присутствуют при легком тиротоксикозе. Однако патогенетически это два самостоятельных заболевания. Более того, проведенные в различных странах эпидемиологические исследования не подтверждают того, что эмоциональный стресс может играть этиологическую роль в развитии диффузного токсического зоба.
И все же следует иметь в виду, что при стрессе повышается секреция гормонов мозгового вещества надпочечников (адреналин и норадреналин), которые, как известно, увеличивают скорость синтеза и секреции тироидных гормонов. С другой стороны, стресс активирует гипоталамо-гипофизарную систему, усиливает секрецию кортизола, ТТГ, что может служить триггером – пусковым моментом в механизме развития диффузного токсического зоба. По мнению большинства исследователей, эмоциональный стресс участвует в развитии диффузного токсического зоба путем влияния на иммунную систему организма. Установлено, что эмоциональный стресс приводит к атрофии вилочковой железы, снижает образование антител, уменьшает концентрацию интерферона в сыворотке крови, повышает предрасположенность к инфекционным заболеваниям, увеличивает частоту аутоиммунных заболеваний и рака.
Симпатическая нервная система, имеющая адренергические рецепторы на капиллярах, тесно соприкасающихся с мембранами фолликулов щитовидной железы, может принимать участие в изменении биогенных аминов или изменять отдельные белки, являющиеся компонентами мембраны. В организме с нарушенной иммунной системой такие повторные изменения могут вызывать различные аутоиммунные реакции.
Нельзя исключить роль различных вирусов, которые, взаимодействуя с белками мембраны тироцита и образуя иммунные комплексы, могут стимулировать синтез антител к макрокомплексу “вирус-антитела к нему-мембрана тироцита” или, нарушая структуру белка отдельных участков мембраны, изменяют таким образом ее антигенные свойства. Выше отмечалась роль микоплазмы и Yersinia enterocolitica в инициации образования антител к рецептору ТТГ. И в том, и в другом случае вирус или бактерии являются триггером аутоиммунной реакции. Патогенез диффузного токсического зоба представлен на схеме 23.
Клиническая картина. Больные с диффузным токсическим зобом предъявляют жалобы на общую слабость, повышенную раздражительность, нервозность и легкую возбудимость, нарушение сна, иногда бессонницу, потливость, плохую переносимость повышенной температуры окружающей среды, сердцебиения, иногда боли в области сердца колющего или сжимающего характера, повышенный аппетит и, несмотря на это, похудание, диарею.
Щитовидная железа диффузно увеличена, но степень ее увеличения часто не соответствует тяжести заболевания. Как правило, у мужчин при выраженной клинической форме диффузного токсического зоба щитовидная железа увеличена незначительно, пальпируется с трудом, так как увеличение происходит в основном за счет боковых долей железы, которые плотно прилегают к трахее. В большинстве случаев железа диффузно увеличена до II-III степени, плотная при пальпации, что может создавать впечатление узлового зоба, особенно при несимметричном ее увеличении. Кровоснабжение железы повышено, и при надавливании на нее фонендоскопом прослушивается систолический шум.
Существует несколько классификаций степени увеличения щитовидной железы. В нашей стране широко применяется классификация, предложенная О. В Николаевым в 1955 г. и незначительно модифицированная в последующем (О. В. Николаев, 1966). В соответствии с этим различают:
0-щитовидная железа не пальпируется;
I степень – пальпаторно определяется увеличение перешейка щитовидной железы;
II степень – пальпаторно определяются увеличенные боковые доли щитовидной железы;
III степень – визуально определяется увеличение щитовидной железы (“толстая шея”);
IV степень – значительное увеличение щитовидной железы (зоб ясно виден);
V степень – зоб огромных размеров.
I и II степень относят к увеличению щитовидной железы, а III-V степень увеличения щитовидной железы является собственно зобом.
Наряду с этим до последнего времени применялась и классификация, предложенная ВОЗ. В соответствии с этой классификацией различают следующие степени увеличения щитовидной железы: 0-щитовидная железа не пальпируется; Iа-щитовидная железа отчетливо пальпируется, но визуально не определяется; Iб-щитовидная железа пальпируется и определяется визуально в положении с запрокинутой головой; II-щитовидная железа определяется визуально при нормальном положении головы; III- зоб виден на расстоянии; IV- очень большой зоб.
В 1992 г. эта классификация была пересмотрена и предложено различать: 0 – зоб не виден и не пальпируется; I степень – на шее пальпируется образование, соответствующее увеличенной щитовидной железе, смещаемое при глотании, но не видимое при нормальном положении шеи; при этом в щитовидной железе может пальпироваться один или несколько узлов, даже при неувеличенной щитовидной железе; II степень – щитовидная железа пальпируется и отчетливо видна при нормальном положении головы.
Развитие клинических признаков диффузного токсического зоба связано с избыточной секрецией тироидных гормонов и их влиянием на различные органы и ткани, в частности, с повышением образования тепла (калоригенное действие), увеличением потребления кислорода, что отчасти связано с разобщением окислительного фосфорилирования. Большинство эффектов избытка тироидных гормонов опосредуется через симпатическую нервную систему: тахикардия, тремор пальцев рук, языка, всего туловища (симптом телеграфного столба), потливость, раздражительность, чувство беспокойства и страха (рис. 19, см. вклейку).
Нарушения сердечно-сосудистой деятельности проявляются в виде тахикардии (пульс даже в период ночного сна более 80 в минуту), повышения систолического и снижения диастолического артериального давления (увеличение пульсового давления), приступов мерцательной аритмии, появления ее постоянной формы с развитием сердечной недостаточности. Тоны сердца громкие, на верхушке сердца прослушивается систолический шум. Сосуды кожи расширены (компенсаторная реакция для отдачи тепла), в связи с чем она теплая на ощупь, влажная. Помимо этого, на коже у некоторых больных выявляется витилиго, гиперпигментация складок кожи, особенно в местах трения (шея, поясница, локоть и др.), крапивница, следы расчесов (зуд кожи, особенно при присоединении поражения печени), на коже головы – алопеция (локальное выпадение волос). Сердечно-сосудистые изменения обусловлены действием избытка тироидных гормонов на сердечную мышцу, что приводит к нарушению многих внутриклеточных процессов (разобщение окислительного фосфорилирования и др.), формированию синдрома тиротоксического сердца.
При обследовании на ЭКГ, помимо синусовой тахикардии, может выявляться синусовая аритмия, высокий вольтаж зубцов, ускорение или замедление предсердно-желудочковой проводимости, отрицательный или двухфазный зубец Т, мерцательная аритмия.
У лиц пожилого возраста тиротоксикоз может проявляться исключительно приступами мерцательной аритмии, что представляет определенную трудность для диагностики заболевания. В межприступный период у таких больных общее состояние остается удовлетворительным и число сердечных сокращений может быть в пределах нормы. При этом клинические проявления сердечной недостаточности плохо поддаются лечению препаратами наперстянки. Исследование функции щитовидной железы, определение уровня тироидных гормонов в крови, проведение пробы с тиролиберином или угнетением с Т3 помогает своевременной диагностике диффузного токсического зоба у лиц старшего и пожилого возраста.
Повышенное образование тепла вследствие повышения обмена веществ под влиянием тироидных гормонов приводит к повышению температуры тела: больные отмечают постоянное чувство жара, ночью спят под одной простыней (симптом простыни).
Отмечается повышенный аппетит (у лиц пожилого возраста аппетит может быть снижен), жажда, нарушение функции желудочно-кишечного тракта, диарея, умеренное увеличение печени, а в некоторых случаях даже незначительно выраженная желтуха. При обследовании выявляются повышение активности аминотрансфераз и щелочной фосфатазы в сыворотке крови и избыточная задержка сульфобромфталеина. Больные худеют. В тяжелых случаях не только исчезает подкожный жировой слой, но и уменьшается объем мышц. Развивается мышечная слабость как следствие не только изменения мышц (катаболизм белка), но и поражения периферической нервной системы. При этом заболевании выявляется слабость мышц проксимальных отделов конечностей (тиротоксическая миопатия). Сравнительно редко развивается тиротоксический периодический паралич, который может продолжаться от нескольких минут до нескольких часов и даже дней. Более часто это состояние встречается у японских и китайских больных, страдающих диффузным токсическим зобом. В патогенезе его определенная роль отводится снижению концентрации калия в сыворотке крови. Прием препаратов калия иногда приводит к прерыванию этих симптомов и предупреждает появление новых приступов.
Глубокие сухожильные рефлексы повышены, выявляются тремор вытянутых пальцев рук, гиперкинезия (суетливость), у детей – хореоподобные подергивания. Иногда тремор рук настолько выражен, что больным с трудом удается застегнуть пуговицы, изменяется почерк и характерен симптом “блюдца” (при нахождении в руке пустой чашки на блюдце издается дребезжащий звук как результат мелкого тремора кистей рук).
Под влиянием тироидных гормонов наблюдаются изменения в костной системе. У детей происходит ускорение роста. Катаболическое действие гормонов приводит к потере белка костной ткани (матрица кости), что проявляется остеопорозом. Боли в области спины и в костях имеют “остеопоротическое” происхождение.
Нарушения функции ЦНС проявляются раздражительностью, беспокойством, повышенной возбудимостью, лабильностью настроения, потерей способности концентрировать внимание (больной переключается с одной мысли на другую), расстройства сна, иногда депрессия и даже психические реакции. Истинные психозы встречаются редко.
Нарушения функции половых желез проявляются в виде олиго- или аменореи, снижением фертильности. У мужчин появляется гинекомастия как следствие нарушения обмена половых гормонов в печени и изменения соотношения эстрогенов и андрогенов. Снижаются либидо и потенция. Кроме того, проведенные нами исследования (М.И. Балаболкин и Т.В Мохорт, 1983) показали, что у больных диффузным токсическим зобом имеется гиперпролактинемия, которая коррелирует с нарушениями функции половых желез.
Жажда и полиурия могут быть симптомами диабета в том случае, если у больного до заболевания была нарушена толерантность к глюкозе, а избыток тироидных гормонов способствует декомпенсации углеводного обмена вплоть до развития явного сахарного диабета.
При диффузном токсическом зобе в большинстве случаев имеются характерные изменения (блеск глаз и др.) со стороны глаз. Глазные щели расширены, что создает впечатление гневного, удивленного или испуганного взгляда. Широко расширенные глазные щели часто создают впечатление наличия экзофтальма. Однако экзофтальм характерен для офтальмопатии, которая нередко сочетается с диффузным токсическим зобом. Характерно редкое мигание (симптом Штельвага), пигментация век (симптом Еллинека), как правило, при длительном и тяжелом течении заболевания.
При взгляде вниз между верхним веком и радужной оболочкой появляется участок склеры (симптом Грефе). При взгляде вверх также обнаруживается участок склеры между нижним веком и радужкой (симптом Кохера). Нарушение конвергенции глазных яблок (симптом Мебиуса). При взгляде прямо иногда выявляется полоска склеры между верхним веком и радужной оболочкой (симптом Дельримпля). Развитие этих симптомов связано с усилением тонуса гладких мышечных волокон, участвующих в поднимании верхнего века, которые иннервируются симпатической нервной системой.
Аутоиммунная офтальмопатия – самостоятельное аутоиммунное заболевание, представляющее собой комплексное поражение тканей орбиты и сопровождающееся инфильтрацией, отеком и пролиферацией ретробульбарных мышц, клетчатки и соединительной ткани. В течение десятков лет офтальмопатия описывалась под названием отечного экзофтальма, злокачественного экзофтальма, нейродистрофического экзофтальма, орбитопатии, эндокринного экзофтальма, тиротоксического экзофтальма и др. Различные приведенные названия отражают попытку связать патогенез офтальмопатии с перечисленными состояниями. Лишь в последние годы удалось получить убедительные доказательства в пользу аутоиммунного генеза офтальмопатии. Аутоиммунная офтальмопатия может встречаться как самостоятельное, независимое от тиротоксикоза заболевание, в сочетании с диффузным токсическим зобом или с претибиальной микседемой. Описаны многочисленные сочетания аутоиммунной офтальмопатии с аутоиммунным тироидитом, протекающим с нормальной или пониженной функцией щитовидной железы. По данным различных авторов, частота аутоиммунной офтальмопатии в сочетании с диффузным токсическим зобом составляет от 5 до 20%. Применение для диагностики аутоиммунной офтальмопатии УЗИ, компьютерной или МР-томографии показало, что аутоиммунная офтальмопатия в различной степени ее проявления встречается более часто, чем считалось раньше, и ее распространенность составляет до 40-50% у больных, страдающих диффузным токсическим зобом.
Аутоиммунная офтальмопатия чаще встречается у мужчин, причем у лиц белой расы она встречается, по данным различных авторов, в 4-6 раз чаще, чем у азиатских индейцев, проживающих в тех же районах. Показано, что использование радиоактивного йода для лечения диффузного токсического зоба удваивает частоту развития аутоиммунной офтальмопатии, в то время как хирургическое лечение или медикаментозная терапия диффузного токсического зоба не являются факторами риска развития аутоиммунной офтальмопатии. Аутоиммунную офтальмопатию следует отличать от глазных симптомов, описанных выше и являющихся частью синдрома тиротоксикоза.
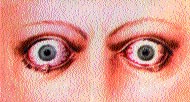
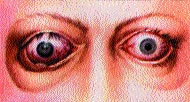
Характерным для аутоиммунной офтальмопатии является наличие экзофтальма и кроме этого больные предъявляют характерные жалобы на боли в глазных яблоках, ощущение “песка в глазах”, слезотечение, светобоязнь. Постоянно выявляются отечность век, инъекция сосудов склеры и новообразование сосудов (плохой прогностический признак). Как правило, экзофтальм при аутоиммунной офтальмопатии несколько асимметричный, может быть односторонним, сочетается с отеком, инфильтрацией век и конъюнктивитом (рис 20, см. вклейку). Отсутствует параллелизм в течении диффузного токсического зоба и офтальмопатии.
В норме протрузия глазного яблока составляет 16-19 мм. Различают три степени офтальмопатии, при которых протрузия глазного яблока увеличивается на 3-4 мм, 5-7 мм и свыше 8 мм соответственно. Американская ассоциация по заболеваниям щитовидной железы предлагает изменения глаз при диффузном токсическом зобе подразделять на следующие классы: “0” – отсутствие каких- либо изменений; 1-й класс – только ретракция верхнего века, которая достаточно выражена при наличии тиротоксикоза и спонтанно исчезает при эутироидном состоянии; 2-й класс – к указанным выше изменениям присоединяется отек мягких тканей (периорбитальный отек), иногда с отеком и покраснением конъюнктивы; 3-й класс – к перечисленным симптомам присоединяется экзофтальм и протрузия глазного яблока увеличивается на 3-4 мм; 4-й класс – увеличение протрузии глазного яблока на 5-7 мм по сравнению с нормой и вовлечение в воспалительный патологический процесс глазных мышц; 5-й класс – из-за выраженного экзофтальма в патологический процесс вовлекается роговица (кератит); 6-й класс – из-за изменений на глазном дне и вовлечения в процесс зрительного нерва наблюдается снижение остроты зрения.
Таким образом, в последней классификации к собственно офтальмопатии следует отнести классы 3-6, тогда как классы 0-2 следует относить к глазным симптомам тиротоксикоза.
При значительной офтальмопатии (III степени) глазные яблоки выступают из орбит, веки и конъюнктива отечны, воспалены, развивается кератит вследствие постоянного высыхания роговицы и ее изъязвления, что может приводить к развитию “бельма” и снижению зрения вплоть до полной слепоты.
Изменения при аутоиммунной офтальмопатии преимущественно наблюдаются в мышцах глазницы, а также в слезных железах и ретробульбарной жировой клетчатке. Вовлекаются в патологических процесс все структурные элементы орбиты. Выявляется местная лимфатическая инфильтрация и интерстициальный отек, особенно мышц, объем которых увеличивается в 7-10 раз по сравнению с нормой. Увеличение вследствие этого объема орбиты приводит к появлению экзофтальма. Изменения в начальном периоде развития офтальмопатии характеризуются преимущественно явлениями инфильтрации перечисленных тканей, а при длительном течении аутоиммунной офтальмопатии в пораженных тканях развиваются уже необратимые явления фиброза. Последний приводит к ограничению движений глазного яблока, прогрессированию экзофтальма, ухудшению зрения вследствие венозного застоя в сосудах сетчатки.
Описаны случаи окклюзии центральной вены сетчатки, нейропатия глазного нерва, а также потеря зрения вследствие механического сдавления глазного нерва отечной, увеличенной в объеме ретробульбарной клетчаткой. В.И. Мазуров и др. (1991) при обследовании с помощью компьютерной томографии выявили несколько вариантов патологических изменений в орбите: а) преимущественное увеличение объема глазодвигательных мышц, б) преимущественное увеличение объема ретробульбарной клетчатки, названное ими смешанный тип изменений, при котором выявляется увеличение почти в одинаковой степени и мышц, и клетчатки. Обследование орбит с помощью УЗИ выявляет увеличение протяженности ретробульбарного пространства, утолщение прямых глазодвигательных мышц и увеличение их акустической плотности. Ю.Т. Фишкина (1985) подчеркивает, что основным эхографическим признаком, отличающим стадию фиброза от инфильтративной стадии, является значительное увеличение акустической плотности мышц глаза. Повышенное ретробульбарное давление в результате лимфоидной инфильтрации, накопления жидкости и отека ретроорбитальных и ретробульбарных тканей не только приводит к выталкиванию глазного яблока из глазницы – экзофтальму, но и является причиной сдавления зрительного нерва с потерей зрения и может вызвать тромбоз вен сетчатки. Изменения в глазных мышцах приводят к диплопии.
Аутоиммунные механизмы развития офтальмопатии подтверждены многочисленными исследованиями. В мышцах глаза и ретробульбарной клетчатке имеет место характерная для аутоиммунных процессов инфильтрация CD4+ и CD8+ лимфоцитами и макрофагами. На фибробластах из тканей орбит выявляется экспрессия генов HLA II класса. Аутоактивированные лимфоциты CD4+ и СD8+ с участием макрофагов и различных цитокинов (g-интерферон, интерлейкин-1, фактор некроза опухолей, b-трансформирующий фактор роста, факторы, активирующие рост и функцию фибробластов, и др.) стимулируют местные фибробласты, которые усиливают синтез гликозамингликанов, являющихся гидрофобными структурами, что и способствует мощному отеку и увеличению объема тканей орбиты. Последние способствуют местной гипоксии, которая в свою очередь усиливает синтез гликозаминогликанов.
Роль клеточно-опосредованного и гуморального иммунитета в развитии аутоиммунной офтальмопатии неодинакова и зависит от профиля секретируемых цитокинов. Методом цепной полимеразной реакции McLachlan и. соавт. (1994) установили наличие 2 типов Т-хельперов в орбитальных тканях при диффузном токсическом зобе. Т-хельперы I типа секретируют g-интерферон, а Т-хельперы II типа – интерлейкин-4 и 5. Интерлейкин-10 в незначительных количествах секретируется Т-хельперами обоих типов. В патогенезе офтальмопатии, по мнению авторов, ключевая роль принадлежит интерлейкину-4, а не g-интерферону.
Пролиферация активированных Т-лимфоцитов стимулирует гуморальный иммунитет и образование антител к мышцам глазницы и фибробластам орбитальных тканей. Выявляются антитела к антигену с мол. м. 55, 64 и 95 кДа. При офтальмопатии, сочетающейся с диффузным токсическим зобом, в мышцах глаза, эндотелиальных и интерстициальных клетках выявляется экспрессия генов HLA-DR, но преимущественно гена белка-70 температурного шока.
Исследованиями последних лет установлено, что одним из антигенов, к которому образуются антитела при аутоиммунной офтальмопатии, является рецептор к ТТГ. Так, H. Burch и соавт. (1994), используя антисыворотку к высокоиммунной части рецептора ТТГ человека (последовательность аминокислот 352-367), идентифицировали методом иммуноблотинга несколько белков с мол. м. 95, 71 и 18 кДа, участвующих в патогенезе аутоиммунной офтальмопатии, сочетающейся с диффузным токсическим зобом. Другая группа исследователей (R. Pascke и соавт., 1994) в ретроорбитальных мышцах, фибробластах, мононуклеарных клетках крови обнаружили транскрипты рецептора ТТГ. Более того, имело место образование гликозаминогликанов в культуре фибробластов под влиянием бычьего ТТГ, тогда как рекомбинантный ТТГ человека, даже в высокой концентрации, не стимулировал синтез гликозаминогликанов. Высказано предположение о наличии в орбиталных тканях лишь экстраклеточной части рецептора к ТТГ, который проявляет свойства нефункционального аутоантигена. Эти данные соответствуют результатам других исследований, в которых показано, что фибробласты содержат РНК, кодирующую внеклеточный домен рецептора ТТГ, и что при аутоиммунной офтальмопатии удалось обнаружить точечную мутацию, ведущую к замене треонина на пролин в экстраклеточном домене рецептора ТТГ (R.S. Bahn и соавт., 1993; A. Feliciello и соавт., 1993; R. Bahn и соавт. 1994). Такой мутантный рецептор к ТТГ, выявляемый в фибробластах при офтальмопатии и претибиальной микседеме, сочетающейся с диффузным токсическим зобом, может иметь, по мнению авторов, уникальные иммуногенетические свойства и участвовать в патогенезе аутоиммунной офтальмопатии. Этот аутоантиген фибробластов может распознаваться лимфоцитами, направленными против рецептора ТТГ при диффузном токсическом зобе. Последующая инфильтрация тканей орбиты активированными цитокинпродуцирующими лимфоцитами сопровождается, вероятнее всего, избыточным синтезом гликозаминогликанов и дополнительной пролиферацией фибробластов и вовлеченных в процесс тканей.
Претибиальная (локальная) микедема является также самостоятельным аутоиммунным заболеванием и встречается при диффузном токсическом зобе значительно реже (не более 4% популяции больных диффузным токсическим зобом), чем аутоиммунная офтальмопатия. Термин претибиальная микседема не соответствует современному взгляду на патогенез и развитие этой патологии. Некоторые авторы обозначают эти поражения кожных покровов как “дермопатия”. С нашей точки зрения, правильнее обозначать такие изменения кожных покровов как “аутоиммунная дермопатия”, которая почти всегда сочетается с наличием офтальмопатии. Как правило, поражается кожа передней поверхности голени, она становится отечной, утолщенной, с выступающими волосяными фолликулами, пурпурно-красного цвета и напоминает кожу апельсина (рис. 20, б). Действительно, наиболее часто аутоиммунная дермопатия проявляется поражением кожи передней поверхности голени. Однако такие же поражения встречаются на коже тыльной поверхности и пальцах кисти. Поражение часто сопровождается значительной эритемой и зудом. Гистологически в периферическом слое кожи обнаруживаются отек, повышенная инфильтрация мукополисахаридами и избыточное количество муцина, которое как бы “расщепляет” пучки коллагена на отдельные коллагеновые волокна. Иногда аутоиммунная дермопатия, так же как и аутоиммунная офтальмопатия, возникает через 4-20 мес. после лечения диффузного токсического зоба радиоактивным йодом.
а 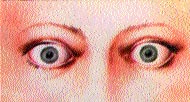
б 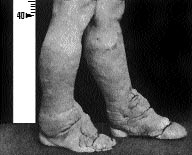
Рис 20. Офтальмопатия (а) и претибиальная микседема (б) при диффузном токсическом зобе.
Акропатия – характерные изменения (отечность мягких тканей и подлежащих костных тканей в области кистей фаланги пальцев, кости запястья). На рентгенограммах выявляются субпериостальные образования костной ткани, которые выглядят, как пузыри мыльной пены. Эти изменения обычно сочетаются с тиротоксикозом, офтальмопатией и претибиальной микседемой. При отсутствии последних диагноз акропатии затруднителен и в таких случаях необходима дифференциальная диагностика между акромегалией, легочной гипертрофической остеоартропатией. Для подтверждения диагноза акропатии необходимо сканирование пораженной области после внутривенного введения 99mТс-пирофосфата. Вовлеченные в процесс мягкие и костные ткани почти избирательно поглощают, как и участки поражения претибиальной микседемы, указанный изотоп.
Особенностью клинического течения диффузного токсического зоба у детей и подростков является, как правило, отсутствие классических признаков заболевания и офтальмопатии. Сравнительно редко диффузный токсический зоб встречается у детей дошкольного возраста, тогда как частота заболевания увеличивается в подростковом возрасте, причем у девочек диффузный токсический зоб встречается в 5-7 раз чаще, чем у мальчиков. Такие больные предъявляют жалобы на повышенную утомляемость и общую слабость, снижение способности в концентрации внимания. Подростки начинают плохо учиться, пропускают школу, наблюдаются изменения в поведении. У девочек позже, чем обычно, появляются менархе и устанавливается менструальный цикл. Щитовидная железа не достигает в большинстве случаев размеров, наблюдаемых при диффузном токсическом зобе у взрослых. Клиническое и лабораторное обследование больных в таких случаях позволяет своевременно диагностировать заболевание и проводить необходимую терапию.
В.Г. Баранов (1977) предлагает следующие критерии для оценки степени тяжести тиротоксикоза. Тиротоксикоз I степени сопровождается нерезко выраженной симптоматикой, пульс не более 100 в минуту, основной обмен не превышает +30%, признаков нарушения функции других органов и систем нет. Для тиротоксикоза II степени характерны отчетливо выраженная симптоматика при значительной потере массы тела, нарушения функции желудочно-кишечного тракта, тахикардия 100-120 в минуту с эпизодами нарушения ритма, основной обмен от +30 до 60%. При тиротоксикозе III степени (висцеропатическая форма, которая без лечения может прогрессировать в кахексическую форму) наблюдаются выраженный дефицит массы тела, тахикардия свыше 120 в минуту, нередко мерцательная аритмия, сердечная недостаточность, поражение печени, основной обмен превышает +60%.
Большую опасность для жизни представляет тиротоксический криз, который встречается у 0,02 – 0,05% больных и обычно развивается под влиянием провоцирующих факторов. Среди них на первом месте стоит травма (хирургическое вмешательство на щитовидной железе или других органах, грубая пальпация щитовидной железы), непроходимость кишечника, психическая травма, инфаркт миокарда. Диабетический кетоацидоз, эмоциональный стресс, прием избыточного количества йода у лиц, проживающих в условиях йодной недостаточности, интеркуррентные инфекции (часто пневмония), беременность, роды, радиойодтерапия. Тиротоксический криз чаще возникает при диффузном токсическом зобе, чем при других формах тиротоксикоза. Он почти исключительно встречается у женщин с диффузным токсическим зобом, чаще в теплое время года (лето) и в 70% случаев развивается остро.
Основное место в патогенезе тиротоксического криза отводится тироидным гормонам. Выше указывалось, что грубая пальпация, операция на щитовидной железе, психические травмы играют провоцирующую, “запускающую” роль в развитии тиротоксического криза, особенно у нелеченных или нерегулярно принимающих тиростатические препараты больных. Под влиянием перечисленных моментов происходит внутритироидальное высвобождение гормонов и поступление их в кровь. В некоторых случаях тироидные гормоны высвобождаются из связанного с белками (тироксинсвязывающий глобулин и др.) крови состояния под влиянием приема лекарств (салицилаты, клофибрат и др.), которые конкурируют с тироидными гормонами за связь с этими белками, особенно после окончания приема тиростатических препаратов.
В большинстве случаев при тиротоксическом кризе или в начале его развития выявляется повышение содержания Т3 и Т4 в сыворотке крови. Однако нет полной корреляции между уровнем тироидных гормонов в крови и степенью выраженности клинических проявлений тиротоксикоза. Это связано, вероятно, с тем, что внеклеточный уровень тироидных гормонов не соответствует их внутриклеточному содержанию. Установлено, что тироксин в связанной форме с транстиретином комплексируется мембранами клеток и Т4 транспортируется внутрь мембраны, где происходит его конверсия в Т3, а последний поступает лишь после этого во внеклеточное пространство и в кровь или внутрь клеток. Не исключено, что при тиротоксическом кризе блокируется поступление образовавшегося в толще мембраны клетки Т3 в кровь, вследствие чего он далее транспортируется только к ядру и митохондриям клетки.
Избыток тироидных гормонов вызывает усиление катаболизма и ускорение окислительных процессов внутри клетки. Снижается масса тела больного, быстро расходуются источники энергии – уменьшается содержание гликогена и жира в печени. Катаболизм белков мышц сопровождается резкой мышечной слабостью. Повышение окислительных процессов на периферии (окисление жиров, углеводов и в последнюю очередь белков), с одной стороны, требует постоянного достаточного количества кислорода, а с другой – образуется избыточное количество тепловой энергии, которая вызывает гипертермию, иногда до 400С. Наблюдаемые при этом тахикардия, тахипноэ, повышение систолического объема крови и систолическая артериальная гипертензия являются до известной степени компенсаторными реакциями для удовлетворения повышенной потребности периферических тканей в кислороде и рассредоточения образовавшейся тепловой энергии. Кроме того, тироидные гормоны могут оказывать прямое токсическое влияние на сердечную мышцу.
Эти факторы приводят к развитию сердечно-сосудистой недостаточности и мерцательной аритмии. Избыточное количество тироидных гормонов в крови вызывает нарушения функции ЦНС и желудочно-кишечного тракта.
Диффузный токсический зоб сопровождается повышением скорости обмена кортикостероидов в организме, усилением их распада, выведения и преимущественным образованием менее активных соединений. В результате при этом заболевании развивается относительная надпочечниковая недостаточность, которая усиливается при тиротоксическом кризе.
Кроме того, при тиротоксикозе вообще, а особенно при тиротоксическом кризе наблюдается активирование калликреин-кининовой системы, что проявляется резким повышением содержания брадикинина, кининогена, активности кининаз и других компонентов системы. Эти нарушения приводят к выраженным расстройствам микроциркуляции, развитию необратимой гипотензии и коллапса, которые являются неотъемлемой частью клинической картины финальной стадии тиротоксического криза.
Клиника тиротоксического криза сопровождается резким нарушением функции ряда систем и органов, в частности ЦНС, сердечно-сосудистой, желудочно-кишечной, гипоталамо-гипофизарно-надпочесниковой, а также печени и почек. Выражены психическое и двигательное беспокойство вплоть до острого психоза или, наоборот, сонливость (реже), дезориентация и даже коматозное состояние, высокая температура (выше 380С), удушье, боли в области сердца, тахикардия, достигающая 150 в минуту, иногда мерцательная аритмия. У пожилых больных повышение температуры может быть лишь незначительным. Частота сердечных сокращений, как правило, не соответствует повышению температуры, т.е. превышает таковую, наблюдаемую при гипертермии другой этиологии (инфекция и т. п.). Кожа горячая, гиперемирована, влажная от профузного пота, с гиперпигментацией складок. Боли в животе, сопровождающиеся тошнотой, диареей, иногда желтухой и редко картиной острого живота. Часто гепатомегалия, особенно при сердечно-сосудистой недостаточности. Увеличивается минутный объем и происходит перераспределение крови от внутренних органов на периферию для рассредоточения образующейся в избыточном количестве тепловой энергии. Нарушение функции печени может быть следствием такого перераспределения крови. Пульсовое давление и оксигенация венозной крови увеличиваются. Вследствие этого увеличивается клиренс как эндогенных гормонов, так и различных лекарственных препаратов, что необходимо иметь в виду при проведении терапии. При тиротоксическом кризе повышается чувствительность к b-адренергическим агонистам. Указанное диктует необходимость проведения мониторирования показателей сердечно-сосудистой деятельности при лечении тиротоксического криза.
Выраженность психоневрологических симптомов тиротоксического криза имеет и прогностическое значение, так как прогрессирующая спутанность сознания, потеря ориентировки, заторможенность являются предвестниками тиротоксической комы, почти всегда заканчивающейся летально.
Неблагоприятным прогностическим признаком при тиротоксическом кризе служит желтуха, появление которой указывает на угрозу печеночной недостаточности.
Самым опасным осложнением тиротоксического криза является сердечно-сосудистая недостаточность. Дистрофия миокарда и снижение его функциональных резервов, развивающиеся при диффузном токсическом зобе, усугубляются гипоксией, выраженными метаболическими и микроциркуляторными нарушениями в течении тиротоксического криза. В этой связи около половины летальных исходов при тиротоксическом кризе связано с развитием острой сердечно-сосудистой недостаточности.
В период тиротоксического криза наблюдается дальнейшее повышение содержания общего и свободного Т3 и Т4 в сыворотке крови, однако их определение не требуется для подтверждения тиротоксического криза. Большее значение имеет определение функции печени, почек и содержание электролитов в сыворотке крови. Восстановление нормального водно-электролитного баланса в период лечения является обязательным условием успешной терапии тиротоксического криза.
Диагноз и дифференциальная диагностика. Диагноз диффузного токсического зоба основывается на результатах клинического обследования и подтверждается лабораторными данными. Необходимо отметить, что в поликлинических условиях чаще встречается гипердиагностика диффузного токсического зоба, и нередко среди лиц, поступающих в отделения эндокринологии с таким диагнозом, выявляются больные с неврастенией, нарушениями психики, нейроциркуляторной дистонией. Если у больного с диффузным токсическим зобом кисть теплая и влажная, то у больного неврастенией – холодная, влажная от липкого пота.
Похудание может наблюдаться при обоих состояниях, однако при нейроциркуляторной дистонии, как правило, умеренное снижение веса сопровождается снижением аппетита, при диффузном токсическом зобе аппетит не только не снижен, но повышен. Несмотря на значительно больший прием пищи у больных диффузным токсическим зобом снижение веса прогрессирует. Тахикардия исчезает в покое. В качестве теста для проведения дифференциальной диагностики рекомендуется простая, но реливантная процедура, заключающаяся в следующем. У больного в два часа ночи необходимо посчитать пульс. При нейроциркуляторной дистонии его частота будет ниже 80 ударов в минуту, а у больного диффузным токсическим зобом – свыше 80. Артериальное давление часто пониженное, но может быть в норме и умеренно повышенным. При этом пульсовое давление в обычных пределах, тогда как при диффузном токсичесом зобе повышено. Повышение основного обмена до высоких цифр встречается при диффузном токсическом зобе, причем уровень холестерина в сыворотке крови у этих больных, как правило, снижен, тогда как при неврастении как основной обмен, так и содержание холестерина в сыворотке крови в пределах нормы.
Близкая клиническая симптоматика (помимо диффузного токсического зоба и нейроциркуляторной дистонии – раздражительность, эмоциональная неустойчивость, плохой сон, плаксивость, чувство жара, повышенная плаксивость) имеет место при климактерическом неврозе. Если нейроциркуляторная дистония встречается чаще у лиц молодого возраста, то невроз климактерического периода у лиц после прекращения менструального цикла (обычно 45-50 лет). Вместо характерного снижения массы тела – его повышение. Чувство “жара” не постоянно, а характерные “приливы”, длящиеся несколько секунд или минут и сменяющиеся иногда чувством зябкости. Помимо различия в клинической картине, при лабораторном обследовании выявляется достоверная разница в содержании тироидных гормонов в сыворотке крови.
В некоторых случаях при диффузном токсическом зобе имеется выраженная атрофия мышц, что необходимо дифференцировать от неврологических заболеваний, сопровождающихся миопатией.
Исключительно редко встречается тиротоксический периодический паралич, развивающийся спонтанно и внезапно и сопровождающийся почти полной обездвиженностью. При этом всегда имеет место гипокалиемия. Тиротоксический паралич можно предупредить введением препаратов калия и b-блокаторов.
У лиц пожилого возраста (чаще женщин) диффузный токсический зоб может протекать под маской сердечно-сосудистых заболеваний (тахикардия с признаками сердечной недостаточности, нарушение ритма по типу мерцательной (предсердной) аритмии, которая резистентна к лечению препаратами дигиталиса). Повышенная раздражительность, нервозность и лабильность, столь характерная для лиц сравнительно молодого возраста, у них отсутствует. Чаще имеет место апатия, сонливость, что обычно расценивается как сенильные (возрастные) проявления. Снижение массы тела у больных пожилого возраста наблюдается на фоне сниженного аппетита, что часто диктует необходимость исключения патологии желудочно-кишечного тракта. Гастроскопия и другие исследования, проводимые до компенсации тиротоксикоза, могут способствовать резкому ухудшению состояния больного. Следует иметь в виду, что умеренные клинические признаки тиротоксикоза у пожилых больных могут наблюдаться при раке щитовидной железы и его метастазах. Поэтому при увеличенной щитовидной железе, неоднородности ее строения, выявляемого на УЗИ или сканировании, необходимо также проводить биопсию.
Большое диагностическое значение имеет исследование содержания гормонов щитовидной железы в крови (общий и свободный Т4, Т3, тироксинсвязывающие белки). У больных с диффузным токсическим зобом уровень Т4 и Т3 в сыворотке крови повышен. Необходимо иметь в виду, что увеличение общего тироксина в сыворотке крови еще не является свидетельством повышения функции щитовидной железы. Встречается так называемый синдром повышенного содержания тироксинсвязывающего белка (семейная дисальбуминемичекая гипертироксинемия), для которого характерна высокая концентрация общего Т4 и тироксинсвязывающих белков (преимущественно альбумина) при нормальном показателе свободного Т4, Т3 и ТТГ. Это наследственное заболевание, и у многих родственников таких лиц повышенный уровень Т4 при отсутствии клинических признаков тиротоксикоза сочетается с соответствующим увеличением концентрации тироксинсвязывающих белков. Данная патология наследуется как признак, сцепленный с Х-хромосомой.
Кроме того, повышение уровня Т4 и Т3 в сыворотке крови встречается при синдроме резистентности к тироидным гормонам как доминантный признак, и данная патология связана с нарушением взаимодействия гормона с клеточными рецепторами.
В некоторых случаях выявляется нормальная концентрация Т4 и избыточное содержание Т3 в сыворотке крови – так называемый Т3-токсикоз, клиническая картина которого не отличается от таковой обычного тиротоксикоза.
Необходимо отличать так называемый йод-базедов феномен – состояние, при котором клиническая картина тиротоксикоза развивается в случае применения препаратов йода в больших дозах, в том числе у лиц, находящихся в йоддефицитных районах. Развитие тиротоксикоза в этих случаях связывают с тем, что гиперплазированная щитовидная железа, которая постоянно встречается при йодной недостаточности, продолжает поглощать йод, как и ранее, хотя йодная недостаточность ликвидирована. Это в свою очередь приводит к избыточной секреции тироидных гормонов. Кроме того, нельзя исключить и другую возможность, когда в период йодной недостаточности наряду с диффузной гиперплазией имеются узлы, которые в условиях недостатка йода никак себя не проявляют, а при достаточном количестве йода начинают функционировать автономно, избыточно продуцируя тироидные гормоны.
Для диагностики диффузного токсического зоба широко используются радионуклидные методы исследования. Радиодиагностика выявляет повышенное поглощение радиоактивного йода, так же как и 99mТс. Наряду с определением поглощения радиоактивного йода проводится сканирование щитовидной железы (рис. 21, см. вклейку), которое можно сочетать с пробой с трийодтиронином. Угнетение поглощения радиоактивного йода после приема Т3 исключает диагноз диффузного токсического зоба. Проведение пробы с трийодтиронином может привести (особенно у лиц пожилого возраста) к развитию сердечной недостаточности при наличии скрытой ИБС. В настоящее время вместо этого теста широко применяется проба с тиролиберином, которую можно проводить беременным. Нормальный ответ секреции ТТГ на введение тиролиберина исключает диагноз диффузного токсического зоба, тогда как при его наличии повышения уровня ТТГ в сыворотке крови не происходит. При проведении пробы с тиролиберином следует иметь в виду, что некоторые фармакологические препараты (альдактон, сульпирид и др.), не меняя базальный уровень Т4, Т3 и ТТГ в сыворотке крови, резко повышают ответ ТТГ на введение тиролибеина. Это связано с модуляцией рецепторов тиротрофов к тиролибеину или изменением гормонорецепторного взаимодействия Т3 в гипофизе.
Сравнительно редко причиной тиротоксикоза является тиротропинома – аденома передней доли гипофиза, продуцирующая ТТГ. Клиническая картина не отличается от таковой при диффузном токсическом зобе. При обследовании выявляется наряду с повышенными цифрами общего и свободного Т4 и Т3 высокий уровень ТТГ в сыворотке крови, который при диффузном токсическом зобе изредка в норме или чаще снижен.
Для дифференциальной диагностики диффузного токсического зоба и тиротоксической аденомы щитовидной железы необходимо сканирование как до, так и после стимуляции ТТГ. Наличие тироидстимулирующих антител свидетельствует о диффузном токсическом зобе, а отсутствие – о тиротоксической аденоме.
Тиротоксикоз, обычно легкой или средней тяжести, может быть при послеродовом, “безболезненном” или подостром тироидите, при которых низкое или неопределяемое содержание ТТГ в сыворотке крови сочетается с повышенным уровнем тироидных гормонов.
Обязательно необходима дифференциальная диагностика диффузного токсического зоба и тиротоксической фазы аутоиммунного тироидита. При аутоиммунном тироидите щитовидная железа диффузно увеличенна и при пальпации ощущается неравномерность ее плотности, в то время как при диффузном токсическом зобе она более эластична и одинаковой плотности. Тиротоксикоз при аутоиммунном тироидите легкой или в крайнем случае средней тяжести. Различно и время проявления клинической картины тиротоксикоза. При аутоиммунном тироидите более длителен анамнез, тогда как при диффузном токсическом зобе развернутая клиническая картина проявляется в течение более короткого периода. Однако антитела к тироглобулину и к тироидной пероксидазе выявляются как при диффузном токсическом зобе, так и при аутоиммунном тироидите, для которого характерен гипотироз даже после небольшого периода, в течение которого отмечалась невыраженная картине умеренного тиротоксикоза.
Диагностика аутоиммунной офтальмопатии при отсутствии тиротоксикоза представляет определенные трудности. Антитела к тироглобулину и к тироидной пероксидазе выявляются у 70-75% больных с офтальмопатией, и титр их значительно выше, чем у больных с диффузным токсическим зобом. При одностороннем экзофтальме необходимо исключить опухоль, кисту, эхинококк ретроорбитальной области. Для диагностических целей применяется ультросонография (УЗИ) или компьютерная томография, реже венография.
Выше указывалось, что претибиальная микседема чаще встречается в сочетании с диффузным токсическим зобом и офтальмопатией. При претибиальной микседеме титр ЛАТС-фактора, как и других тироидстимулирующих антител в сыворотке крови, повышен. Область кожи, пораженная претибиальной микседемой, концентрирует 99mТс-пирофосфат в большом количестве.
Лечение. Терапия диффузного токсического зоба комплексная. Больной должен получать полноценное питание с достоточным количеством витаминов и микроэлементов. Необходимо восстановить нормальный сон и с этой целью целесообразно использовать различные седативные препараты. При выборе последних следует иметь в виду, что барбитураты ускоряют метаболизм тироксина и, следовательно, такие препараты, как фенобарбитал, помимо седативного эффекта, будут снижать уровень тироидных гормонов в крови.
Для лечения диффузного токсического зоба применяются тиростатические препараты, препараты йода, комбинация седативных препаратов и b-блокаторов, радиоактивный йод, хирургическое вмешательство. При тиротоксикозе легкой степени проводят лечение йодом в сочетании с b-блокаторами и седативными препаратами. Йодиды применяются для предоперационной подготовки по поводу тиротоксикоза, а также вместе с антитироидными препаратами для терапии тиротоксического криза. Традиционно для этой цели используется раствор Люголя или насыщенный раствор йодида калия, который назначают в дозе от 1 до 10 капель в день. Люголевский раствор готовят по следующей прописи: Kalii iodati 2,0; Iodi puri 1,0; Aq. destill. ad 30,0. В 5 каплях раствора содержится 180 мг йодидов.
Эффект терапевтических доз йодида (180-200 мг в день) проявляется уже через 2-3 недели: снижается уровень Т4 и Т3 в сыворотке крови, повышается реакция ТТГ на введение тиролиберина. Препараты йода тормозят биосинтез тироидных гормонов, при этом нарушается способность щитовидной железы поглощать из крови неорганический йод и снижается секреция Т4 и Т3. Кроме того, уменьшается чувствительность железы к стимулирующему действию ТТГ, а при диффузном токсическом зобе – к влиянию тироидстимулирующих антител. Следует иметь в виду, что длительное использование препаратов йода может вести к усилению тиротоксикоза.
В таких случаях целесообразнее применять различные b-блокаторы (индерал, анаприлин, обзидан, атенолол, альпренолол, метопролол) по 40-60 мг в сутки, но доза в случае необходимости может быть увеличена до 100-120 мг в сутки. b-Блокаторы уменьшают силу и частоту сердечных сокращений, блокируют положительный хронотропный и инотропный эффект катехоламинов. За счет замедления синусового ритма, уменьшения и исчезновения экстрасистолии, снижения АД и ударного объема b-блокаторы значительно уменьшают гиперфункцию тиротоксического сердца. Несмотря на отдельные публикации о положительном эффекте b-блокаторов в качестве монотерапии при диффузном токсическом зобе, такая терапия как самостоятельный метод лечения в настоящее время не рекомендуется. При внезапной отмене b-блокаторов могут наблюдаться явления усиления функции симпато-адреналовой системы (тремор, потливость, раздражительность, слабость, сердцебиение), что диктует необходимость постепенной (в течение 3-5 дней) отмены b-блокаторов.
b-Адренергический механизм опосредует только часть сопровождающих тиротоксикоз вегетативных и висцеральных расстройств и прямо не связан с выраженными метаболическими нарушениями (в том числе с расстройствами тканевого дыхания), которые во многом определяют тяжесть состояния. Вместе с тем клиническая практика показала, что фармакодинамический эффект b-блокаторов при тиротоксикозе выражен больше, чем можно было бы ожидать, исходя из представлений о механизме их действия. Как теперь установлено, они уменьшают периферическую конверсию тироксина в трийодтиронин, благодаря чему уже через 1 ч после введения b-блокаторов концентрация Т3 в крови снижается. Следует иметь в виду, что b-блокаторы и другие симпатолитики не являются средством этиотропного лечения и должны использоваться только как дополнительная патогенетическая терапия. Показано также применение резерпина по 0,1 мг 2-3 раза в день.
Клинический эффект приема йодидов – не только снижение и ликвидация явлений тиротоксикоза, но и уменьшение размеров, плотности и кровоснабжения щитовидной железы. У лиц, ранее лечившихся радиоактивным йодом или подвергавшихся хирургическому вмешательству, при этой терапии могут развиваться даже явления гипотироза.
В последние годы значительное распространение получило применение йодидов в виде иподата натрия (ораграфин или телепак), который, помимо прямого ингибирующего влияния на функцию щитовидной железы, снижает скорость образования Т3 из Т4. Препарат назначают в дозе 1 г в день и уже через 10-14 дней может наблюдаться восстановление эутироидного состояния.
Перхлорат калия, который поглощается щитовидной железой и конкурирует с йодом за связывание с йодконцентрирующей системой щитовидной железы и тем самым блокирует поглощение йода щитовидной железой, может применяться в период предоперационной подготовки в суточной дозе 600-800 мг. В настоящее время применяется крайне редко.
Препараты лития в виде карбоната лития в суточной дозе 900-1500 мг с успехом используются для лечения диффузного токсического зоба. Литий стабилизирует мембраны и тем самым снижает стимулирующее действие ТТГ и тироидстимулирующих антител на щитовидную железу, уменьшая высвобождение гормонов из щитовидной железы, что приводит к уменьшению концентрации Т4 и Т3 в сыворотке крови. По скорости снижения клинических проявлений тиротоксикоза препараты лития сравнимы с препаратами йода. В отличие от йода препараты лития снижают скорость метаболизма тироидных гормонов. В этой связи карбонат лития применяется в комбинации с тиростатическими препаратами при необходимости быстро ликвидировать тиротоксикоз, а препараты йода не могут быть использованы из-за высокой к ним чувствительности. Карбонат лития может быть использован при диффузном токсическом зобе в качестве монотерапии. Эутироидное состояние достигается быстро, но через 3-4 месяца щитовидная железа “выскальзывает” из-под влияния ионов лития с рецидивом клинических проявлений тиротоксикоза. Применяя терапевтические дозы препаратов лития, при которых концентрация лития в крови не должна превышать 1 мэкв/л, необходимо иметь в виду возможность появления признаков его токсического действия (тошнота, рвота, нарушение сердечной деятельности, судороги и даже кома). Поэтому лечение карбонатом лития следует проводить под контролем его содержания в крови.
Из методов консервативной терапии широко применяется лечение тиростатическими препаратами, среди которых наиболее распространены производные имидазола (мерказолил, карбимазол, метимазол) и тиоурацила (пропилтиоурацил).
Мерказолил блокирует образование тироидных гормонов на уровне органофикации и взаимодействия моно- и дийодтирозина, а также тормозит йодирование тирозиновых остатков тироглобулина. Пропилтиоурацил ингибирует, как и мерказолил, образование тироидных гормонов путем снижения активности пероксидазы и образования йодтиронинов из йодтирозинов. Кроме того, пропилтиоурацил подавляет монодейодирование тироксина на периферии и его конверсию в Т3. Как известно, дейодирование происходит только в микросомальной фракции клеток, и ферментная система, катализирующая эту реакцию, состоит из дейодиназы-5, дейодирующей Т4 с переходом его в Т3, и дейодиназы-5, дейодирующей Т4 с переходом его в об. Т3. Поэтому эффект действия от использования пропилтиоурацила наступает быстрее, чем при применении мерказолила.
Лечение пропилтиоурацилом начинают с суточной дозы 300-600 мг (по 100-150 мг каждые 6 ч) и по достижении эутироидного состояния (обычно через 2-3 недели) доза препарата снижается до 200-400 мг (обычно на 1/3 от исходной) с постепенным ее уменьшением каждые 2-2,5 недели до поддерживающих доз – 50-100 мг в сутки.
Мерказолил назначают в дозе 40-60 мг (при легком тиротоксикозе – 30 мг). Указанная суточная доза должна быть разделена на 4 приема (каждые 6 ч). Обычно такая доза 2-3,5 нед. приводит к уменьшению симптомов тиротксикоза, масса тела больных увеличивается. С момента наступления эутироидного состояния доза антитироидных препаратов постепенно снижается (мерказолила до 5-10 мг в день). Прием поддерживающих доз антитироидных препаратов продолжается до 1-1,5 лет. Преждевременная отмена препарата приводит к рецидиву тиротоксикоза и необходимости назначать вновь высокие дозы антитироидных препаратов.
При длительном приеме тиростатических препаратов вследствие длительного и значительного (ниже нижней границы нормы) снижения уровня тироидных гормонов в крови и при условии восстановления функции обратной связи (гипофиз-щитовидная железа) усиливается секреция ТТГ, что приводит к стимуляции (гиперплазии) щитовидной железы и увеличению ее размеров (струмогенное действие). Для предупреждения такого действия антитироидных препаратов рекомендуется прием небольших доз тироидных гормонов (0,05-0,1 мкг тироксина в день), причем дозу тироксина подбирают так, чтобы состояние больного оставалось эутироидным.
В ряде публикаций показано, что при комбинированном применении тиростатиков с тироксином cнижается (до 35%) частота рецидивов диффузного токсического зоба по сравнению с больными, у которых терапия в течение 18 месяцев проводилась только тиростатиками. B. McIver и соавт. (1996) обследовали и лечили 111 больных с диффузным токсическим зобом, которые в течение первого месяца получали 40 мг карбимазола (аналог мерказолила), а после рандомизации больных разделили на две группы: монотерапия карбимазолом (первая группа – 52 больных) и комбинированная терапия – карбимазол +L-тироксин (вторая группа – 59 больных). Доза тироксина вначале составляла 100 мкг в сутки, а затем подбиралась индивидуально и поддерживалась на уровне, необходимом для ингибирования секреции ТТГ. В течение 18 месяцев терапии концентрация тироидстимулирующих антител снижалась с 23,4±28,4 до 3,4 ±7,3 ЕД/л (первая группа) и 30,6±35,0 до 5,3±12,1 ЕД/л (вторая группа). У 8 больных первой группы наблюдался рецидив диффузного токсического зоба через 6±4 мес после окончания терапии. У такого же числа больных (8 человек), получавших комбинированную терапию (вторая группа), наблюдался рецидив диффузного токсического зоба через 7±4 мес после окончания терапии. Эти данные убедительно показывают, что комбинированная терапия (карбимазол + тироксин) не снижает частоту рецидива диффузного токсического зоба.
Кроме того, в последние годы были опубликованы сообщения японских авторов об одинаковой терапевтической эффективности малых (10 мг) и больших (40 мг) доз тиростатических препаратов при лечении диффузного токсического зоба. С целью подтверждения этих данных было проведено многоцентровое (15 европейских клиник) исследование, в котором 251 больной получал 10
Date: 2015-07-01; view: 529; Нарушение авторских прав