
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Механізм спряження дихання та фосфорилування в мітохондріях
|
|
Існування поєднання перенесення електронів і окиснювапьного фосфорилування було відкрито у 30-их роках ХХ ст. російським вченим В.А.Енгельгардтом. Вивчаючи інтенсивність дихання мітохондрій голуба, він помітив, що одночасно з поглинанням кисню в цьому процесі використовується неорганічний фосфат з утворенням фосфорних ефірів, тобто має місце спряження дихання з фосфорилуванням.
У 1939 році українськими вченими В. Беліцером і Е.Цибаковою було виведено співвідношення Р/О як показник спряження дихання і фосфорилування. В. Беліцер показав, що при поглинанні одного атома кисню (або при перенесенні однієї пари електронів від субстрату на кисень) поглинається три атоми неорганічного фосфату: коефіцієнт Р/О дорівнює приблизно 3, тобто в дихальному ланцюзі є три пункти спряження або фосфорилування, де неорганічний фосфат приймає участь в утворенні АТФ.
Існує декілька гіпотез пояснення механізму цього процесу. Основні – це гіпотеза хімічного спряження, хеміосмотичного і механохімічного спряження або конформаційного спряження. У даний час найбільше обгрунтування отримала теорія хеміосмотичного спряження, розроблена англійським біохіміком П. Мітчеллом.
Більшість ферментів дихального ланцюга закріплені досить міцно у ліпідно-білковій структурі мембрани. Перша ланка дихального ланцюга пов‘язана з НАД-або ФАД-залежними дегідрогеназами, знаходиться на внутрішньому боці мембрани.
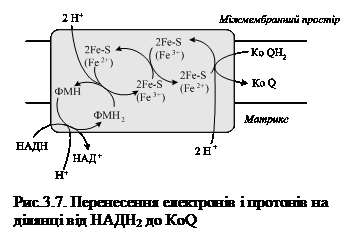 Як видно зі схеми, представленої на рис. 3.7 перше акцептування починається на ділянці від НАДН2 до КоQ (убіхінону). Отже, саме тут вивільняється перша пара протонів, а два електрони транспортуються з участю заліза до КоQ, який приєднує електрони і отримує від’ємний заряд та одночасно захоплюються протони з матриксу мітохондрій, що супроводжується утворенням КоQН2 і появою від’ємного заряду на внутрішній поверхні мембрани.
Як видно зі схеми, представленої на рис. 3.7 перше акцептування починається на ділянці від НАДН2 до КоQ (убіхінону). Отже, саме тут вивільняється перша пара протонів, а два електрони транспортуються з участю заліза до КоQ, який приєднує електрони і отримує від’ємний заряд та одночасно захоплюються протони з матриксу мітохондрій, що супроводжується утворенням КоQН2 і появою від’ємного заряду на внутрішній поверхні мембрани.
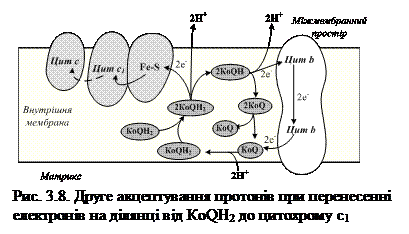
Друге акцептування протонів спостерігається при перенесенні електронів на ділянці від КоQН2 до цитохрому с1. Відновлений КоQН2 дифундує через мембрану до зовнішньої поверхні, де розміщений цитохром с1 і залізосірчаний білок. На внутрішній поверхні мембрани окиснення супроводжується переходом другої пари іонів 2Н+ в середовище і повернення двох електронів на залізосірчаний білок, а потім до другої молекули КоQ, при цьому він дістає від’ємний заряд і захоплює ще два протони з матриксу (рис.3.8).
 Третє акцептування відбувається, коли КоQН2 з участю цитохромів с1 і с передає електрони на цитохромоксидазу (аа3). На цитохромоксидазі, у якої активний центр повернений до матриксу, відбувається передача електронів на молекулярний кисень. Іони водню (Н+) для утворення молекул води поступають із матриксу мітохондрій.
Третє акцептування відбувається, коли КоQН2 з участю цитохромів с1 і с передає електрони на цитохромоксидазу (аа3). На цитохромоксидазі, у якої активний центр повернений до матриксу, відбувається передача електронів на молекулярний кисень. Іони водню (Н+) для утворення молекул води поступають із матриксу мітохондрій.
 Ліпідрозчинний кофермент Q (убіхінон), що легко дифундує з внутрішнього боку мембрани (від матрикса) до зовнішнього, виступає також перенощиком протонів із матриксу на зовнішню поверхню мембрани – у міжмембранний простір. Вважають, що енергія, яка виділяється при перенесенні їх в дихальному ланцюзі, перекачує протони із матриксу в міжмембранний простір, обминаючи їх нагромадження всередині самої мембрани. При цьому створюється так званий протонний потенціал (різниця концентрацій Н+ по обидва боки внутрішньої мембрани), а, отже, і електрохімічний потенціал (зарядженість), який використовується в процесах фосфорилування АДФ при утворенні АТФ. Тому внутрішня мембрана в мітохондрій непроникна для заряджених частинок і особливо для Н+ і ОН- Якщо б мембрана була проникною для іонів Н+, вони повернулися б назад, у напрямку їх меншої концентрації в матрикс. Енергія при цьому повинна виділятись у вигляді тепла. Це підтверджується і тим, що при додаванні деяких речовин, так званих “роз’єднуючих агентів” різко збільшується проникність внутрішньої мембрани для протонів, відбувається роз’єднання процесів тканинного дихання й окиснювального фосфорилування і утворення АТФ припиняється.
Ліпідрозчинний кофермент Q (убіхінон), що легко дифундує з внутрішнього боку мембрани (від матрикса) до зовнішнього, виступає також перенощиком протонів із матриксу на зовнішню поверхню мембрани – у міжмембранний простір. Вважають, що енергія, яка виділяється при перенесенні їх в дихальному ланцюзі, перекачує протони із матриксу в міжмембранний простір, обминаючи їх нагромадження всередині самої мембрани. При цьому створюється так званий протонний потенціал (різниця концентрацій Н+ по обидва боки внутрішньої мембрани), а, отже, і електрохімічний потенціал (зарядженість), який використовується в процесах фосфорилування АДФ при утворенні АТФ. Тому внутрішня мембрана в мітохондрій непроникна для заряджених частинок і особливо для Н+ і ОН- Якщо б мембрана була проникною для іонів Н+, вони повернулися б назад, у напрямку їх меншої концентрації в матрикс. Енергія при цьому повинна виділятись у вигляді тепла. Це підтверджується і тим, що при додаванні деяких речовин, так званих “роз’єднуючих агентів” різко збільшується проникність внутрішньої мембрани для протонів, відбувається роз’єднання процесів тканинного дихання й окиснювального фосфорилування і утворення АТФ припиняється.
Прикладом цього може служити дія 2,4-динітрофенолу (рис.3.9). Ця ліпофільна речовина легко дифундує через мітохондріальну мембрану, як в іонізованій, так і в неіонізованій формах, виступаючи джерелом протонів. Може переносити протони через мембрану в бік меншої концентрації, що призводить до зниження протонного потенціалу. У присутності роз’єднувачів (в тому числі і природних, наприклад тироксину), а також деяких лікарських засобів (аспірин, дикумарол тощо) вільна енергія, яка виділяється при перенесенні електронів, переходить в теплову. Використання кисню і окиснення субстратів при цьому продовжується, але синтез АТФ неможливий. Оскільки енергія окиснення при цьому розсіюється у вигляді тепла, то роз’єднувачі підвищують температуру тіла (пірогенна дія).
Всі вищевказані та інші факти мали значення для створення хеміосмотичної концепції спряження тканинного дихання з фосфорилуванням.
На думку П. Мітчелла енергія перенесення протонів і електронів у дихальному ланцюзі в першу чергу зосереджується у вигляді протонного потенціалу або електрохімічного градієнта іонів Н+, який створюється перекачуванням протонів через мембрану (по певних пунктах дихального ланцюга) з внутрішньої поверхні внутрішньої мембрани (з боку матриксу) на її зовнішню поверхню - в міжмембранний простір.
Одночасно поверхні мембрани заряджаються: зовнішня – позитивно, за рахунок збільшення концентрації Н+, а внутрішня – негативно за рахунок її зменшення і нестачі іонів ОН-, тобто створюється градієнт електричного потенціалу.Отже, ланцюг перенесення електронів працює як протонна помпа, перекачуючи протони з матриксу на зовнішній бік мембрани (рис. 3.10).
 В результаті цього створюється різниця концентрацій протонів і одночасно різниця електричних потенціалів із знаком плюс на зовнішній поверхні мембрани.
В результаті цього створюється різниця концентрацій протонів і одночасно різниця електричних потенціалів із знаком плюс на зовнішній поверхні мембрани.
Таким чином, на внутрішній мембрані одночасно з градієнтом концентрації протонів і виникає градієнт електричного потенціалу.
Розрахунки показали, що дихальний ланцюг мітохондрій при перенесенні двох протонів створює потенціал у 0,25 В.
Електрохімічний потенціал, який створився, примушує протони при їх надлишку на зовнішньому боці мембрани рухатися (за градієнтом концентрації) у зворотному напрямку – з зовнішньої мембрани у внутрішню (в матрикс). Проте мембрана є не проникною для них, за винятком окремих ділянок – протонних каналів, які є в ферментативному комплексі Н+-АТФ-синтетази. Зворотна дифузія протонів в матриксі призводить до зрівноваження різниці концентрацій Н+ і відбувається розрядження внутрішньої мембрани (зникає електричний потенціал). Одночасно в активному центрі ферменту Н+_АТФ-синтетази відбувається процес окиснювапьного фосфорилування.
Різниця потенціалів, яка виникла при перенесенні (зворотному) двох протонів, в 0,25 В повністю достатня для утворення однієї молекули АТФ. Так, при спряженні тканинного дихання з окиснювальним фосфорилуванням створюється колообіг іонів водню (зарядження і розрядження внутрішньої мембрани, що називається протонним циклом). Тому хеміосмотичну концепцію називають ще протонрухливою. Саме цей зворотній потік протонів і служить рушійною силою для синтезу АТФ.
3.5.1. Роль АТФ-синтази в механізмі фосфорилування. Відповідно до хеміосмотичної концепції протони, виведені назовні за рахунок енергії перенесення електронів, знову проникають всередину, в мітохондріальний матрикс. Але внутрішня мембрана непроникна для них за винятком спеціальних ділянок – протонних каналів. У ділянці цих каналів розташовується Н+-АТФ – синтетаза, яка є протонною помпою, що забезпечує перехід іонів Н+ із зони з більшою концентрацією в зону з низькою, що супроводжується виділенням вільної енергії, за рахунок якої синтезується АТФ.
Встановлено, що комплекс Н+-АТФ-синтетаза складається з двох структурних частин: “ніжка гриба” у вигляді білкового циліндра пронизує всю товщину внутрішньої мембрани, один кінець якої взаємодіє з внутрішнім середовищем, а інший виступає в матрикс у вигляді голівки з активним центром і позначається як фактор F1 (рис. 6.10) Toбто Н+ - АТФ-синтетазу можна представити як Fo+F1. Будова, властивості та функція двох частин цього фермента зовсім різні. Молекулярна маса становить 500 000 Да, з них на F1 припадає приблизно 340 000 Да. F0- сильно гідратований білок, який складається з чотирьох поліпептидних ланцюгів. F1 складається з десяти субодиниць – поліпептидних ланцюгів п’яти різних типів. F0 виконує функцію канала в мембрані, через який проходять протони, а F1-фосфорилюючу функцію при синтезі АТФ. Цей спряжений фактор може викликати у відповідних умовах і гідроліз АТФ.
АТФ-синтетазний комплекс функціонує як єдина система, яка перетворює енергію електрохімічного градієнта іонів водню в фосфатний зв’язок молекули АТФ.
АТФ, синтезована у мітохондріях, використовується як хімічне паливо при різних енерговитратах. Тому мітохондріальну АТФ необхідно постачати в цю частину клітини, де вона необхідна. Саме тому необхідний приплив АДФ і донора фосфатної групи в мітохондрії. Вільна дифузія цих метаболітів через внутрішню мембрану мітохондрій неможлива із-за її непроникності для них. Ця проблема вирішується за рахунок існування в ліпідному шарі білкових транспортних систем: транслокази фосфату, яка постачає його в матрикс, і транслокази аденілових нуклеотидів (АДФ- АТФ – транслокази), яка переносить АДФ в мітохондрії, а АТФ - у цитоплазму.
Таким чином, мембранний потенціал визначає фізіологічно необхідний напрямок переміщення АДФ із цитоплазми і перенесення в це саме середовище АТФ.
Важливим моментом є зворотність реакції, яка каталізується АТФ-синтетазним комплексом. При відповідних умовах комплекс F1-F0 може розщеплювати молекулу АТФ і використовувати при цьому отриману енергію для викачування протонів та утворення електрохімічного потенціалу іонів водню.Так, каталізуючи зворотню реакцію розпаду АТФ, Н+-АТФ – синтетаза відкачує протони із внутрішнього простору назовні за рахунок енергії гідролізу АТФ. Протонні АТФази, виділені із мітохондрій тварин, вищих рослин і грибів, хлоропластів і деяких бактеріальних клітин, мають загальний тип будови та один механізм функціонування.
3.5.2. Вільне окиснення. Якщо процес тканинного дихання відокремлений від процесу фосфорилування, то енергія субстратів, які окиснюються перетворюється в тепло. Такий шлях окиснення клітинних субстратів був названий вільним окисненням. Воно необхідне в тих випадках, коли потреба в теплі для організму більша, ніж в АТФ. Наприклад, для підтримання температури тіла при охолодженні теплокровних тварин.
В організмі присутній бурий жир. Фізіологічне призначення цієї тканини – продукція тепла в процесі окиснення тригліцеридів для підтримання необхідної температури тіла. Особливістю мітохондрій цієї тканини є відсутність в них можливості синтезувати АТФ. Внутрішня мембрана мітохондрій бурого жиру має особливі пори, які є проникними для протонів. Іони водню, які продукуються при роботі дихального ланцюга, попадають назад в матрикс не через протонний канал АТФ-азного комплексу, а через ці провідні пори. Енергія окиснення перетворюється в тепло. Бурого жиру багато в новонароджених, з віком його кількість зменшується.
3.6. Регуляція тканинного дихання (дихальний контроль)
Утворення АТФ шляхом окиснювапьного фосфорилування регулюється згідно з енергетичними потребами клітини. Якщо отримана енергія використовується швидко, процеси біологічного окиснення прискорюються і стають більш інтенсивними. Якщо отримана енергія використовується повільно, вони сповільнюються.
Від чого залежить інтенсивність тканниного дихання і швидкість утворення АТФ?
Тканинне дихання, як і будь-який інший процес в клітині, регулюється концентрацією субстратів, які вступають у реакцію (в даному випадку – це АДФ і неорганічний фосфат) та продуктами цієї реакції (АТФ) при перенесенні електронів у дихальному ланцюзі, з припиненням якого синтез АТФ стає неможливим.
Концентрація АТФ в клітині дуже низька. Наприклад, в серці людини знаходиться не більше одного грама АТФ, а для його роботи протягом хвилини при відносному спокої організму необхідна енергія, яка відповідає 40 г АТФ. Це свідчить про те, що синтез АТФ в клітинах серця повинен здійснюватися безперервно.
Відповідно, одна і ця ж молекула АТФ повинна за одну хвилину тисячу разів гідролізуватися і знову регенеруватися.
Залежність тканинного дихання мітохондрій від концентрації АДФ називають дихальним контролем. Інтенсивність дихання регулюється співвідношенням АТФ/АДФ. Чим менше це співівідношення, тим інтенсивніше відбувається дихання, що спричинює синтез АТФ. Швидкість окиснення клітинного палива регулюється з дуже великою точністю.
Таким чином, механізм дихального контролю відрізняється високою чутливістю і точністю. Тому відносні концентрації АТФ і АДФ в тканинах змінюється в вузьких межах. Використання енергії клітиною, тобто частота обертів циклу АТФ-АДФ може змінюватися десятки і тисячі разів.
Date: 2015-07-17; view: 728; Нарушение авторских прав