
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Экстракционные методы
Экстракция (жидкостная экстракция) – процесс извлечения вещества, в частности соединений металлов, из водного раствора в жидкую органическую фазу, не смешивающуюся с водой. Путем реэкстракции извлекают из органической фазы экстрагированный металл в водный раствор. Органическая фаза возвращается в цикл экстракции.
Экстракцией в технологиях утилизации и рекуперации решают следующие задачи: извлечение металла из бедных растворов с отделением его от сопутствующих элементов и получением концентрированного раствора; извлечение органических и неорганических загрязнений; глубокая очистка сточных вод.
Экстракцию проводят в сравнительно простых аппаратах, работающих в непрерывном режиме. Процесс легко автоматизировать. Многократность использования экстрагента повышает экономичность процесса экстракции. Применение экстракции упрощает технологические схемы, позволяет во многих случаях повысить извлечение металлов и комплексность использования сырья.
Для понимания дальнейшего изложения необходимо привести значения некоторых терминов.
Экстрагент – органическое вещество, образующее с извлекаемым металлом комплекс или соль, способные растворяться в органической фазе. Экстрагентами служат органические кислоты, спирты, эфиры, кетоны.
Разбавитель – органическое жидкое вещество, не смешивающееся с водой, служащее растворителем экстрагента. Распространенные разбавители – керосин, ксилол, уайт-спирит и др. Благодаря применению разбавителя можно использовать твердые экстрагенты или улучшить физические характеристики жидких экстрагентов (вязкость, плотность). Разбавитель большей частью химически не взаимодействует с извлекаемым металлом (отсюда часто используемый термин «инертный разбавитель»), но он существенно влияет на показатели экстракции (избирательность, коэффициент распределения и др.).
Высаливатель – неорганическое вещество (обычно электролит), улучшающее показатели экстракции. Добавление в водный раствор высаливателя способствует образованию легко экстрагируемых недиссоциированных молекул или экстрагируемых комплексов.
Экстракт и рафинат – соответственно органическая и водная фазы после экстракции.
Реэкстракт – водная фаза, полученная после реэкстракции, т. е. извлечения металла из экстракта в водный раствор.
Экстрагент должен обладать хорошей экстракционной способностью, т. е. высокой степенью извлечения металла и селективностью по отношению к извлекаемому металлу. При этом он должен иметь низкую растворимость в воде, водных растворах кислот и щелочей (высокая растворимость ведет к значительным потерям экстрагента). Важным условием является легкость регенерации экстрагента с возвращением его в цикл экстракции и устойчивость его в водных растворах (экстрагент не должен гидролизовать, окисляться или восстанавливаться компонентами раствора).
Для лучшего разделения фаз после их перемешивания необходимо, чтобы экстрагент (если его используют без разбавителя) имел низкую вязкость и отличался от водной фазы по плотности. В целях безопасности экстрагент должен быть относительно малолетучим, нетоксичным, не склонным к воспламенению.
Разбавители применяют для уменьшения плотности и вязкости экстрагента, снижения его потерь. Естественно, что они должны обладать низкой плотностью и вязкостью. Обязательные дополнительные условия – низкая стоимость разбавителя и безопасность работы с ним в отношении воспламеняемости и токсических свойств.
Чаще всего в качестве разбавителя применяют керосин (лучше гидрированный керосин). В случае экстракции аминами разбавителем обычно служит смесь керосина с дециловым или октиловым спиртом. Иногда в качестве разбавителей используют дибутиловый эфир триэтиленгликоля, диизопропиловый эфир, полиалкил-бензолы и др.
Основные количественные характеристики экстракционного процесса:
коэффициент распределения элемента D;
константа распределения соединения Kd,;
коэффициент разделения (или фактор разделения) р;
степень извлечения E.
Коэффициент распределения D – отношение концентраций элемента в органической и водной фазах при установлении состояния равновесия
 ,
,
где С1, С2,….Сi – концентрации элемента в различных его химических формах в органической и водной фазах.
В частном случае, когда в органической и водной фазах соединение экстрагируемого элемента имеет одинаковый состав, выражение упрощается
 .
.
Таким образом, Kd – частный случай D; Kd выражает известный закон распределения Нернста.
Коэффициент разделения b – отношение коэффициентов распределения двух разделяемых металлов: b=D1/D2. Практически применяют экстракционные системы с b>2.
Степень извлечения Е – процент извлечения вещества в органическую фазу от общего его количества в обеих фазах.
При одинаковых объемах водной и органической фаз
 .
.
При неодинаковых объемах водной Vводн и органической Vорг фаз
 .
.
Классификация экстрагентов. В водных растворах ионы гидратированы и прочно удерживаются в водной фазе. Их извлечение в органическую фазу происходит лишь в том случае, если процесс сопровождается убылью энергии Гиббса экстракционной системы.
Это условие может быть выполнено при использовании в качестве экстрагентов органических соединений. Соответствующие этому условию органические вещества можно подразделить на две группы.
К первой группе относятся нейтральные экстрагенты – органические вещества, молекулы которых способны к образованию координационных связей (донорно-акцепторного типа) с извлекаемым ионом, более прочных, чем связи его с молекулами воды (т. е. энергия сольватации молекулами экстрагента превышает энергию гидратации).
Ко второй группе относятся органические кислоты и их соли или органические основания и их соли, способные при контакте с водным раствором к обмену неорганического катиона или аниона, входящего в состав экстрагента, на одноименный ион, находящийся в растворе. В этом случае условием протекания экстракции является более высокая энергия гидратации ионов, переходящих из органической фазы в водную фазу, по сравнению с извлекаемыми из водного раствора ионами. Экстрагенты этой группы называют жидкими ионообменниками. Их подразделяют на катионо- и анионообменные в зависимости от вида обмениваемых ионов. Экстракционные процессы можно разделить на три основные группы:
1. Экстракция нейтральными экстрагентами.
2. Анионообменная экстракция.
3. Катионообменная экстракция.
Кроме того, следует упомянуть сравнительно редкие случаи, когда экстракция не сопровождается химическим взаимодействием и ее можно рассматривать как случай простого физического распределения. Так экстрагируются симметричные ковалентные молекулы, растворимость которых в органическом растворителе (например, в керосине) обычно на порядок выше, чем в воде. К этому типу примыкает также экстракция слабых кислот, если их диссоциация полностью подавлена в присутствии сильной кислоты. Так, например, в присутствии минеральной кислоты нейтральная молекула уксусной кислоты СНзСООН мало гидратирована и экстрагируется по типу простого физического распределения.
Если коэффициенты распределения D велики, то в принципе можно осуществить полное извлечение металла за одну или две периодические экстракции.
При многократной периодической экстракции, зная величину D, можно найти оптимальное число операций экстракции и объема экстрагента в каждой из них для достижения оптимального извлечения.
Примем D = Cорг/Cводн = const.
По балансу после одной операции
 ,
,
где Vорг и Vводн – объемы органической и водной фаз при каждой экстракции;  и
и 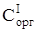 – концентрации после одной операции;
– концентрации после одной операции;  – исходная концентрация извлекаемого иона в водном растворе.
– исходная концентрация извлекаемого иона в водном растворе.
Так как 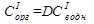 , то
, то
 ,
,
или
 ;
;
 .
.
Аналогично после двух экстракций
 .
.
После n операций
 .
.
Анализ этого уравнения показывает, что при данном суммарном количестве экстрагента (nVорг) наименьшая концентрация  достигается при большом n и малом Vорг (т. е. при многоступенчатой экстракции малыми порциями экстрагента).
достигается при большом n и малом Vорг (т. е. при многоступенчатой экстракции малыми порциями экстрагента).
Мембранные методы
В настоящее время начинается процесс перестройки энергетики, химической, нефтеперерабатывающей и пищевой промышленности на основе мембранной технологии как наиболее экологически целесообразной. Одним из ее главных методов является электродиализ с ионитовыми мембранами. Этот метод основан на возникновении разности химического потенциала в системе ионитовые мембраны – раствор при наложении на нее градиента электрического потенциала. Область применения электродиализа постоянно расширяется. Его используют для очистки неэлектролитов от электролитов, разделения смесей электролитов, для получения ультрачистой воды в электронной промышленности. Важным моментом в развитии электродиализа стало применение его для деминерализации солоноватых вод. Перспективными сферами применения электродиализа могут стать проводимые с его помощью реакции, позволяющие из солей получать кислоты и основания, растворять малорастворимые соединения. Особенно важным в электродиализе является возможность его проведения без применения химических реагентов, что приводит к отсутствию приращения массы веществ в сточных водах при обработке их данным методом. Извлекаемые при этом примеси вновь возвращаются в технологические циклы (используемый для решения аналогичных задач ионный обмен приводит к многократному приращению массы веществ в сточных водах).
Экологическая направленность электродиализа обусловлена возможностью рекуперировать и утилизировать данным методом разнообразные промышленные отходы, организовывать замкнутые циклы по воде и извлекаемым компонентам, включать его в технологические цепочки многих производств. С этой целью электродиализ успешно применяется для извлечения меди из отходов производства, очистки молочной сыворотки в пищевой промышленности, удаления солей из биологически активных веществ (например, аминокислот), извлечения тяжелых металлов из сточных вод гальванических производств. В атомной промышленности мембранные методы используют для получения сверхчистой воды и переработки радиоактивных отходов, в теплоэнергетике – для рекуперации воды. Отличительной особенностью всех мембранных методов, заимствовавших у природы самый совершенный механизм разделения, является их универсальность и возможность защитить окружающую среду от загрязнения.
Мембраны можно разделить на три вида: естественные, искусственные и синтетические. Естественные мембраны из животного пузыря, яичного белка, пергамента, агар-агара, а также из природных неорганических материалов (шлифованных цеолитов, обожженной глины) использовались на ранней стадии развития диализа и электродиализа. Шагом вперед стало изготовление искусственных мембран, среди которых наибольшее распространение получили мембраны на основе целлюлозы (коллодиевые и целлофановые). Синтетические ионитовые мембраны были впервые получены в 1950-м году. На их основе стали развиваться электромембранные методы. Ионитовые мембраны различают по функциям и числу фаз. По функциям они делятся на катионитовые (КМ), анионитовые (АМ), биполярные (БМ) и со специфической проницаемостью. По числу фаз мембраны можно разделить на однофазные (гомогенные), двухфазные (гетерогенные) и трехфазные (биполярные гетерогенные мембраны).
Биполярные мембраны предоставляют широкие возможности для создания новых электромембранных процессов. Самым многообещающим свойством биполярных мембран является способность генерировать ионы водорода и гидроксила на биполярных границах. Использование этой функции позволяет получать кислоты и основания из солей, разделять и очищать газы, разделять разнозарядные ионы. Аппараты с биполярными мембранами могут быть использованы в процессах водоподготовки, электрохимического синтеза неорганических и органических кислот и щелочей из их солей. Широкое применение ионного обмена как метода очистки природных вод приводит к необходимости использования для регенерации смол больших количеств кислот и оснований.

Рис. 4. Схема электродиализа раствора Na2SO4 в четырехкамерной ячейке с ионитовыми мембранами
При нейтрализации кислых и щелочных стоков после ионного обмена образуются сточные воды с высоким солесодержанием. Применение электродиализа с биполярными мембранами позволяет решить задачу утилизации этих стоков, получить из них кислоты и основания, пригодные для повторного использования. Подобная задача может возникнуть при переработке шахтных вод, сточных вод заводов минеральных удобрений, морской воды.
Основной процесс, в котором нашли применение биполярные мембраны – это конверсия солей в кислоты и основания. Схема электродиализатора для получения серной кислоты и гидроокиси натрия из сульфата натрия с применением биполярной мембраны представлена на рис. 4. Число биполярных мембран в промышленных аппаратах может быть увеличено.
Рассмотрим процессы, протекающие в элементарной ячейке МК–МБ–МА. При наложении на систему градиента электрического потенциала на границе раздела между катионитовой и анионитовой частями биполярной мембраны происходит глубокое обессоливание и разложение воды. Эта граница становится непрерывным генератором водородных и гидроксильных ионов при ориентации катионитовой части по направлению к катоду.
Гидроксильные ионы мигрируют от границы контакта катионитовой и анионитовой частей мембраны в раствор, откуда в дальнейшем их движение ограничивается практически непроницаемой для них катионитовой мембраной, разделяющей секции 3 и 4. Из раствора секции 3 через катионитовую мембрану, разделяющую секции 3 и 4, по направлению к катоду мигрируют ионы натрия. В секции 4 они образуют с накапливаемыми там гидроксильными ионами гидроксид натрия.
Водородные ионы, образующиеся на внутренней границе биполярной мембраны, мигрируют через катионитовую часть по направлению к катоду в раствор секции 2, из которой дальнейшая их миграция ограничена анионитовой мембраной, разделяющей секции 1 и 2. В секции 2 и 3 непрерывно подается раствор сульфата натрия. Анионы сульфата мигрируют из раствора секции 2 через анионитовую мембрану, разделяющую секции 1 и 2, в раствор секции 1, где образуют с накапливаемыми в ней водородными ионами серную кислоту. В приэлектродных секциях также происходит конверсия соли в кислоту и основание за счет переноса ионов и электродных процессов.
Дистилляция
Дистилляцией называют процесс разделения жидких смесей на отличающиеся по составу фракции путем частичного испарения жидкости и последующей конденсации пара. Метод основан на различии в составах жидкости и образующегося из нее пара.
Отогнанная фракция (дистиллят) обогащена относительно более летучим (низкокипящим) компонентом. Неотогнанная жидкость (кубовый остаток) обогащается менее летучим (высококипящим) компонентом. Если из исходной смеси отгоняется не одна фракция, а несколько, то дистилляцию называют фракционной (дробной). В зависимости от условий процесса различают простую и молекулярную дистилляцию. Простая дистилляция проводится при таких значениях давления, при которых длина свободного пробега молекул во много раз меньше, чем расстояние между поверхностями испарения жидкости и конденсации пара. Температура процесса при данном давлении определяется условиями фазового равновесия между жидкостью и паром. При необходимости снижения температуры применяют перегонку под вакуумом, а также с водяным паром или инертным газом.
Распределение компонентов смеси между жидкостью и паром характеризуется коэффициентом летучести
 ,
,
где xi и xk, yi и yk – содержания компонентов i и k соответственно в жидкости и в образующемся из нее паре. Состав пара определяется свойствами и межмолекулярным взаимодействием компонентов.
Дистилляция осуществляется периодически или путем непрерывной подачи исходной смеси и отбора продуктов разделения (дистиллята и кубового остатка). Аппараты, применяемые для дистилляции, делят на ёмкостные и пленочные. В емкостных аппаратах при непрерывном режиме дистилляции достигается меньшая степень разделения, чем при периодическом режиме.
В пленочных аппаратах жидкость распределяется по поверхности нагрева в виде пленки. По способу ее образования различают следующие виды аппаратов:
а) аппараты с жидкостью, свободно стекающей по обогреваемой поверхности (например, по поверхности труб);
б) аппараты с восходящим движением жидкости за счет трения на границе между жидкостью и паром, движущимся снизу вверх с большой скоростью;
в) роторные аппараты с жидкостью, разливаемой по поверхности обогреваемого корпуса при вращении ротора с подвижными или неподвижными лопастями. Состав жидкости в пленочных аппаратах изменяется по высоте. На выходе из аппарата он приближается к равновесному составу по отношению к исходной смеси. Эта смесь имеет наибольшее содержание низкокипящих компонентов. Иными словами достигается дополнительное по сравнению с простой дистилляцией разделение смеси.
Пример. При tc смесь (рис.5) распадается на пар «b» состава xп и жидкость «c» состава xж (x – доля второго компонента). Если суммарное количество смеси равно 100, то после распада образуется m долей xп пара и (1 – m) долей xж жидкости.
Отсюда
x0 = mxп + (1-m)xж = mxп + xж – mxж = m(xп – xж) + xж.
Преобразуя
x0 – xж = m(xп – xж), m = (x0 – xж)/(xп – xж) и (1 – m) =(xп – x0)/(xп – xж),
получаем отношение масс компонентов смеси:
m/(1 – m) = (x0 – xж)/(xп – x0).
Как видим, этим же уравнением выражается равновесие рычага «bc» с точкой опоры в «с» с массами на концах m и (1 – m).

Рис. 5. Диаграмма «температура кипения – состав» системы ацетон – бензол
Date: 2016-07-25; view: 787; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |