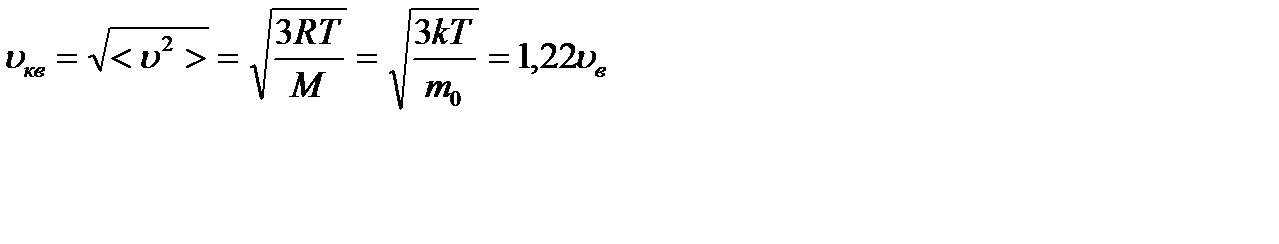Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Колденен жане бойлык толкындар. Кума толкын теңдеуи
|
|
| Тұтас ортадағы тербелістің таралу процесі толқын деп аталады. Серпімді орталарда таралатын тебелістер серпімді немесе механикалық толқындар деп аталады. Егер толқынның таралуы кезінде орта бөлшектері гармониялық тербелісте болса, онда толқын гармониялық деп аталады. Толқындар көлденең және бойлық болып бөлінеді. Көлденең толқында орта бөлшектері толқынның таралу бағытына перпендикуляр бағытта, бойлық толқында – таралу бағыты бойында тербеледі.3.9-суретте х өсі бойымен таралған көлденең толқынның пайда болуы мен таралуы көрсетілген. Әр қатарда бірнеше бөлшектің берілген уақыттағы орындары бейнеленген. Орта бөлшектері тепе-теңдік нүктесінің маңайында жоғары-төмен тербеледі. Бөлшектер толқынның таралу бағытындағы келесі бөлшектерге тербелмелі қозғалыс энергиясын тасымалдайды, бірақ өздері алға қарай орын ауыстырмайды. Барлық толқындардың негізгі ерекшелігі – толқындық процесте зат тасымалданбайды, энергия тасымалданады. | 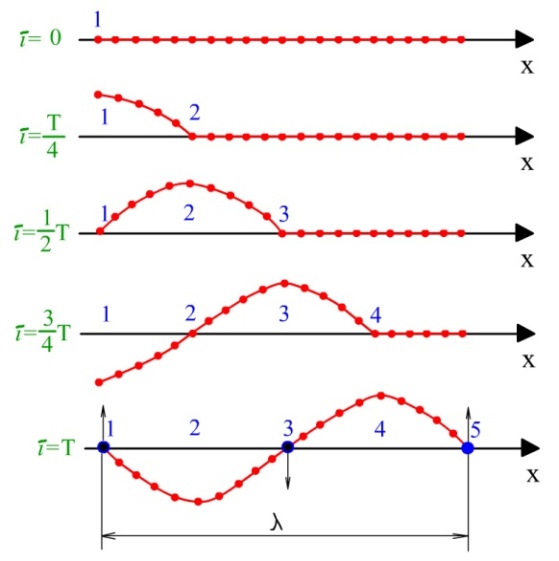 Көлденең толқын
Көлденең толқын
|
Бірдей фазада тербелетін ең жақын нүктенің ара қашықтығы толқын ұзындығы  деп аталады. Бұл шама толқынның тербеліс Т периоды мен жылдамдығының көбейтіндісіне тең:
деп аталады. Бұл шама толқынның тербеліс Т периоды мен жылдамдығының көбейтіндісіне тең:
 . Мұндағы:
. Мұндағы: 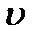 – толқынның таралу жылдамдығы;
– толқынның таралу жылдамдығы;  – тербеліс жиілігі.
– тербеліс жиілігі.
Қума толқын

| |||||||
Орта нүктелерінің тербеліс амплитудалары  бірдей бірдей
| |||||||
Тербеліс фазасы  қарастырылып отырған нүктенің қарастырылып отырған нүктенің  координатасына тәуелді координатасына тәуелді
| |||||||
Тербелмелі қозғалыс энергиясы толқынның таралу бағытында тасымалданады.
22)Термодинамикалық жүйелер және олардың параметрлері: қысым, температура, көлем.
Термодинамикада тепе-теңдіктегі макроскопиялық жүйелердің жалпы қасиеттері мен олардың бір термодинамикалық күйден екінші күйге ауысу процестері зерттеледі.
Термодинамикалық жүйе деп бір-бірімен және сыртқы денелермен зат пен энергия алмасушы дараланған макроскопиялық денелер жүйесін айтады. Жүйенің күйін сипаттау үшін жүйенің термодинамикалық параметрлері (күй параметрлері) деп аталатын физикалық шамалар енгізілген. Оларға р – қысым,  – көлем, Т – температура, п – концентрация және т.б. жатады.
Қысым р – дененің бірлік бетіне нормаль бойымен әсер ететін күшке тең шама – көлем, Т – температура, п – концентрация және т.б. жатады.
Қысым р – дененің бірлік бетіне нормаль бойымен әсер ететін күшке тең шама  Өлшем бірлігі – Па (Паскаль) ( Өлшем бірлігі – Па (Паскаль) ( ).
Жүйенің температурасы – оның бөлшектерінің жылулық қозғалыс қарқынының өлшемі. Физикада бірнеше температуралық шкала қолданылады. Мысалы, Кельвин ( ).
Жүйенің температурасы – оның бөлшектерінің жылулық қозғалыс қарқынының өлшемі. Физикада бірнеше температуралық шкала қолданылады. Мысалы, Кельвин (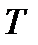 ) және Цельсий ( ) және Цельсий (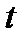 ) шкалаларындағы температуралар өзара
T = t + 273,15
өрнегімен байланысқан.
Қалыпты күйде термодинамикалық параметрлер келесі мәндерге тең болады:
p =1,013· 105 Па, VM =22,4· 10-3 м3, T =273,15 K.
Термодинамикалық процесс деп жүйенің кез - келген параметрінің өзгерісін айтады.
23)Клапейрон-Менделеев теңдеуі. Мольдік масса, зат мөлшері.
Идеал газдың күй теңдеуі – термодинамикалық параметрлер арасындағы функционалдық байланыс: ) шкалаларындағы температуралар өзара
T = t + 273,15
өрнегімен байланысқан.
Қалыпты күйде термодинамикалық параметрлер келесі мәндерге тең болады:
p =1,013· 105 Па, VM =22,4· 10-3 м3, T =273,15 K.
Термодинамикалық процесс деп жүйенің кез - келген параметрінің өзгерісін айтады.
23)Клапейрон-Менделеев теңдеуі. Мольдік масса, зат мөлшері.
Идеал газдың күй теңдеуі – термодинамикалық параметрлер арасындағы функционалдық байланыс: 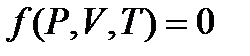 . Көптеген тәжірибе нәтижелерін қорыта отырып, Менделеев (1874), бір моль идеал газ үшін келесі теңдеуді анықтады: . Көптеген тәжірибе нәтижелерін қорыта отырып, Менделеев (1874), бір моль идеал газ үшін келесі теңдеуді анықтады:
 . .
 –газдың молярлық көлемі; –газдың молярлық көлемі;  – универсал газ тұрақтысы – универсал газ тұрақтысы 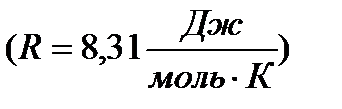 Массасы Массасы  , көлемі , көлемі 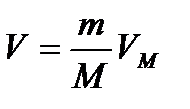 идеал газдың күй теңдеуі: идеал газдың күй теңдеуі:
 .
Бұл Менделеев – Клапейрон теңдеуі. Клайперон теңдеуін тағы бір түрде жазуға болады: .
Бұл Менделеев – Клапейрон теңдеуі. Клайперон теңдеуін тағы бір түрде жазуға болады:  немесе немесе
 . .
 – мөлшері 1 моль заттағы молекулалар санына тең Авогадро саны, – мөлшері 1 моль заттағы молекулалар санына тең Авогадро саны, 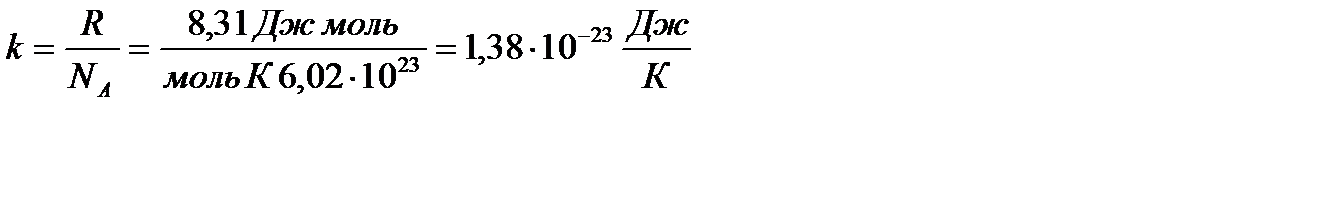 – Больцман тұрақтысы, – Больцман тұрақтысы,  – молекулалар концентрациясы (бірлік көлемдегі газ бөлшектерінің саны). Тұрақты температурада газ қысымы молекулалардың концентрациясына пропорционал болады.
Заттың мольдің массасы - бір мольдің мөлшерінде алынған заттың массасы. – молекулалар концентрациясы (бірлік көлемдегі газ бөлшектерінің саны). Тұрақты температурада газ қысымы молекулалардың концентрациясына пропорционал болады.
Заттың мольдің массасы - бір мольдің мөлшерінде алынған заттың массасы. 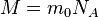 Заттың мольдік массасы заттың салыстырмалық молекулалық массасымен кг/моль қатынасы арқылы байланысқан. Заттың кез келген мөлшерінің массасын былай анықтауға болады: Заттың мольдік массасы заттың салыстырмалық молекулалық массасымен кг/моль қатынасы арқылы байланысқан. Заттың кез келген мөлшерінің массасын былай анықтауға болады:  Затта канша молекула бар,молекулаларда қанша атом болатынн білу үшін моль ұғымы қолданлады. Моль - зат мөлшерінің өлшемі, ол v әрпімен белгіленеді. NA=6,02-1023 моль-1.Кез келген заттың 1 молінде Авогадро санындай құрылымдық бірліктер (атом, молекула) болады. Олай болса «моль» дегеніміз Авогадро санындай құрылымдык бірлігі бар зат мөлшері.
24)Идеал газдың молекула-кинетикалық теориясының(МКТ)негізгі теңдеуі. Газ молекулаларының орташа квадраттық жылдамдығы.
Үздіксіз бейберекет ретсіз қозғалыстағы газ молекулаларының өзара және ыдыс қабырғасымен соқтығысуы абсолют серпімді болады. Молекулалардың соқтығысулары арқылы олардың арасында жылдамдық пен энергия алмасулары жүреді. Молекулалардың қабырғамен соқтығысуынан газ қысымы пайда болады.
Идеал газ үшін молекула-кинетикалық теорияның негізгі теңдеуі жүйенің тәжірибеде өлшенетін р макроскопиялық параметрі мен бөлшектің микроскопиялық параметрін байланыстырады (
Затта канша молекула бар,молекулаларда қанша атом болатынн білу үшін моль ұғымы қолданлады. Моль - зат мөлшерінің өлшемі, ол v әрпімен белгіленеді. NA=6,02-1023 моль-1.Кез келген заттың 1 молінде Авогадро санындай құрылымдық бірліктер (атом, молекула) болады. Олай болса «моль» дегеніміз Авогадро санындай құрылымдык бірлігі бар зат мөлшері.
24)Идеал газдың молекула-кинетикалық теориясының(МКТ)негізгі теңдеуі. Газ молекулаларының орташа квадраттық жылдамдығы.
Үздіксіз бейберекет ретсіз қозғалыстағы газ молекулаларының өзара және ыдыс қабырғасымен соқтығысуы абсолют серпімді болады. Молекулалардың соқтығысулары арқылы олардың арасында жылдамдық пен энергия алмасулары жүреді. Молекулалардың қабырғамен соқтығысуынан газ қысымы пайда болады.
Идеал газ үшін молекула-кинетикалық теорияның негізгі теңдеуі жүйенің тәжірибеде өлшенетін р макроскопиялық параметрі мен бөлшектің микроскопиялық параметрін байланыстырады ( ): ):
 , ,  .
мұндағы .
мұндағы  –молекула массы, п –молекулалар концентрациясы; –молекула массы, п –молекулалар концентрациясы;  – газ молекулаларының ілгерілемелі қозғалысының орташа квадраттық жылдамдығы. – газ молекулаларының ілгерілемелі қозғалысының орташа квадраттық жылдамдығы.
 Орташа квадраттық жылдамдығы:
Орташа квадраттық жылдамдығы:
 .
25)Газ молекулаларының жылдамдықтар бойынша үлестірілу заңы(Максвелл заңы). Газ молекулалары- ның жылдамдықтар бойынша үлестірілу функциясы және оның графигі. Газ молекулаларының ең ық- тимал, орташа квадраттық және орташа арифметикалық жылдамдықтары.
Газ молекулалары ретсіз қозғалып, бір-бірімен үздіксіз соқтығыста болатындықтан, молекулалардың жылдамдықтары да әртүрлі болып, олар жылдамдық бойынша қандай да бір заңдылық бойынша таралады. Молекулалардың қозғалысына ретсіздік, ал олардың соқтығысуларына ықтималдылық тән болатынына қарамастан, теория мен тәжірибе олардың жылдамдықтар бойынша таралуы бір ғана мүмкін заңдылық бойынша бірмәнді анықталатынын көрсетті. Ықтималдылық теориясын қолдана отырып, 1860 жылы Максвелл идеал газ молекулаларының жылдамдықтар бойынша таралу заңын анықтады: .
25)Газ молекулаларының жылдамдықтар бойынша үлестірілу заңы(Максвелл заңы). Газ молекулалары- ның жылдамдықтар бойынша үлестірілу функциясы және оның графигі. Газ молекулаларының ең ық- тимал, орташа квадраттық және орташа арифметикалық жылдамдықтары.
Газ молекулалары ретсіз қозғалып, бір-бірімен үздіксіз соқтығыста болатындықтан, молекулалардың жылдамдықтары да әртүрлі болып, олар жылдамдық бойынша қандай да бір заңдылық бойынша таралады. Молекулалардың қозғалысына ретсіздік, ал олардың соқтығысуларына ықтималдылық тән болатынына қарамастан, теория мен тәжірибе олардың жылдамдықтар бойынша таралуы бір ғана мүмкін заңдылық бойынша бірмәнді анықталатынын көрсетті. Ықтималдылық теориясын қолдана отырып, 1860 жылы Максвелл идеал газ молекулаларының жылдамдықтар бойынша таралу заңын анықтады:
   мұндағы
мұндағы - таралу функциясы .
Функцияның нақты түрі газ тегіне (молекула массасы - таралу функциясы .
Функцияның нақты түрі газ тегіне (молекула массасы  ) және оның температурасына байланысты. Қысым мен көлем молекулалардың жылдамдықтар бойынша таралуына әсер етпейді. Максвелл таралуы
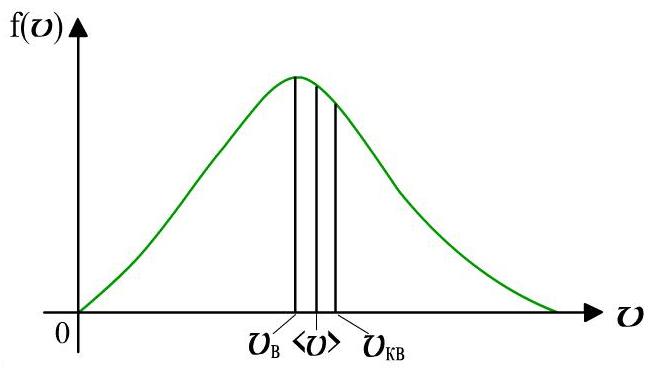
Таралу функциясы максимум болатын жылдамдық ең ықтимал жылдамдық ) және оның температурасына байланысты. Қысым мен көлем молекулалардың жылдамдықтар бойынша таралуына әсер етпейді. Максвелл таралуы
Таралу функциясы максимум болатын жылдамдық ең ықтимал жылдамдық
 деп аталады. деп аталады.
|
Date: 2016-07-22; view: 9494; Нарушение авторских прав