
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Эфирные масла при длительном воздействии малых радиационных доз
|
|
Работа выполнена на мышах-самцах гибридов FL(CBA×C57BL6) массой 16—18 г. Животных содержали в условиях вивария при смешанном освещении на стандартной диете.
Гуморальный иммунный ответ оценивали по числу антителообразующих клеток в селезенке на 5-е сутки после иммунизации. Использовали метод локального гемолиза в геле агарозы (Ерне и Нордин). Учитывали число АОК на всю селезенку и на 106 спленоцитов. В качестве антигена использовали тимусзависимый антиген — эритроциты барана в оптимальной дозе (2-108 клеток на мышь). Антиген вводили внутривенно в 0,5 мл среды 199.
Облучение экспериментальных животных выполняли на аппарате РУМ-17. Источник излучения Со-60, фокусное расстояние — 15 см, фильтры — Аl и Сu. Мощность облучения — 108 R в 1 мин.
При анализе радиопротекторного действия РАВ их ингалировали животным, помещенным в замкнутое пространство. Время ингаляции — 20 мин. С помощью ароматизатора-дозатора создавали заданную концентрацию 0,2; 0,4; 0,6 мг/м3. В качестве РАВ использовали композицию (лаванда, пихта, мята, базилик, жасмин).
Условия эксперимента: реакция гуморального иммунного ответа на дозированное внешнее облучение в малых дозах; динамика силы иммунного ответа у мышей, перенесших облучение в дозе 0,2 Гр; радиопротекторный эффект РАВ при дозированном хроническом облучении в малых дозах.
На первом этапе исследования была выявлена зависимость силы иммунного ответа от дозы облучения. При этом исследовали реакцию гуморального компонента иммунного ответа на дозированное внешнее облучение в малых дозах. В качестве контрольных животных были использованы интактные мыши, ибо манипуляции, связанные с облучением (подсадка мышей в контейнеры и пр.), существенно не влияли на иммунный ответ (табл. 14).
Оказалось, что однократное внешнее облучение в малых дозах способно изменить иммунный ответ (табл. 15).
Облучение в дозах 0,4 и 0,6 Гр приводило к супрессии иммунного ответа, а облучение в дозе 0,2 Гр не сопровождалось ограничением накопления АОК. Однако последующие исследования показали, что облучение, даже однократное в допустимой дозе аварийного обслуживания, сопровождается угнетением антителообразования в динамике пострадиационного периода (табл. 16).
Таблица 14. Гуморальный иммунный ответ на эритроциты барана ннтактных мышей и мышей, подвергнутых ложному облучению
| Группа животных | Число опытов (и мышей) | Количество АОК | |
| на селезенку | на 106 спленоцитов | ||
| Интактные | 2(11) | 46 282 | |
| Ложнооблученные | 2(10) | 48 183 |
Таблица 15. Реакция гуморального компонента иммунного ответа на однократное дозированное внешнее облучение в малых дозах
| Группа животных | Число опытов (и мышей) | Количество АОК | |
| на селезенку | на 106 спленоцитов | ||
| Интактные | 2(13) | 36 303 | |
| Доза 0,2 Гр | 2(12) | 33 164 | |
| Доза 0,4 Гр | 2(12) | 22 676 | |
| Доза 0,6 Гр | 2(11) | 23 288 |
Таблица 16. Динамика силы иммунного ответа у животных, перенесших внешнее равномерное облучение в дозе 0,2 Гр
| Сутки послеоблучения | Группа животных | Число опытов(и мышей) | Количество АОК | |
| на селезенку | на 106 спленоцитов | |||
| Контроль Опыт | 2(11) 2(12) | 33 474 29 922 | 99 130 | |
| Контроль Опыт | 2(10) 2(10) | 25 276 11 053 | 51 29 | |
| Контроль Опыт | 2(11) 2(10) | 19 520 41 114 | 104 308 |
Супрессия гуморального иммунного ответа после однократного внешнего облучения в дозе 0,2 Гр была зарегистрирована на 4-е сутки пострадиационного периода.
На втором этапе исследования животных ежедневно подвергали воздействию ионизирующего излучения в течение 20 дней до суммарной дозы, равной эффективной допустимой дозе аварийного обслуживания человека, способной, судя по представленным выше данным, обусловить развитие иммунодепрессии (0,2 Гр), отчетливо регистрируемой на 4-е сутки пострадиационного периода. Мышей опытной группы перед облучением ингалировали композицией в течение 20 мин в заданных концентрациях. В качестве контроля использовали животных, получивших только ингаляцию. Иммунизацию проводили по схеме на 7-е, 15-е и 21-е сутки. Опыт дублирован. В использованных группах мышей число животных колебалось от 10 до 14.
Хроническое дозированное облучение в течение 20 дней до суммарной дозы, равной эффективной допустимой дозе аварийного обслуживания человека, сопровождалось иной динамикой модуляции функции иммунной системы по сравнению с таковой при однократном облучении в равной дозе (0,2 Гр).
Супрессия антителообразования в ответ на антигенную стимуляцию эритроцитами барана при хроническом дозированном облучении регистрировалась в тот период, когда при остром однократном облучении наблюдается стимуляция гуморального иммунного ответа, в частности на 7—8-е сутки. Очевидно, репаративные процессы в иммунной системе при хроническом дозированном облучении, имеющие клеточную природу, оказывались существенно подавленными. Ингаляция композицией РАВ в дозах 0,4 и 0,6 мг/м3 способна обеспечить иммунопротективный эффект, возможно, через стимуляцию репаративных процессов. В селезенке мышей, получавших ингаляции, накапливалось достоверно большое АОК по сравнению с их числом у мышей, подвергнутых только облучению. На 15-е сутки хронического дозированного облучения различия не столь демонстративны.
В основе феномена стимуляции антителогенеза при дозированном хроническом равномерном облучении, регистрируемого по числу АОК на миллион спленоцитов на 15-е сутки облучения, лежит, возможно, не только стимуляция репаративных процессов, например усиленная миграция стволовых кроветворных клеток в органы иммуногенеза из костного мозга, но и угнетение Т-супрессоров. Следовательно, есть основание предположить, что ингаляции могут реализовать свой иммунопротективный эффект не только на уровне стволовой кроветворной клетки, но и на уровне регуляторных популяций Т-лимфоцитов, снимая, например, ограничение функции Т-лимфоцитов-супрессоров. С достоверностью можно только сказать, что ежедневные ингаляции композицией в дозах 0,4—0,6 мг/м3 в течение 7 дней до иммунизации и 5 дней после иммунизации способны обеспечить иммунопротективный эффект при хроническом равномерном дозированном облучении малыми дозами, не превышающими суммарной дозы 0,12 Гр.
Эфирные масла и резервные возможности костного мозга животных при хроническом радиационном облучении. В работе использованы самцы мышей гибридов FL(CBA×C57BL6) 3-месячного возраста. Хроническое радиационное облучение в малых дозах воспроизводили на аппарате РУМ-17 ежедневно в дозе 0,2 Гр в течение 25 дней. Все животные были разделены на три группы: 1-я группа — интактные мыши, 2-я группа — контрольные (подвергнуты только облучению), 3-я группа — опытные (получавшие сразу после облучения ингаляции РАВ). Ингаляции проводили в течение 20 мин вгерметически замкнутом объеме. Использовали природную концентрацию РАВ — 0,2 мг/м3. В качестве ароматического вещества применяли масло лаванды. Из каждой группы для исследования брали по 5 мышей.
Исследовали периферическую кровь. Каждые 5-е сутки учитывали число лейкоцитов, эритроцитов, подсчитывали лейкоцитарную формулу. Кровь забирали при декапитации.
Прежде всего следует отметить, что не только однократное внешнее облучение в допустимой дозе аварийного обслуживания (0,2 Гр) сопровождается модуляцией гуморального иммунного ответа в динамике пострадиационного периода: в первые 4 сут регистрируется его снижение, а на 8-е сутки — повышение. Ежедневные воздействия ионизирующим излучением до суммарной дозы, которая в 3 раза меньше 0,2 Гр, ограничивают регенеративную способность костного мозга как источника иммунокомпетентных клеток и иммуногенез (табл. 17).
Таблица 17. Гуморальный иммунный ответ на эритроциты барана у мышей, перенесших хроническое дозированное равномерное облучение в суммарной дозе 0,07 Гр
| Период исследования (сутки) | Группа животных | Число опытов (и мышей) | Количество АОК | |
| на селезенку | на 106 спленоцитов | |||
| 7—8-е | Контроль Опыт | 2(12) 2(11) | 18 067 7600 | 129 60 |
С учетом приведенных данных не вызывает сомнений, что использование в дальнейших исследованиях хронического дозированного равномерного облучения малыми дозами (в частности, ежедневное облучение в дозе 0,2 Гр) в течение 25 дней можно рассматривать в качестве модели хронической лучевой болезни. Гематологически она проявляется постепенно развивающейся лейкопенией, эритроцитозом, абсолютной лимфопенией (табл. 18) и ограничением резервных возможностей костномозгового кроветворения, например в условиях повышенной нагрузки на эритропоэз, индуцированной гипоксической гипоксией (табл. 19).
РАВ в природных концентрациях заметно «снимают» отмеченные патологические сдвиги, что наиболее отчетливо проявляется с 20-х суток наблюдения (табл. 20). На 25-е сутки показатели крови мышей опытной группы практически не отличаются от таковых интактных мышей.
Эффект РАВ реализуется на уровне костного мозга, ибо резервные возможности его у этой группы мышей сохраняются, о чем свидетельствует усиление эритропоэза в ответ на гипоксическую гипоксию. В контрольной группе количество эритроцитов в периферической крови животных после гипоксии не изменяется, в то время как в опытной группе регистрируется достоверное увеличение числа эритроцитов (табл. 21).
Таблица 18. Показатели клеточного состава периферической крови мышей при хронической лучевой болезни
| Сутки от начала облучения | Группа животных | Показатели крови | ||
| лейкоциты, 109/л | эритроциты, 1012/л | лимфоциты, 109/л | ||
| 5-е | Интактные Контрольные | 6,05 6,5 | 3,9 3,6 | 3,33 3,57 |
| 10-е | Интактные Контрольные | 9,3 7,2 | 4,7 5,3 | 5,3 3,8 |
| 15-е | Интактные Контрольные | 6,1 6,2 | 4,4 7,5 | 3,2 3,2 |
| 20-е | Интактные Контрольные | 7,0 3,5 | 2,9 5,3 | 3,9 1,9 |
| 25-е | Интактные Контрольные | 5,3 2,8 | 3,4 6,9 | 3,8 1,7 |
Таблица 19. Количество эритроцитов в периферической крови мышей интактной и контрольной групп, перенесших гипоксическую гипоксию
| Период исследования | Группа животных | Количество эритроцитов, 1012/л |
| Исходный | Интактные Контрольные | 3,9 5,6 |
| 5-е сутки после гипоксии* | Интактные Контрольные | 4,7 5,3 |
* Гипоксическую гипоксию воспроизводили «поднятием» мышей в барокамере на «высоту» 10 000 м с «площадкой» в течение 5 мин.
Таблица 20. Показатели клеточного состава периферической крови мышей при сочетанном действии иронического облучения и ингаляции РАВ
| Сутки от начала облучения | Группа животных | Показатели крови | ||
| лейкоциты, 109/л | эритроциты, 1012/л | лимфоциты, 109/л | ||
| 20-е | Интактные Контрольные Опытные | 7,0 3,5 4,4 | 2,9 5,2 4,7 | 3,9 1,9 2,9 |
| 25-е | Интактные Контрольные Опытные | 5,3 2,8 5,8 | 3,4 6,9 4,7 | 3,8 1,7 3,1 |
Таблица 21. Количество эритроцитов в периферической крови мышей опытной и контрольной групп, перенесших гипоксическую гипоксию
| Период исследования | Группа животных | Количество эритроцитов, 1012/л |
| Исходный | Интактные Контрольные Опытные | 3,9 5,6 5,3 |
| 5-е сутки после гипоксии | Интактные Контрольные Опытные | 4,7 5,3 6,9 |
Таким образом, РАВ обладают радиопротекторными свойствами. Последнее реализуется на уровне костномозгового кроветворения; очевидно, основной мишенью радиопротекторного действия РАВ являются плюрипотентная стволовая клетка или ее ближайшие потомки — коммитированные клетки-предшественники.
Глава 21. АНТИКАНЦЕРОГЕННОЕ ДЕЙСТВИЕ ЭФИРНЫХ МАСЕЛ
Есть заболевания, которые в далеком прошлом встречались крайне редко, а в настоящее время являются серьезной медицинской проблемой. К таким заболеваниям относится рак. Человеческая деятельность в наше время увеличивает риск развития рака. Это корпускулярные (а и Р) и ионизирующие (рентгеновские и γ-лучи) излучения, ультрафиолетовые лучи (озоновые дыры), резкое ухудшение экологической ситуации в глобальном масштабе, затрагивающие атмосферу, водоемы, почву и т.д. Нередко злокачественными опухолями осложняются заболевания с иммунологической недостаточностью: профессиональная патология, стрессы, нарушения эндокринного равновесия и др.
Смертность от злокачественных опухолей занимает второе место среди общей смертности, причем она проявляет тенденцию к увеличению, а существующие методы лечения в большинстве случаев остаются малоэффективными. В связи с этим встает наиболее остро проблема профилактики.
Особую актуальность приобретает разработка новых методов выявления и профилактики доклинических форм заболевания (онкологический риск!) как наиболее перспективных направлений профилактики злокачественных опухолей.
В настоящее время раковые клетки можно обнаружить в организме лишь в том случае, когда их число превышает 109. Однако это количество уже соответствует клинически далеко зашедшему процессу, так как по достижении 1012 клеток наступает смерть.
Растения постоянно привлекают внимание исследователей в качестве противоопухолевых веществ. Известный советский химиотерапевт Е.М.Вермер считал, что противоопухолевые вещества надо искать в первую очередь среди растительных веществ, тормозящих их рост и подготавливающих растения к зимнему анабиозу.
В Индии уже много лет назад в качестве противоопухолевого препарата применялся барвинок. Многие другие противоопухолевые средства, созданные на базе различных растений, имеют свою историю. Народный опыт характерен тем, что для лечения используются растительные вещества, лечебный эффект которых действительно наблюдался на протяжении многих поколений.
В исследованиях установлена противоопухолевая активность экстрактов из тополя бальзамического, различных видов полыни. Экстракт из листьев эвкалипта препятствовал развитию цитогенетических нарушений. Так, число клеток с хромосомными аберрациями у интактных животных составляло 1,5 %, после иммунизации мышей вирусом полиомиелита — 12,8 %. При введении одновременно с вакциной экстракта из эвкалипта уровень нарушений снижался на 20—60 %.
Некоторые исследователи нетоксической терапии онкологических заболеваний на экспериментальных моделях отдают предпочтение препаратам растительного происхождения, относящимся к группе адаптогенов (женьшень, родиола розовая, элеутерококк, лимонник китайский). Они способствуют повышению адаптации организма к неблагоприятным условиям, в частности в послеоперационном периоде онкологических больных, для стимуляции клеточного иммунитета при иммунодепрессии.
Противоопухолевый антибиотик из растений — препарат «К»— при введении в организм повышает синтез IgM, обладающий противоопухолевым действием, повышает чувствительность замедленного действия. На основе производных азулена (компонента ЭМ) создан противоопухолевый препарат.
Известно, что канцерогенез может быть предотвращен введением различных химических соединений как природного, так и синтетического происхождения. В настоящее время обнаружено, что вещества, обладающие антиканцерогенными свойствами, принадлежат к 25 различным классам химических соединений. Антиканцерогенные соединения принято классифицировать в соответствии с тем этапом канцерогенеза, на котором они эффективны. К первому типу ингибиторов относятся вещества, предотвращающие образование собственно канцерогенов из их предшественников, ко второму — так называемые блокирующие агенты, которые препятствуют доступу канцерогенов к критическим мишеням или взаимодействию с ними, к третьему — подавляющие агенты, препятствующие развитию опухолевого процесса в клетках, уже подвергшихся взаимодействию с канцерогеном.
Наши исследования относятся к изучению действия антиканцерогенов второго типа, препятствующих взаимодействию канцерогенов с критическими мишенями — белками и образованию канцерогенов — белковых аддуктов (КБА). Исследования в этом направлении представляются наиболее перспективными для решения таких актуальных вопросов онкологии, как разработка высокоэффективных методов первичной специфической химиопрофилактики повышенного профессионального онкологического риска.
Известно, что взаимодействие канцерогенов с нуклеиновыми кислотами и клеточными белками является ключевым звеном в процессах инициации канцерогенеза. Модификация клеточных белков, происходящая в результате их взаимодействия с канцерогенами, может обусловливать повреждение процессов репликации, транскрипции и клеточного деления и, таким образом, модулировать трансформацию клеток или опухолевую прогрессию. Образующиеся при взаимодействии канцерогенов с белками КБА, как было показано, являются высокоспецифическими маркерами канцерогенеза и могут быть использованы для выявления лиц с повышенным онкологическим риском среди промышленных рабочих, а также как эффективные маркеры контроля и регистрации антиканцерогенного действия изучаемых модуляторов канцерогенеза.
Исследования антиканцерогенного и иммуномодулирующего действия РАВ проводились нами на мышах линии СЗНА, получавших в течение 15 дней известный канцероген — бензидин, вызывающий у людей опухоли мочевого пузыря, а у мышей этой линии — развитие гепатом. Эта экспериментальная модель успешно использовалась ранее для изучения антиканцерогенного действия синтетических соединений — полимеров и природных биорегуляторов — витаминов.
Бензидин давали мышам с основной диетой в дозе 100 мг/кг. РАВ эфирных масел вводили ингаляционным способом. Ингаляции производили в специально оборудованной герметической камере в течение 1 ч через день (9 раз). Скорость подачи воздуха, смешанного с летучими РАВ, составляла 3 л/мин. Исследованию подвергали следующие группы животных: 1) мыши, получавшие канцероген в течение 15 дней; 2) мыши, которым вводились РАВ без канцерогена через день (9 раз); 3) мыши, получавшие в течение 15 дней бензидин и эфирные масла; 4) интактные животные (контрольная группа).
Антиканцерогенное действие РАВ оценивали путем сравнительного изучения их влияния на образование КБА в группах мышей, получавших один канцероген и канцероген в сочетании с введением масел. Иммуномодулирующее действие РАВ оценивали путем определения их влияния на образование антителообразующих В-лимфоцитов и розеткообразующих Т-лимфоцитов.
Известно, что бензидин вызывает в печени и в сыворотке крови мышей линии СЗНА через 15 дней после введения образование КБА двух типов: содержащих экзогенный канцероген — бензидин и эндогенный — метаболит триптофана — 3-оксиантраниловую кислоту (3-ОАК). Появление КБА второго типа связано с метаболическими нарушениями, индуцируемыми поступлением в организм экзогенных канцерогенов.
Для определения КБА использовали метод встречной иммунодиффузии в агаре. Тест-системой для определения КБА служили иммуносыворотки кроликов, содержащие антитела против канцерогенов как гаптенов. Для иммунизации кроликов и получения иммуносывороток использовали синтетические, содержащие канцерогены вещества — бензидин и 3-ОАК — азопротеины. Азопротеины получали путем диазотирования аминогрупп канцерогенов и последующего азосочетания полученных диазосоединений с белковым носителем — альбуминами лошадиной сыворотки крови.
КБА определяли в сыворотке крови и экстрактах печени мышей. Для получения сыворотки крови применяли пул от 3—5 мышей. Для получения тканевых антигенов использовали печень от каждой мыши. Тканевые экстракты печени получали путем гомогенизации ткани этого органа в объеме воды, равном 5-кратному весу печени. После гомогенизации экстракты оставляли на сутки в рефрижераторе при +4 ˚С, а затем центрифугировали при 8000 об/мин и концентрировали до содержания белка в пробах 3—6 г%.
Состояние иммунореактивности в группах подопытных и контрольных животных оценивали путем подсчета антителообразующих В-клеток (АОК) в селезенке мышей против эритроцитов барана (ЭБ) при помощи реакции локального гемолиза в геле, отражающих состояние В-системы иммунитета, и розеткообразующих Т-клеток (РОК), отражающих состояние Т-системы иммунитета. Определение Т-лимфоцитов проводили в селезенке, вилочковой железе и лимфатических узлах при помощи реакции иммунного розеткообразования. Статистическую обработку результатов исследований проводили при помощи t-критерия Стьюдента.
Исследовали шалфейное, гвоздичное, жасминовое, анисовое, эвгеноловое ЭМ, основную фракцию ЭМ базилика, пихтовое ЭМ масло лавра и эвкалиптовое. Результаты проведенных исследований показали следующее.
Введение мышам лишь одного канцерогена — бензидина вызывало:
· образование в сыворотке крови и в ткани-мишени печени животных КБА, содержащих экзогенный канцероген — бензидин и эндогенный — 3-ОАК у всех 14 обследованных мышей;
· снижение количества АОК в селезенке мышей; в контроле число АОК составляло 309,7, в то время как у мышей, получавших бензидин, — 136,8 (Р<0,001);
· инволюцию вилочковой железы и снижение количества розеткообразующих Т-лимфоцитов в селезенке и лимфатических узлах. В контроле число розеткообразующих Т-лимфоцитов составляло в селезенке 26,3, в лимфатических узлах — 34,0 и в вилочковой железе — 18,0, в то время как у мышей, получавших бензидин, в селезенке — 14,1 (Р<0,001) и в лимфатических узлах — 21,0 (Р<0,01).
Введение мышам одних РАВ без канцерогена оказывало различное действие на состояние иммунореактивности в зависимости от типа вводимых ароматических веществ. РАВ шалфейного масла не оказывали иммуномодулирующего действия на состояние иммунореактивности мышей. РАВ гвоздичного ЭМ вызывали статистически достоверное по сравнению с контролем увеличение содержания как АОК, так и розеткообразующих Т-лимфоцитов в селезенке, вилочковой железе и лимфатических узлах мышей: в селезенке число РОК составляло 43,7, в лимфатических узлах — 60,0 и в вилочковой железе — 31,0.
РАВ жасминового масла приводили к стимуляции образования АОК в селезенке мышей: их число было статистически достоверно выше по сравнению с контрольными показателями, а также к увеличению содержания Т-розеткообразующих клеток в селезенке мышей (33,3) и не влияло на число РОК в вилочковой железе и лимфатических узлах. РАВ анисового и пихтового масел вызывали стимуляцию образования АОК в селезенке мышей и не влияли на число розеткообразующих Т-лимфоцитов. РАВ ЭМ лавра не влияли на образование АОК и РОК в селезенке и лимфатических узлах, но стимулировали число Т-лимфоцитов в вилочковой железе (40,2). РАВ эвкалиптового масла оказывали иммуностимулирующее действие на образование АОК [число АОК при применении масла повышалось до 367,7, в то время как в контроле составляло 249,8 (Р<0,001)] и на образование РОК в селезенке (43,3; Р<0,02) и в лимфатических узлах мышей (46,6; Р<0,01). РАВ эвгенола не оказывали стимулирующего действия ни на число РОК, ни на число АОК: значения этих показателей были даже достоверно ниже, чем в контроле (число РОК в селезенке мышей составляло 21,6, в лимфатических узлах — 21,6 и в вилочковой железе — 14,7).
Одновременное введение мышам канцерогена и РАВ эфирных масел вызывало следующие изменения изучаемых показателей. Ингаляционное введение мышам одновременно с бензидином некоторых РАВ — как шалфейного, так и гвоздичного ЭМ — вызывало полное подавление образования бензидин и 3-ОАК-содержащих КБА в сыворотке крови и в печени всех исследованных животных; стимуляцию образования антителообразующих В-клеток, число которых не только достигло уровня контроля, но и статистически достоверно превышало его; стимуляцию образования розеткообразующих Т-лимфоцитов в селезенке, вилочковой железе и лимфатических узлах, количество которых не только было статистически достоверно выше соответствующих значений в группе мышей, получавших бензидин, но также достоверно превышало содержание их в группе контрольных животных. Так, в группе мышей, получавших бензидин- и РАВ гвоздичного масла, количество РОК в селезенке составляло 31,2, в лимфатических узлах — 45,5 и в вилочковой железе — 24,6.
При введении РАВ жасминового ЭМ одновременно с канцерогеном отмечалось подавление образования КБА, содержащих 3-ОАК, и снижение образования КБА, содержащих бензидин в печени мышей: из 14 исследованных мышей бензидин-КБА был обнаружен в печени только 2 животных. На образование КБА в сыворотке крови мышей эти РАВ не влияли. Результаты исследования иммунореактивности в этой группе мышей свидетельствовали об увеличении числа АОК, достоверное как по сравнению с группой мышей, получавших бензидин, так и по сравнению с контрольной группой животных. Число РОК увеличивалось только в селезенке и вилочковой железе мышей этой группы и лишь по сравнению с группой животных, получавших один бензидин: в селезенке количество розеткообразующих Т-лимфоцитов составляло 26,7, в вилочковой железе — 21,6. Число Т-лимфоцитов в лимфатических узлах мышей, получавших канцероген и РАВ жасминового масла, не отличалось от соответствующих значений животных контрольной группы (30,2).
Введение РАВ анисового масла с канцерогеном практически не влияло на образование КБА, вызывая лишь снижение частоты регистрации 3-ОАК-антигенов в печени мышей: из 5 подопытных животных 3-ОАК-антиген был обнаружен в печени 2 мышей. В этой группе животных РАВ анисового масла оказывали стимулирующее действие только на образование АОК, которых было достоверно выше, чем у мышей, получавших один канцероген. Число РОК в этой группе было ниже, чем в контроле, в селезенке (13,5) и лимфатических узлах (24,3), а в вилочковой железе, так же как и у мышей, получавших один бензидин, отмечалась инволюция.
Одновременно введение РАВ эвгенола с канцерогеном вызывало снижение образования КБА только в печени животных: из 5 подопытных мышей 3-ОАК-антигены и бензидин-антигены были обнаружены в печени у одного животного. Эвгенол оказывал некоторый защитный эффект на число АОК и РОК в селезенке мышей, значения которых были выше, чем у мышей, получавших бензидин, но ниже, чем в контроле: число РОК в селезенке мышей этой группы составляло 19,1, в вилочковой железе — 13,1 и в лимфатических узлах — 20,3.
РАВ пихты при введении одновременно с бензидином не влияли на частоту регистрации КБА в печени животных, но вызывали снижение их образования в сыворотке крови мышей: из 5 подопытных животных КБА, содержащие бензидин и 3-ОАК, были обнаружены в сыворотке крови только одного животного. Эти РАВ оказывали защитное действие на число АОК, которое было достоверно выше, чем в группе мышей, получавших один бензидин, но ниже, чем в контроле, и препятствовали инволюции вилочковой железы — число РОК в нем (18,5) не отличалось от соответствующего значения в контроле (18,0), но не влияло на число РОК в селезенке (19,0) и лимфатических узлах (24,8), которое достоверно не отличалось от соответствующих значений в группе мышей, получавших один канцероген.
РАВ масла лавра при одновременном введении с бензидином вызывали снижение процента обнаружения 3-ОАК-антигена в сыворотке крови (66,7 %) и в печени животных (17,6 %) и бензидин-антигена в печени мышей — до 5,9 %. На появление бензидин-антигена в сыворотке крови мышей эти РАВ не оказывали влияния. Под действием РАВ лавра в группе этих мышей не наблюдалось снижения содержания АОК в селезенке (259,6) по сравнению с группой мышей, получавших бензидин, которое сохранялось на уровне значения у мышей контрольной группы (249,8); не отмечалось также снижение содержания РОК в селезенке (24,4), вилочковой железе (30,0), лимфатических узлах (33,2), характерного для животных, получавших бензидин.
РАВ эвкалипта при одновременном введении с бензидином не оказывали влияния на образование КБА, но способствовали увеличению числа РОК в селезенке (41,5), лимфатических узлах (42,4) и вилочковой железе (41,0) животных, которое было достоверно выше не только по сравнению с этим показателем в группе мышей, получавших один канцероген, но и по сравнению с группой контрольных животных. Однако в отличие от РОК число АОК в селезенке этой подопытной группы мышей (89,9) оказалось достоверно значительно ниже по сравнению не только с контрольной группой животных (249,8), но и с группой мышей, получавших один бензидин (145,2).
На основании полученных материалов исследований могут быть сделаны следующие выводы.
Из 8 испытанных ЭМ иммуностимулирующие свойства были обнаружены при действии шести видов эфирных масел — гвоздичного, жасминового, анисового, пихтового, эвкалиптового и масла лавра. При этом одни масла стимулировали преимущественно В-систему иммунитета (анисовое и пихтовое), другие — Т-систему иммунитета (масло лавра); наибольший интерес представляют РАВ, стимулирующие как В-, так и Т-системы иммунитета: гвоздичное, жасминовое и эвкалиптовое масла.
Антиканцерогенные свойства РАВ проявляются в торможении взаимодействия канцерогенов с белками и образовании КБА; они обнаружены при действии РАВ гвоздичного, шалфеиного, жасминового, анисового, лаврового, пихтового масел, эвгенола. При этом только РАВ гвоздичного и шалфеиного масел вызывали полное торможение образования КБА как в сыворотке крови, так и в печени животных. Остальные РАВ оказывали частичный эффект.
Введение всех исследованных РАВ одновременно с бензидином препятствовало иммунодепрессивному действию канцерогенов на В- и Т-иммунитет. При этом одни РАВ оказывали защитный эффект преимущественно на В-иммунитет (анисовое и пихтовое масло), в то время как другие — на Т-иммунитет (эвкалиптовое) и третьи — на Т- и В-системы иммунитета (РАВ шалфеиного, гвоздичного, жасминового, лаврового масел, эвгенола).
Представленные результаты экспериментальных исследований свидетельствуют о том, что РАВ, являясь эффективными природными регуляторами, могут блокировать взаимодействие канцерогенов с критическими мишенями клетки и препятствовать их иммунодепрессивному действию на Т- и В-системы иммунитета. Эти данные открывают широкие перспективы для их практического использования в качестве естественных антиканцерогенов при разработке новых методов снижения повышенного онкологического риска.
Во второй части работы мы исследовали рабочих резиновой промышленности. Результаты эпидемиологических исследований свидетельствуют о повышенном риске развития у них злокачественных новообразований легкого, желудка, толстой кишки, мочевого пузыря, кроветворной и лимфатической систем, поджелудочной, предстательной, щитовидной желез и т.д.
Показано, что маркерами повышенного онкологического риска у них могут быть КБА, содержащие экзогенные канцерогены — бензидин и 2-нафтиламин, являющиеся одними из производственных факторов повышенного риска в резиновой промышленности, а также эндогенный канцероген 3-ОАК, регистрируемый в сыворотке крови рабочих.
Для проведения AT была отобрана группа рабочих (50 человек) с повышенным онкологическим риском, в сыворотке крови которых были обнаружены КБА, содержащие бензидин, 2-нафтиламин или 3-ОАК. AT проводилась путем ингаляционного введения рабочим РАВ шалфейного и гвоздичного ЭМ в концентрациях, близких к природным, в течение 15 дней.
До и после AT у рабочих определялись следующие показатели:
· канцероген-белковые аддукты трех типов — содержание бензидина, 2-нафтиламина или 3-ОАК;
· количественное содержание иммунных комплексов (ИК);
· количественное содержание иммуноглобулинов;
· иммуносупрессивное действие сыворотки крови рабочих.
КБА определяли методом встречной иммунодиффузии в агаре. Тест-системой для определения КБА служили иммуносыворотки кроликов, содержащие антитела против канцерогенов как гаптенов. Для иммунизации кроликов и получения иммуносывороток были использованы синтетические, содержащие канцерогены бензидин, 2-нафтиламин и 3-ОАК-азопротеины. Азопротеины получали путем диазотирования аминогрупп канцерогенов и последующего азосочетания полученных диазосоединений с альбуминами лошадиной сыворотки крови.
Содержание иммуноглобулинов и ИК определяли для оценки воздействия на гуморальный иммунитет рабочих РАВ, играющих важную роль в противоопухолевой защите организма. Образование ИК антиген — антитело отражает фазу нормального иммунного ответа, направленного на удаление чужеродных веществ. Все экзо- и эндоантигены, в том числе и КБА, можно считать индукторами образования ИК. Предполагается важная роль ИК в иммунорегуляции: взаимодействуя с клеточными рецепторами, ИК могут модулировать Т- и В-системы иммунитета. В связи с этим определение ИК у рабочих до и после AT представляет интерес как для оценки гуморального иммунитета, так и для исследования степени воздействия на него КБА. Для определения количества ИК использовали метод, основанный на селективной преципитации комплексов антиген — антитело в 3,75 % полиэтиленгликоле с последующим фотометрическим определением плотности преципитата. Количественное определение IgA, IgM и IgG проводилось при помощи метода иммунодиффузии по Манчини. Иммуносупрессивное действие сыворотки крови рабочих определяли путем исследования ее влияния на образование антителообразующих клеток (АОК) к эритроцитам барана (ЭБ) у мышей линии BALB/C в реакции локального гемолиза в геле.
Тест подавления сывороткой крови больных АОК к ЭБ был предложен для иммунодиагностики рака легких. При помощи этого теста было показано, что количество АОК к ЭБ у мышей, которым вводили сыворотку крови рабочих, содержащую КБА, статистически достоверно ниже, чем в селезенке мышей, которые получали сыворотку крови рабочих, не содержащую КБА. Следует отметить, что вопрос о роли и значении гуморальных иммунодепрессантов имеет общебиологическое значение и широко используется при различных патологических состояниях, в том числе и при опухолях. В сыворотке крови онкологических больных обнаружены гуморальные факторы, которые ингибируют самые различные иммунологические реакции, причем супрессия может носить как специфический, так и неспецифический характер. В связи с этим изучение гуморальных супрессивных факторов у рабочих с профессиональным онкологическим риском до и после AT представляет значительный интерес как для разработки критериев оценки эффективности ароматерапии риска, так и для дальнейшего изучения механизмов этиопатогенеза профессиональных опухолей. Для стандартизации данных, полученных в нескольких опытах, в связи с тем что количество АОК в контроле может значительно варьировать от опыта к опыту, результаты определения АОК рассматривали в виде коэффициента иммунного ответа (КИО):
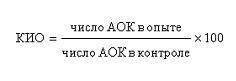
где число АОК в опыте представляло количество АОК, образующихся в селезенке мышей, которым вводили сыворотку крови рабочих и ЭБ, а число АОК в контроле — количество АОК в селезенке мышей, которым вводили только ЭБ. Статистическую обработку полученных материалов исследований проводили при помощи t-критерия Стьюдента.
Результаты проведенных исследований показали следующее (рис. 11). До AT КБА, содержащие 3-ОАК, были выявлены в крови 48 из 50 отобранных рабочих (98 %); содержащие бензидин — у 27 из 50 рабочих (54 %), а 2-нафтиламин — у 18 человек (36 %). Общая группа повышенного онкологического риска (лица, содержащие один, два или три маркера одновременно) составила 100 %: в крови всех 50 отобранных рабочих были обнаружены КБА, содержащие 3-ОАК, бензидин или 2-нафтиламин. После AT КБА, содержащие 3-ОАК, были обнаружены у 7 человек (14 %), бензидин — у 6 (12 %) и 2-нафтиламин — у одного (2 %). Общая группа риска после AT составила 10 человек (20 %). Таким образом, после AT число рабочих, в крови которых содержались 3-ОАК-КБА, сократилось в 7 раз, бензидин-КБА — в 4,5 раза, 2-нафтиламин-КБА — в 18 раз. Общая группа повышенного онкологического риска (безотносительно канцерогена, входящего в состав КБА) сократилась в 5 раз.
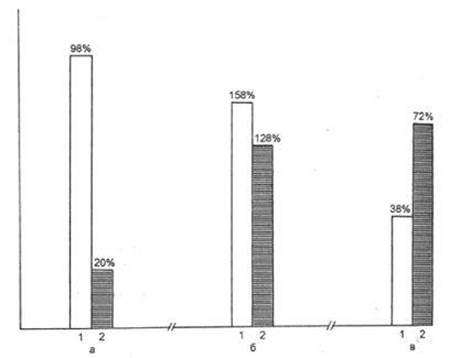
Рис. 11. Влияние ароматерапии на содержание в крови рабочих 3-АОК, иммунные комплексы (ИК) и коэффициент иммунного ответа (КИО).
1 — до начала процедур; 2 — по окончании процедур; а — содержание в крови 3-ОАК; б — содержание иммунных комплексов; в — коэффициент иммунного ответа.
Снижение после AT числа рабочих, в крови которых имелись КБА, отражалось на результате определения у них количества ИК: если до AT среднее количество ИК составляло 158,1, то после окончания курса ингаляций оно снизилось до 128,8 (различия статистически достоверны).
Средние значения иммуноглобулинов в группе рабочих до AT составило: IgA — 2,16, IgM — 1,38, IgG — 9,32, а после окончания курса — соответственно 2,02 (Р<0,05), 1,53 (Р<0,05) и 8,9 (Р<0,05) (Р — степень достоверности по сравнению с контрольной группой рабочих до AT). Эти результаты свидетельствуют о статистически достоверном увеличении в сыворотке крови рабочих после AT из трех исследованных классов иммуноглобулинов только IgM.
Результаты исследований влияния сыворотки крови рабочих на образование АОК к ЭБ оказались следующими. В группе рабочих до AT КИО составлял 38,7, в то время как после AT — 72,1 (Р<0,05). Увеличение коэффициента иммунного ответа после AT указывает на то, что снижение частоты регистрации в сыворотке крови рабочих КБА, наблюдаемое после вдыхания РАВ, сопровождается снижением ее иммунодепрессивного действия на образование антите-лообразующих В-лимфоцитов в ответ на антигенную стимуляцию. Об этом свидетельствует также увеличение содержания IgM в сыворотке крови рабочих после ароматерапии.
Таким образом, результаты проведенных исследований показали, что РАВ эфирных масел, вызывая уменьшение частоты регистрации эндогенных факторов риска — КБА и препятствуя возникновению связанных с их появлением нарушений иммунореактивности, могут быть использованы для разработки новых нетрадиционных методов AT повышенного профессионального онкологического риска.
Глава 22. ФИЗИОТЕРАПИЯ С ПРИМЕНЕНИЕМ ЭФИРНЫХ МАСЕЛ
Природные и преформированные физические факторы должны развиваться параллельно и дополнять друг друга. В этом плане, на наш взгляд, особенно целесообразно сочетанное применение некоторых физиотерапевтических процедур с эфирными маслами.
Для изучения в экспериментах на животных распределения эфирных масел в органах и тканях, их концентрации при различных путях введения, скорость элиминации из организма, надо было пометить эфироносное растение углеродом 14С.
Способ введения 14С в вегетирующие растения лаванды настоящей и монарды дудчатой с последующей отгонкой ЭМ из цветков и соцветий состоял в следующем: растение помещали в герметическую прозрачную камеру с радиоактивной 14СО, (объем камеры — 0,4 м3, концентрация 14СО2 — 1 %, удельная активность составляла 100 мБк/м3).
Более простой способ состоял в выдерживании базальных частей свежесрезанных растений в растворе меченной 14С сахарозы с удельной активностью 3—4 мБк/мл.
Радиоуглерод, ассимилированный из14С сахарозы или 14СО, при фотосинтезе, включался в реакции синтеза ЭМ. Удельная активность ЭМ соответствовала 400 кБк/мл. Измерение проводилось газоразрядным детектором. Описанный способ метки с14СО2 применялся в исследованиях поступления и распределения ЭМ в организме животных.
При внутримышечном введении ЭМ монарды включение метки регистрировалось во всех органах: в легких — 450 имп/мин, печени, селезенке, сердце, крови — 250—300 имп/мин, в почках — 3000— 6000 имп/мин, в мышцах в месте введения — 1000—1500 имп/мин. Замеры проводили через 2 ч после введения ЭМ. Эфирное масло монарды элиминировалось через почки и легкие.
При ингаляционном введении ЭМ монарды, меченной14С, установлено, что через 2 ч максимальное количество радиоактивной метки обнаруживалось в легких — 330 имп/мин на 100 мг сухой массы, в печени и почках — 169 и 225 имп/мин, селезенке — 73,6 (фоновый уровень 45 имп/мин). Через 6 ч метка обнаруживалась только в почках — 82 имп/мин. Через 24 ч резко возрастала радиоактивность селезенки (345 имп/мин). На 4-е сутки радиоактивность вновь повысилась в легких и почках, а в селезенке снизилась.
Фонофорез в сочетании с ЭМ. Мы изучили возможность введения ЭМ лаванды методом фонофореза. В работе использовались ЭМ лаванды, меченные 14С. Крысам опытной группы масло лаванды вводили путем фонофореза в депилированный участок кожной поверхности спины. В контрольной группе масло втиралось в аналогичном количестве стеклянной палочкой. С этой целью в опытной и контрольной группах на депилированные участки кожи наносили масло в количестве 0,4 мл. Процедуру проводили однократно в течение 20 мин. После 2-, 6-часовой и суточной экспозиции крыс обеих групп забивали. Для исследования забирались кусочки кожи из области втирания, мышцы, почки, а также кровь, из которых после тщательного высушивания и растирания готовили навески по • 70 мг. Радиоактивность проб определяли на газово-проточном счетчике. По количеству импульсов в навеске судили о количестве введенного в организм крысы ЭМ лаванды.
Замеры радиоактивности в исследуемых пробах показали, что ЭМ лаванды в большом количестве вводится с помощью ультразвука. После 2-часовой экспозиции количество импульсов в пробах крови опытной группы достоверно превышало их число в контрольных пробах (Р<0,001). После 6-часовой экспозиции достоверного различия между радиоактивностью опытных и контрольных проб не отмечалось. После суточной экспозиции в пробах кожи опытной группы радиоактивность резко снизилась, в то время как в контрольной группе она была достоверно выше (Р<0,001). Показатели радиоактивности проб почек, печени, мышц и крови статистически не обрабатывались из-за их низкой радиоактивности.
Приведенные данные позволяют заключить, что ультразвук способствует большему введению масла лаванды в кожу и быстрейшему его поступлению в кровь, чем при обычном втирании (массаже).
Введение эфирного масла лаванды методом фонофореза и массажа. Нами в эксперименте установлено, что при массаже с ЭМ лаванды, меченного ИС, оно вводится медленнее, чем при фонофорезе (Р<0,05), но в коже задерживается дольше. Так, через сутки после массажа радиоактивность кожи была достоверно выше (Р<0,001), чем при введении методом фонофореза.
Введение эфирного масла лаванды при бальнеопроцедурах. Через 2 ч после отпуска ванн крысам с водопроводной водой и эфирным маслом лаванды, меченным 14С в пропорции 99,5:0,5, при длительности процедуры 30 мин радиоактивность крови составила 158, легких — 226, почек — 173 имп/мин, что свидетельствует о высокой и быстрой проходимости ЭМ через кожу и поступлении их в кровь и органы. Это подтверждает целесообразность сочетанного использования ванн с эфирными маслами.
Действие фонофореза в сочетании с ЭМ лаванды на резистентность животных. Изучен первичный иммунный ответ крыс при действии на проекцию тимус—костный мозг фонофореза в сочетании с одновременным нанесением ЭМ лаванды.
Исследования проводили на трех группах крыс по 10 животных в каждой. Животные контрольной группы воздействию ультразвука не подвергались. В 1-й опытной группе воздействовали ультразвуком мощностью Вт/см2 на проекцию тимус—костный мозг; длительность процедуры 15 мин. Во 2-й группе воздействовали ультразвуком той же мощности, область и длительность воздействия были те же, что и в 1-й группе, но вместо вазелина использовали ЭМ лаванды. Во всех трех группах курс включал 10 процедур.
Исследовали функциональную активность Т-лимфоцитов, ГЗТ и титр антител. Данные, полученные в опытных группах, сравнивали с результатами исследования животных интактной группы. По функциональной активности Т-лимфоцитов, ГЗТ и титру общих антител IgM опытные группы достоверно отличались от контрольной. По титру антител достоверное различие установлено лишь в опытной группе (ультразвук в сочетании с ЭМ лаванды). При сравнении результатов 1-й и 2-й опытных групп достоверное различие выявлено по выраженности ГЗТ и титру антител класса IgG.
Приведенные данные свидетельствуют о том, что при фонофорезе действие ультразвука на ГЗТ и гуморальный иммунитет было более выраженным в тех случаях, когда фонофорез сочетался с эфирным маслом.
Эфирные масла в сочетании с лечебной грязью. Преимущество действия лечебной грязи с ЭМ состоит в том, что оно усиливается за счет биологически активных веществ ЭМ. Высокая проникающая способность ЭМ через кожу позволяет считать, что при накожном их применении следует ожидать проявления общего характера. Через кожу кролика ЭМ эвкалипта, чабреца проникают за 20—40 мин; лимонное, анисовое, бергамотное ЭМ — за 40—60 мин; лаванды, сосны, герани — за 60—70 мин; кориандра — за 100 мин. ЭМ, помимо собственной активности, могут быть носителями для других лекарственных средств, которые требуется приложить локально и получить общие эффекты.
Мы установили в эксперименте, что через 2 ч после накожной аппликации крысам лечебной грязи (озеро Мойнаки, Евпатория) с ЭМ лаванды, меченной 14С в пропорции 99:1, и при длительности процедуры 30 мин радиоактивность крови составила ПО имп/мин, легких — 106, почек — 144 имп/мин.
Приведенные данные свидетельствуют о том, что ЭМ при сочетанном применении с лечебной грязью проникают через кожу, поступают в кровь и разносятся по всему организму.
Действие лечебной грязи с ЭМ на гуморальный иммунитет. Опыты проводили на двух группах крыс — контрольной и опытной — по 10 животных в каждой. Использовали лечебную грязь озера Мойнаки (Евпатория) в смеси с ЭМ лаванды. Масло смешивали с лечебной грязью до 0,5 % конечной концентрации. Лечебную грязь доводили до температуры 36 °С и накладывали на всю спину крысы. Длительность процедуры 15 мин, курс исследования включал 10 процедур. В контрольной группе лечебную грязь накладывали без эфирного масла. Проекция нанесения, длительность процедуры и курса соответствовали таковым в опытной группе.
Аппликация грязи в сочетании с эфирным маслом лаванды вызывала у животных достоверное (Р<0,05) повышение титра антител (IgM + IgG). Этого не наблюдали в контрольной группе животных. Таким образом, лечебная грязь в сочетании с ЭМ лаванды оказывает более выраженное действие на показатели гуморального иммунитета. Использование лечебной грязи в сочетании с ЭМ расширяет потенциальные лечебные свойства грязи.
Действие эфирного масла при нанесении на кожу проекции вилочковой железы. Мы изучали действие эфирного масла лаванды на первичный и вторичный иммунные ответы крыс при нанесении на кожу проекции вилочковой железы. Исследования проводили на двух группах животных по 10 крыс в каждой. Во время опыта крыс фиксировали и на кожу, с которой предварительно была удалена шерсть, наносили одну каплю 50 % эфирного масла лаванды. Воздействие продолжалось 15 мин. Затем масло снимали сухой ватой. Курс исследования включал 10 процедур.
При первичном и вторичном ответах в опытной группе наблюдали достоверное снижение реакции ГЗТ и повышение функциональной активности Т-лимфоцитов. Одновременно отмечалось повышение титра антител иммуноглобулинов классов М + G. Приведенные данные интересны, на наш взгляд, тем, что описанный метод иммунокоррекции весьма активен и прост. Однако необходимо его дальнейшее изучение.
Можно с уверенностью предполагать позитивный эффект сочетанного действия ЭМ и лазерного излучения.
Считают возможным получать эффект от сочетанного действия биоконденсатов с электрофорезом и с внутриорганным (внутритканевым) электрофорезом. Однако эти предположения необходимо подтвердить в эксперименте.
Эффективность применения ЭМ при различных заболеваниях легких бактериальной этиологии во многом может быть повышена при сочетании их с лекарственными ферромагнетиками. Их удержание в зоне поражения с помощью магнитного поля обеспечивает создание высоких концентраций ЭМ и пролонгирует период их элиминации из организма.
Мы описали лишь некоторые стороны возможного практического применения ЭМ при СКЛ. Однако по мере получения новых экспериментальных и клинических данных сфера сочетанного применения ЭМ будет все более расширяться.
В последнее десятилетие значительно возрос интерес к нефармакологическим методам лечения, что потребовало от врачей санаторно-курортных учреждений и санаториев-профилакториев знаний ароматерапии. Это залог успеха в профилактике и лечении многих заболеваний. К ЭМ возрос интерес и у больных.
Противовоспалительная активность эфирных масел. Мы изучали на двух моделях противовоспалительную активность 23 различных видов эфирных масел.
Первая модель — модель асептического воспаления. Механизм изучения противовоспалительных средств основан на том, что в норме введение стрихнина вызывает гибель животного. Однако при моделировании у животных воспалительной реакции в области введения скипидара возникает воспалительный вал, который ограничивает очаг некроза и препятствует всасыванию в кровь из этого очага некроза токсичных веществ, находящихся в зоне воспаления. Следовательно, если в такой участок некроза ввести безусловно смертельную дозу стрихнина, животное не погибает, поскольку воспалительный вал предотвратит поступление стрихнина в кровь. Если же применяется противовоспалительное средство, интенсивность воспалительного процесса снижается, защитная функция воспалительного вала уменьшается и стрихнин из очага поражения начинает активно поступать в кровь.
Таким образом, в экспериментах регистрируется обратная зависимость: чем эффективнее противовоспалительное действие испытуемого препарата, тем менее выраженным становится противовоспалительный барьер и увеличивается выход стрихнина в кровь, причем большой процент животных погибают.
Наиболее активным по отношению к асептическому воспалению оказалось ЭМ лаванды, затем по убыванию противовоспалительной активности идут такие ЭМ, как тяжелое хвойное, ажгон, лавр, монарда, базилик и т.д.
Во второй серии опытов противовоспалительное действие ЭМ испытывали на модели инфекционного воспаления, создаваемого путем введения в лапку мыши взвеси культуры патогенного стафилококка. Наиболее эффективными были ЭМ монарды и лаванды. У монарды проявились не только противовоспалительная активность, но и выраженные антимикробные свойства.
В экспериментах на кроликах под влиянием ЭМ лаванды на 30-е сутки и особенно через 60 сут после индукции воспаления в легких регистрировалось торможение воспалительного процесса. В аналогичной контрольной группе к этому сроку воспалительный процесс прогрессировал до гнойно-некротического. Под влиянием ЭМ базилика у части животных наблюдались выраженное торможение воспалительных процессов и активация пролиферативных процессов в легких, направленных на организацию гнойных очагов воспаления.
При лечении инфицированных ран, ожогов, местных гнойных процессов еще недавно акцент ставили на антибактериальную терапию. Однако этот взгляд на современном этапе изменился в сторону методов усиления иммунной защиты организма. Оказалось, что некоторые ЭМ способны корригировать нарушения иммунной системы, вызванные длительным воспалением. Так, через 30 и 60 сут после создания воспаления в легких базилик значительно стимулировал функциональную активность Т-лимфоцитов и реакции ГЗТ. В контрольной группе животных в данные сроки воспаления интенсивность этих реакций была ниже уровня интактных животных.
Итак, ЭМ обладают выраженным противовоспалительным эффектом. Механизм этого действия сложный. Он обусловлен многосторонним влиянием на различные стороны воспалительного процесса. Так, угнетение пусковых механизмов воспаления на этапе повреждения биологических мембран может осуществляться за счет стабилизации мембран, ингибирования свободнорадикального окисления, действия на кору надпочечников, стимулирующих продукцию противовоспалительных стероидных гормонов, способности тормозить инактивацию адреналина, обладающего противовоспалительными свойствами, действовать антагонистически на медиаторы воспаления (гистамин, серотонин, кинины). Важную роль в противовоспалительном эффекте играют также состояние неспецифической резистентности организма и его иммунологическая реактивность.
Глава 23. ЭФИРНЫЕ МАСЛА И ВАКЦИНАЦИЯ
Профилактические прививки — высокоэффективное оружие в борьбе с инфекционными болезнями. Профилактические прививки npоводят в целях получения активного и пассивного иммунитета [Терешин Б.Б., Сохин А.А., 1981]. Для создания активного иммунитет та в организм человека вводят вакцины или анатоксины. Благодагоря вакцинации резко сокращены или практически ликвидированы такие инфекционные заболевания, как дифтерия, натуральная оспа, полиомиелит. Успехи вакцинопрофилактических мероприятий очевидны. Отдельные страны отказались от обязательных прививок против некоторых инфекций. Однако это решение было преждевременным. В 90-е годы вновь повысилась заболеваемость дифтерией, туберкулезом и другими инфекционными болезнями. Особое внимание обращает на себя тот факт, что основная масса прививок приходится на время между ранним детством и юношеством, когда организм еще не сформировался. Не сформировалась и иммунологическая система, которая при достаточно сжатом прививочном календаре получает чрезмерную иммунологическую нагрузку.
Некоторые вакцины наряду с формированием иммунитета против инфекции иногда вызывают побочные эффекты. Возможное аллергизирующее действие прививок впоследствии может способствовать неблагоприятному течению различных заболеваний. Прививки могут оказывать отрицательное действие на неспецифическую резистентность организма и его иммунологическую реактивность (развитие вторичных иммунодефицитов). В этот период организм обычно находится в состоянии нарушенного равновесия.
Проблема профилактики прививок предусматривает дальнейшее совершенствование методов вакцинации и, в частности, поиск новых адъювантов (стимуляторов). Разработано несколько приемов стимуляции иммунного ответа, которые основаны на использовании группы адъювантов, веществ, неспецифически усиливающих функцию иммунной системы: БЦЖ, противотуберкулезная вакцина и ФГА (растительный белок фитоагглютинин) и др.
Представляют интерес результаты исследования стимуляции иммуногенеза неспецифическими, неантигенными веществами — растительными ароматическими биорегуляторами.
Нами была изучена активность РАВ монарды и базилика в условиях целостного организма. Ранее мы установили, что эти ЭМ проявляли в отношении микоплазмы FH и L-форм стрептококка 406 наиболее высокую активность и обладали иммуностимулирующей активностью [Николаевский В.В. и др., 1996]. Бактерицидная доза этих масел не превышала 100 мкг/мл.
Эксперименты проводили на 60 бройлерах-6 в возрасте 65 дней; средняя живая масса 1000 г. Они были инфицированы микоплазмой галлисептикум. В работе использована вирус-вакцина против инфекционного ларинготрахеита (ИЛТ). Инфицирование птиц проводили вирусным штаммом Г-вируса ИЛТ.
В качестве РАВ использовали ЭМ монарды и базилика, показавших в экспериментах in vivo наиболее выраженные противомико-плазменные и антивирусные свойства. Кроме того, РАВ монарды действовал еще и как иммуностимулятор.
Схема постановки опыта была следующей. Всех птиц разделили на 3 группы: птицам 1-й группы (20 голов), инфицированным микоплазмой галлисептикум, вводили аэрозольной вакцинацией штамм ВНИИБП в дозе 5 ЭИД/1 м3 атмосферы совместно с РАВ базилика в дозе 50 мг/м3; птицам 2-й группы (20 голов), также инфицированным микоплазмой галлисептикум, вводили аэрозольно вакцинный штамм ВНИИБП в дозе 5 ЭИД/м3 совместно с РАВ монарды в дозе 50 мг/м3. Птицам 3-й группы (20 голов) проводили аналогичную вакцинацию, однако РАВ не использовали; эта группа была контрольной. Аэрозоль вакцинного штамма вируса ИЛТ получали с помощью генератора аэрозолей САГ-1. Через 20 дней после введения вакцины с РАВ проверяли напряженность иммунитета вирулентным штаммом Г-вируса ИЛТ. Вирулентный штамм Г-вируса ИЛТ вводили интратрахеально в дозе 1000 ЭИД (0,2 мл).
Сыворотки исследовали в реакции задержки гемагглютинации с вирусом ИЛТ и в реакции агглютинации со стандартным антигеном микоплазмы галлисептикум.
Исследования показали, что в подопытных группах, где было использовано РАВ монарды, 83,3 % птиц оказались устойчивыми к действию инфекции (Р<0,001). В группе, где использовалось РАВ базилика, этот процент был ниже — 61,1 %. У птиц контрольной группы устойчивость к заражению регистрировалась только в 33,3 % случаев.
В группах птиц, у которых использовались РАВ, выраженность воспалительного процесса была ниже, чем в контрольной группе. Так, в группе с применением РАВ монарды на 6-й день наблюдения легкое течение ларинготрахеита отмечено у 5,6 %, среднее — у 11,1 % птиц. Тяжелых проявлений болезни не обнаружено. Во 2-й группе легкое течение регистрировалось в 27,8 % случаев, среднее — в 5,6 %, тяжелое — в 5,6 %. В контрольной группе легкое течение болезни отмечено у 11,1 %, среднее — у 16,7 %, тяжелое — у 33,3 % птиц.
Исследование реакции задержки гемагглютинации с антигеном вируса ИЛТ показало, что в группе птиц, где использовались РАВ монарды и базилика, процент положительных реакций через 6 сут колебался от 88,24 до 100. Среднегеометрический титр антител к антигену вируса ИЛТ варьировал в пределах 1,4844—1,9939. В контрольной группе эти показатели составили 81,25—87,5 и 1,4145— 1,6292 % соответственно. Полученные данные свидетельствуют о том, что напряженность иммунитета к вирусу ИЛТ была выше в тех группах, где использовались РАВ.
Серологические исследования микоплазменной инфекции показали, что микоплазмоз регистрировался в 66,17—100 % случаев.
При клиническом обследовании птиц было установлено, что заболеваемость у них регистрировалась в меньшем проценте случаев и протекала более благоприятно при использовании РАВ.
Таким образом, использование РАВ монарды и базилика благоприятно влияет на течение заболеваний, вызванных вирусно-микоплазменной инфекцией. РАВ существенно повышают резистентность микроорганизма к действию инфекционного агента, улучшают клиническое течение заболевания, повышают напряженность иммунитета к вирусам и микоплазмам.
Второй этап исследований был посвящен испытанию действия наиболее эффективного РАВ — монарды на напряженность иммунитета у аэрозольно вакцинированной птицы против ИЛТ, определению наиболее оптимальной дозы РАВ и испытанию сочетанного действия РАВ монарды и биологических проводников на устойчивость у привитой птицы. Для решения этих задач была проведена серия экспериментов.
В первый опыт было включено 40 голов бройлеров. Для вакцинации применяли вирус-вакцину. В опыте использовали РАВ монарды, биологический проводник — диметилсульфоксид ТУ-6-09-38 18-77. Разрешающая доза вируса — вирулентный штамм Г-вируса ИЛТ, доза 2500 ЭИД/м3.
Процент устойчивости птиц при вакцинировании против ИЛТ совместно с РАВ монарды был более высоким против инфекционного агента, чем использование вакцины в чистом виде, т.е. без добавок биологически активных веществ (60 %).
В этом опыте было установлено, что при сочетанном воздействии диметилсульфоксида с РАВ монарды устойчивость птиц составила 30 %, т.е. сочетанное воздействие биологических проводников и РАВ в данной аранжировке опыта недостаточно перспективно.
Следующие исследования были направлены на определение оптимальной дозы РАВ монарды при аэрозольной иммунизации птиц против ИЛТ. В опыт было включено 60 голов бройлеров. Для вакцинации использовали вирус-вакцину.
Разрешающая доза вируса — вирулентный штамм Г-вируса ИЛТ, доза 2500 ЭИД/м3.
Во втором опыте также использовали РАВ монарды. Наиболее оптимальными дозами были 50 и 100 мг/м3 атмосферы. Здесь процент устойчивых птиц к действию вируса ИЛТ достигал 78 и 80 % соответственно. Концентрация РАВ 25 мг/м3 также дала хорошие результаты. Однако число резистентных бройлеров при этих дозах было ниже (75 %), чем в экспериментах с дозами 50 и 100 мг/м3.
При использовании РАВ монарды в концентрации 150 мг/м3 отмечены наиболее низкие показатели устойчивости птиц к инфекционному агенту. Здесь число резистентных бройлеров составило всего 66,6 %.
В экспериментах in vivo на модели вирусно-микоплазменного заражения показано, что под действием РАВ заболеваемость значительно снималась и протекала клинически более благоприятно, чем в контроле. Одновременно резистентность кур к инфицированию персистирующими микроорганизмами (микоплазмой галлисептикум и вирусом ИЛТ) повышалась. Это происходило не только за счет прямого действия РАВ на микроорганизмы, но и в результате стимуляции иммунного ответа. В пользу последнего свидетельствуют факты о том, что эффективность вакцинации резко возрастает при сочетанном использовании ее с РАВ.
В лабораторных условиях проведены опыты по изучению гисто-морфологических реакций в легких, трахее, селезенке, печени, фабрициевой сумке и вилочковой железе от 48 бройлеров 60—100-дневного возраста через 3, 7, 10, 20 и 30 дней после аэрозольной вакцинации против ИЛТ при одновременном введении РАВ.
До введения РАВ базилика на фоне гиповитаминозов и кокцидиоза отмечено значительное снижение показателей общей резистентности и морфофункционального состояния иммунокомпетентных органов. У 86 % использованных в опыте цыплят имелись гистологические проявления иммуносупрессии, причем у 40 % бройлеров подавление функции иммунитета было весьма значительным (иммуносупрессия IV—V степени).
После однократной обработки цыплят с выраженными проявлениями иммуносупрессии первые 3 дня наблюдались слабые признаки активации фабрициевой сумки. Уменьшилось количество фолликулов с признаками иммуносупрессии. Через 8 дней после обработки аэрозолем масла базилика количество цыплят, у которых гистологически определялось состояние иммуносупрессии фабрициевой сумки, сокращалось с 86 до 25 %. В фолликулах увеличивалось число лимфоцитов и бластов.
Наиболее четко признаки иммуностимуляции проявлялись на 14-й день опыта. Размеры фолликулов имели примерно в 2 раза большую величину, чем в контроле. Происходило дальнейшее улучшение заполнения коркового вещества фолликулов лимфоцитами. Корковое вещество было представлено 7,34 рядами клеток (Р<0,001). Отмечено достоверное увеличение ширины коркового слоя вилочковой железы.
Как показали исследования, стимулирующее действие аэрозоля масла базилика проявляется лишь при использовании 50 мг/м3 не более чем в д
Date: 2016-07-22; view: 438; Нарушение авторских прав