
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Групповой реагент, общие и фармакопейные реакции катионов IV аналитической группы.
БИЛЕТ №13
1.При температуре 353 к реакция заканчивается за 20 секунд. Сколько времени длится реакция при 293 К, если у=2,5.
Решение: между скоростью протекания химических реакций и их продолжительностью – обратно пропорциональная зависимость:
 ,где τ₁ и τ₂ - время протекания реакции при температурах T₁ и T₂.
,где τ₁ и τ₂ - время протекания реакции при температурах T₁ и T₂.
2) правило Вант-Гоффа в данном случае можно записать в виде:
 =
= 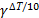 , откуда τ₁ = τ₂ *
, откуда τ₁ = τ₂ * 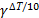 = 20 сек * 2,56; τ₁ = 4880 сек = 81 минута 18 сек.= 1 час 21 мин 18 сек.
= 20 сек * 2,56; τ₁ = 4880 сек = 81 минута 18 сек.= 1 час 21 мин 18 сек.
Ответ: 1 час 21 мин 18 сек.
2.Напишите характерные реакции на ион NO3-.
Сульфат железа (II) FeSO4 окисляется азотной кислотой или ее солями с выделением оксида азота (II)NO. Реакция проходит в присутствии концентрированной серной кислоты:
2NaNO3 + 6FeSO4 + 4H2SO4 + 3Fe2(SO4)3 + Na2SO4 + 2NO↑ + 4H2O
Оксид азота (II) образует с FeSO4 бурое соединение:
FeSO4 + NO = [Fe(NO)]SO4
Групповой реагент, общие и фармакопейные реакции катионов IV аналитической группы.
Групповым реагентом является водный раствор гидроксида натрия NaOH (или калия KOH)
Реакция катиона хрома (III) Cr3+
1. Гидроксиды щелочных металлом NаOH и KOH являются групповыми реактивами для четвертой группы. Гидроксид натрия из раствора соли хрома (III) выделяет серо-зеленый амфорный осадок гидроксида хрома (III):
CrCl3 + 3KOH = Cr(OH)3↓ + 3KCl
Cr3+ + 3OH- = Cr(OH)3↓
Осадок Cr(OH)3 растворяется:
а) в разбавленных кислотах Cr(OH)3↓ + HCl = CrCl3 + 3H2O
б) в избытке растворов щелочей Cr(OH)3↓ + 3NaOH = Na3[Cr(OH)6],
что указывает на амфотерность гидроксида хрома (III).
Сульфид аммония ((NH4)2S выделяет из растворов солей хрома (III) аморфный осадок гидроксида хрома (III):
2CrCl3 + 3(NH4)2S + 6H2O = 2Cr(OH)3↓ + 3H2S↑ + 6NH4Cl
Пероксид водорода Н2О2 в присутствии щелочи окисляет ион хрома Cr3+ в хромат ион CrO42-. Реакция сопровождается характерным внешним признаком – изменением окраски раствора из ярко-зеленой (цвет ионов Cr3+) в ярко-желтую (цвет ионов CrO42-).
Реакции протекают в такой последовательноти:
1. образуется гидроксид хрома CrCl3 + 3NaOH = Cr(OH)3↓ + 3NaCl
2. в избытке щелочи образуется комплексная соль
Cr(OH)3↓ + 3NaOH = Na3[Cr(OH)6]
3. окисление до хромата (желтого цвета)
Суммарная реакция:
2CrCl3 + 3H2O2 + 10 NaOH = 2Na2CrO4 + 6NaCl + 8 H2)
Если полученный раствор хромата подкислить разбавленной H2SO4, то пероксид водорода образует хромат в надхромовую кислоту H2CrO6 синего цвета, легко переходящую в органический слой.
Реакция катиона Zn2+
1. Гидроксиды щелочных металлов NaOH и KOH как групповой реактив выделяют из растворов солей цинка белый студенистый осадок гидроксида цинка:
ZnCl2 + 2NaOH = Zn(OH)2↓ + 2 NaCl
Zn2+ + 2OH = Zn(OH)2↓
2. Гидроксид цинка обладает амфотерными свойствами и поэтому растворяется:
а) в разбавленных кислотах Zn(OH)2 + 2HCl = ZnCl2 + H2O
б) в избытке щелочи Zn(OH)2 + 2NaOH = Na[Zn(OH)4]
Сульфид аммония (NH4)2S осаждает из нейтральных растворов ион цинка в виде белого аморфного сульфида цинка:
ZnCl2 + (NH4)2S = ZnS↓ + 2NaCl
Zn2+ + S2- = ZnS↓
Гексацианоферрат (III) калия K3[Fe(CN)6] красная кровяная соль) с солями цинка дает коричневато-желтый осадок гексацианоферрата (III) цинка:
3ZnCl2 + 2 K3[Fe(CN)6] =Zn3K3[Fe(CN)6]2↓ + 6KCl
3Zn3+ + 2[Fe(CN)6]2↓
Осадок растворяется в хлороводородной кислоте и растворе аммиака.
Реакция сухим путем (образование зелени Ринмана).
Кусочек фильтровальной бумаги, смоченный раствором соли цинка и раствором нитрата кобальта (II), при сжигании дает золу, окрашенную в зеленый цвет цинкатом кобальта (зелень Ринмана). При этом происходит реакция:
Zn(NO3)2 + Co(NO3)2 = CoZnO2 + 4NO2↑ + O2↑
проведению реакции мешают ионы Al3-+3, Cr+3.
Реакция катиона Al3+
1. Гидроксиды щелочных металлов NaOH или KOH, как групповой реактив, с солями алюминия образуют белый осадок гидроксида алюминия Al(SO4)3.
Вследствие амфотерного характера гидроксида алюминия осадок растворяется в разбавленных кислотах:
Al(OH)3 + 3HCl = AlCl3 + 3H2O и в избытке щелочи:
Al(OH)3 + NaOH = Na[Al(OH)4]
Al3+ + 3OH- = Al(OH)3↓
2. Сульфид аммония (NH4)2 из растворов солей Al3+ выделяет аморфный осадок гидроксида алюминия:
3(NH4)2S + Al2(SO4)3 + H2) = 2 Al(OH)3↓ + 3H2S↑+ 3(NH4)2SO4
3. Сухой хлорид аммония NH4Cl выделяет из растворов комплексных солей алюминия (тетрагидроксоалюминат калия) осадок гидроксида алюминия:
K[Al(OH)4] + NH4Clтв. = Al(OH)3↓ + KCl + NH3↑ + H2O
[Al(OH)4]- + NH4- = Al(OH)3↓ + NH3↑ + H2О
4. Получение «тенаровой сини». Разбавленный раствор нитрата кобальта (III) образует с солями алюминия алюминат кобальта, образующий при сжигании золу синего цвета:
2Al2(SO4)3 + 2Co(NO3)2 = 2Co(AlO2)2 + 6SO3↑ + 4NO2↑ + O2↑
4.Образуйте заданную комплексную частицу в соединение и укажите для него:
- внешнюю координационную сферу;
- внутреннюю координационную сферу;
- комплексообразователь;
- лиганды;
- координационное число;
- назвать полученные соединения.
[Pt(Cl6)]*, где Pt4+
-Внутренняя координационная сфера- [Pt(Cl6)]
-Комплексообразователь- Pt4+
-Лиганды- Cl-
-КЧ-1
5.Составьте уравнения гидролиза солей:
NaNO3, Ca(CN)2, MgS, Cu(NO3)2, , K2CO3, FeSO4.
| <== предыдущая | | | следующая ==> |
| Менеджмент и культура качества на промышленном предприятии. | | | Поле заряженной бесконечной плоскости |
Date: 2016-07-22; view: 529; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |