
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Подведение ацетилхолина и норадреналина
|
|
| Подводимый медиатор | Xapaктер реакции | Средняя интенсивность реакции | |||||
| контроль (n=26) | адаптация (n=48) | ||||||
| фон | подведение нейромедиатора | изменение, % | фон | подведение медиатора | изменения, % | ||
| Ацетилхолин | Активация | 2,5+0,6 | 4,9±0,9 | +96 | 2,0±0,3 | 3,4±0,5 | +70,0 |
| Отсутствие реакции | 3,6+0,7 | 3,5+0,7 | -3 | 3,9±0,3 | 3,9+0,3 | ||
| Торможение | 3,1±1,1 | 1,6+0,8 | —49 | 3,1±0,7 | 2,1±0,2 | —82 | |
| Норадреналин | Активация | 2,2±0,5 | 4,5±0,8 | + 104 | 2,9+0,3 | 3,9+0,3 | +34 |
| Отсутствие реакции | 2,4±0,5 | 2,7+0,6 | + 12 | 3,2±0,2 | 3,1±0,2 | —3 | |
| Торможение | 2,6+1,0 | 0,6±0,2 | —77 | 3,2±0,4 | 2,1+0,5* | —34 | |
| Примечание, n — число зарегистрированных нейронов. * р<0,05. |
изменений фоновой активности, выраженности средней реакции на подведение нейромедиаторов. Данные, приведенные в табл. 18, показывают, что средняя величина реакции нейронов на ацетилхолин и норадреналин у адаптированных животных намного меньше, чем у контрольных. При этом более значительно у адаптированных животных снижалась реакция на норадреналин. Так, в случае активации интенсивность реакций нейронов на норадреналин у контрольных животных возрастала на 100%, а у адаптированных— всего на 34%, в случае торможения интенсивность реакций нейронов у контрольных животных снижалась на 77%, а у подопытных — на 34%. Реакции на ацетилхолин также оказались достаточно ослабленными, хотя и в меньшей степени, чем на норадреналин, и эти изменения были на грани достоверности
Оценивая этот новый факт, следует иметь в виду два возможных его объяснения. Во-первых, доказанная выше активация в мозгу центральных стресс-лимитирующих систем — накопление в соответствующих центрах опиоидных пептидов, серотонина, ГАМК, может подавлять реактивность и прежде всего адренореактивность корковых нейронов, предупреждая тем самым запуск нейродинамического процесса, который по современным представлениям реализуется в ответ на действие эндогенного или экзогенного стрессора и приводит к нарушениям сердечного ритма, т. е. возникает ситуация, показанная на схеме 4.
Во-вторых, в результате интенсивного афферентного потока и увеличенного выделения медиаторов в пресинаптические пространства нейронов во время повторных стрессорных воздействий на уровне синаптической мембраны может осуществляться про-
цесс десенситизации нейронов. Этот процесс является одной из возможных причин общего снижения хемореактивности нейронов к различным медиаторам.
Независимо от механизма обнаруженного факта следует учитывать, что несмотря на доказанное нами весьма значительное уменьшение числа корковых нейронов, реагирующих на основные медиаторы нервного возбуждения, все основные поведенческие.реакции и, в частности, выработка пищевых и оборонительных условных рефлексов у адаптированных к стрессу животных протекают нормально. По-видимому, мы встречаемся с ситуацией, когда эти реакции обеспечиваются меньшим числом нейронов, за счет более эффективного осуществления их управляющей функции, т.е. наблюдаем одну из главных характерных черт долговременной адаптации — ее экономичность.
В плане нашего изложения характерно то, что увеличение физиологических возможностей стресс-реализующих и стресс-лимитирующих систем развивается не только при адаптации к собственно стрессорным ситуациям, но также при адаптации к физическим нагрузкам, высотной гипоксии и т. д., причем, многие из этих факторов обладают своим специфическим и достаточно выраженным кардиопротекторным действием. На этом основании в дальнейших исследованиях мы использовали адаптацию к физическим нагрузкам и высотной гипоксии для экспериментальной профилактики и терапии нарушений электрической стабильности сердца при острой ишемии и постинфарктном кардиосклерозе.
Известно, что адаптация к физическим нагрузкам приводит к увеличению «насосной» функции сердца, а также амплитуды, скорости сокращения и расслабления изолированных препаратов миокарда адаптированных животных, работающих в изотоническом режиме [Меерсон Ф. 3., 1975; Меерсон Ф. 3. и др., 1976]. Одновременно, на изолированном сердце таких животных определяется повышение электрического порога фибрилляции [Noakes T. et al., 1983], а в условиях целого организма доказано значительное повышение резистентности сердца таких животных к фибрилляции, возникающей при острой ишемии [Ammann L. et al., 1972]. Однако эти экспериментальные данные, полученные в результате адаптации животных к сравнительно небольшим нагрузкам, находятся в глубоком противоречии с цитированными выше исследованиями последних десятилетий, которые свидетельствуют, что у высокотренированных людей могут наблюдаться нарушения электрической стабильности сердца и внезапная сердечная смерть. Действительно, имеются многочисленные данные о нарушении сердечного ритма у спортсменов [Дембо А. Г. и др., 1977; Pantano J. et al., 1982]. В частности, Н. Ector и соавт. (1984) описывают группу из 17 спортсменов высокого класса с разными видами блокад, у 7 из которых был поставлен водитель сердечного ритма. Эта совокупность данных позволяет предполагать, что сократительная функция и электрическая стабильность сердца могут неодинаково меняться при адаптации к нагрузкам различной
интенсивности, и, соответственно, при возникновении ишемического повреждения адаптация может либо предупреждать, либо, напротив, потенцировать нарушения электрической стабильности и сократительной функции сердца. Для проверки этого предположения мы совместно с Е. Е. Устиновой, А. С. Чинкиным (1987) сопоставляли влияние адаптации к умеренным и интенсивным физическим нагрузкам на сократительную функцию, параметры электрической стабильности сердца и затем оценивали влияния обоих этих вариантов адаптации на резистентность сердца животных к экспериментальному инфаркту.
Опыты проводили на крысах-самцах линии Вистар, массой 310—390 г и предусматривали сопоставление результатов, полученных на 2 последовательно приведенных этапах эксперимента. Первый этап состоял из 4 серий, проводившихся в марте. 1-я серия — контрольные животные; 2-я — животные, адаптированные к физической нагрузке в умеренном режиме; 3-я — животные, у которых воспроизводился экспериментальный инфаркт миокарда, 4-я — животные, адаптированные к физической нагрузке в умеренном режиме, у которых затем воспроизводился экспериментальный инфаркт. Эксперименты второго этапа предусматривали аналогичные 4 серии, проводились в мае и отличались только тем, что адаптация животных проводилась в интенсивном режиме.
Животные, адаптирующиеся в умеренном режиме, плавали ежедневно, 5 раз в нед по 1 ч, в течение 7 нед (tводы+32°С). Животные, адаптирующиеся в интенсивном режиме, плавали, начиная с 22-го дня адаптации, с
Таблица 19. Показатели электрической стабильности сердца при адаптации к умеренным нагрузкам и инфаркте миокарда
| Вариант опытов | Порог фибрилляции желудочков, мА | Порог вагусной брадикардии, В | ЧСС в минуту | Эффект стимуляции блуждающего нерва | ||||
| 1 порог | 3 порога | |||||||
| —Δ ЧСС, % | число экстрасистол | — Δ ЧСС, % | число экстрасистол | |||||
| Контроль (11) | 6,1+0,6 | 0,28 + 0,003 | 413±15 | 16+.2 | 64 ±4 | |||
| Адаптация к умеренным нагрузкам (11) | 9,8+0,9* | 0,35+0,03 | 379+13 | 8±2* | 54+4 | |||
| Инфаркт (10) | 2,2+0,3* | 0,37+0,02 | 424+8 | 17+2 | 3,0±1,0 | 74±5 | 8,6±1,9 | |
| Адаптация к умеренным нагрузкам + инфаркт (10) | 6,4±0,8** | 0,39±0,02 | 413+10 | 13±1 | 60±4 | 0,4±0,3** | ||
| Примечание. Цифры в скобках — число животных; — ΔЧСС — уменьшение частоты сердечных сокращений в % от исходного. * Отличия от варианта «контроль» достоверны. ** Отличия от варианта «инфаркт» достоверны. |
Таблица 20. Сократительная функция сердца (M±m) при адаптации к умеренным нагрузкам и инфаркте миокарда
| Показатели | Вариант опытов | |||
| контроль (11) | адаптация к умеренным нагрузкам (11) | инфаркт (10) | адаптация + + инфаркт (10) | |
| До пережатия аорты | ||||
| Развиваемое давление, мм рт. ст. | 93±6 | 97±9 | 53±11* | 62±4 |
| ЧСС в минуту | 339±22 | 341±12 | 273±30 | 283±11 |
| ИФС, мм рт. ст. • мг—1 • мин—1 | 46±5 | 45±6 | 23±6* | 26±2 |
| Скорость сокращения, мм рт. ст./с | 5300±500 | 5400±300 | 3500±500* | 2100±6 |
| Скорость расслабления, мм рт. ст./с | 2800±300 | 3100±300 | 2100±500 | 2800±300 |
| Во время пережатия аорты, 120-я секунда | ||||
| Развиваемое давление, мм рт. ст. | 192±12 | 222±8 | 111±16* | 160±10** |
| ЧСС в минуту | 276±20 | 307±12 | 243±20 | 279±16 |
| ИФС, мм рт. ст. • мг—1 • мин—1 | 75±4 | 88±4 | 38±4* | 53±4** |
| Скорость сокращения, мм рт. ст./с | 8000+900 | 8200±700 | 3400±500* | 4800±300* |
| Скорость расслабления, мм рт. ст./с | 3000±400 | 3400±400 | 2000±200* | 2900±200* |
| Примечание. Цифры в скобках — число животных. * Отличия от варианта «контроль» достоверны. ** Отличия от варианта «инфаркт» достоверны. |
грузом, составляющим 2,5% массы тела, а начиная с 29-го дня адаптации— с 5% грузом в течение 4 ч на протяжении 7 нед.
Инфаркт миокарда воспроизводился путем перевязки левой коронарной артерии по Н. Selye и соавт. (1960).
Для определения электрического порога фибрилляции и эктопической активности сердца животных брали в острый опыт спустя 2 сут.
Сократительную функцию левого желудочка сердца оценивали по внутрижелудочковому давлению. По кривой давления рассчитывали развиваемое и диастолическое давление, максимальные скорости сокращения и расслабления, частоту сердечных сокращений и интенсивность функционирования структур (ИФС). Резистентность сердца к изометрической нагрузке определяли путем полного пережатия аорты. Гипертрофию сердца определяли по величине его относительной массы, которая при адаптации к умеренным нагрузкам была увеличена на 7%, а при адаптации к интенсивным нагрузкам — на 19%.
Данные, представленные в табл. 19 и 20, характеризуют влияние адаптации к умеренным нагрузкам на основные показатели электрической стабильности и сократительной функции сердца. Из табл. 19 следует, что адаптация к умеренным нагрузкам приводит к повышению порога фибрилляции желудочков примерно в
1,5 раза. Через 2 сут после создания экспериментального инфаркта порог фибрилляции желудочков оказался снижен почти в 3 раза, а у животных, адаптированных к физическим нагрузкам в умеренном режиме он не отличался от контрольного уровня.
У адаптированных животных пороговая сила тока, необходимая для вызова вагусной брадикардии, увеличена, а сама брадикардия по сравнению с контролем выражена незначительно. Определение эктопической активности сердца показало, что у контрольных и адаптированных животных на фоне вагусной брадикардии экстрасистолы не наблюдаются, а при инфаркте при той же самой степени брадикардии в течение 30 сраздражения током пороговой величины наблюдалось в среднем 3 экстрасистолы, т. е. инфаркт приводил к возникновению эктопических очагов возбуждения в сердечной мышце. Адаптация к умеренным нагрузкам практически полностью предупреждает это явление — брадикардия у животных с инфарктом практически не сопровождалась экстрасистолией.
Таким образом, адаптация к умеренным физическим нагрузкам приводит к повышению порога фибрилляции желудочков, предотвращает снижение этого порога и понижает эктопическую активность при инфаркте миокарда.
Данные, представленные в табл. 20, показывают, что адаптация к умеренным физическим нагрузкам не влияет на показатели силы и скорости сокращения сердца как в условиях физиологического покоя, так и максимальной изометрической нагрузки сопротивлением, вызванной полным пережатием аорты. Видно, что предварительная адаптация к умеренным нагрузкам достоверно ограничивает депрессию сократительной функции сердца, закономерно наблюдающуюся через 2 сут после воспроизведения инфаркта миокарда. Этот защитный эффект адаптации наиболее выражен при максимальной изометрической нагрузке, при которой у адаптированных.животных почти все показатели сократительной функции достоверно выше, чем у неадаптированных; он особенно велик для скорости расслабления, которая у адаптированных животных с инфарктом не отличается от контроля.
Таким образом, адаптация к умеренным физическим нагрузкам не только увеличивает насосную функцию сердца, амплитуду, скорость сокращения и расслабления препаратов изолированного сердца, работающих в изотоническом режиме, как это было описано выше [Меерсон Ф. 3., Капелько В. И., Пфайфер К., 1976; Капелько В. И., 1978], но также повышает порог фибрилляции сердца, т. е. увеличивает степень его электрической стабильности и, следовательно, уменьшает вероятность возникновения как фибрилляции, так и недостаточности сердца при инфаркте. Оценивая повышение электрической стабильности при адаптации к умеренным физическим нагрузкам и ее защитный, главным образом антиаритмический, эффект, следует учитывать, что такого рода адаптация, не вызывая существенной гипертрофии сердца, приводит вместе с тем к избирательному увеличению массы структур
СПР, ответственных за транспорт Са2+. Одновременно в сарколеммальной мембране при указанной адаптации на 25% увеличивается общее содержание фосфолипидов и на 50% —содержание фосфатидилсерина, который играет важную роль в связывании сарколеммой Са2+ [Tibbits G. et al., 1981 b]. Имеются также данные, что адаптация к физическим нагрузкам увеличивает содержание фосфатидилхолина и фосфатидилинозитола в мембранах кардиомиоцитов, а эти фосфолипиды играют важную роль в функционировании АТФаз, ответственных за ионный транспорт [Лешкевич Л. Г., Клатт А., 1972]. Можно полагать, что избирательный рост мембранных структур и адаптивная перестройка липидного метаболизма в них играют роль в повышении электрической стабильности и антиаритмическом эффекте адаптации. Другой фактор, несомненно участвующий в механизме этого эффекта, связан с изменением регуляции сердца и состоит в том, что адаптация ограничивает возбуждение адренергической системы при стрессорных ситуациях, к которым несомненно относится возникновение острой ишемии [Меерсон Ф. 3., 1984]. Соответственно установлено, что повышение цАМФ при острой ишемии, потенцирующее повреждение миокарда, значительно меньше выражено у тренированных животных [Noakes Т. et al., 1983].
Данные, представленные в табл. 21 и 22, характеризуют влияние адаптации к интенсивной нагрузке и инфаркта миокарда на параметры электрической стабильности и сократительной функ-
Таблица 21. Показатели электрической стабильности сердца при адаптации к интенсивной нагрузке и инфаркте миокарда
| Вариант опытов | ЧСС в минуту | Порог фибрилляции желудочков, мА | Эффект стимуляции блуждающего нерва | ||||
| 1 порог | 3 порога | ||||||
| порог вагусной брадикардии, В | — Δ ЧСС, % | число экстрасистол | -Δ ЧСС, % | число экстрасистол | |||
| Контроль (8) | 401±12 | 6,0±0,6 | 0,39±0,03 | 13±1 | 45±4 | ||
| Адаптация к интенсивным нагрузкам (8) | 358±23 | 6,6±1,2 | 0,56±0,01* | 13±2 | 48±4 | ||
| Инфаркт (9) | 445±15 | 2,3±0,5* | 0,69±0,03** | 16±2 | 4,0±2 | 65±5 | 5,7±2,4 |
| Адаптация к интенсивным нагрузкам + инфаркт (9) | 417±7 | 3,1±0,6* | 0,65±0,02* | 17±2 | 3,8±1 | 61±4 | 5,4±1,9 |
| Примечание. Цифры в скобках — число животных. * Отличия от варианта «контроль» достоверны. ** Отличия от варианта «инфаркт» достоверны. |
Таблица 22. Сократительная функция сердца (M±m) при адаптации к интенсивным нагрузкам и инфаркте миокарда
| Показатели | Вариант опытов | |||
| контроль (8) | адаптация к интенсивным нагрузкам (8) | инфаркт (9) | адаптация + + инфаркт (9) | |
| До пережатия аорты | ||||
| Развиваемое давление, мм рт. ст. | 118±8 | 109±8 | 71±7* | 61±5 |
| ЧСС в минуту | 358±21 | 313±18 | 371±30 | 364±22 |
| ИФС, мм рт. ст. • мг—1 • МИН—1 | 65±3 | 55±4 | 38±5* | 30±3 |
| Скорость сокращения, мм рт. ст./с | 7000±300 | 6900±400 | 3800±400* | 3200±300 |
| Скорость расслабления, мм рт. ст./с | 3800±200 | 3300±300 | 2100±200* | 1900±200 |
| Во время пережатия аорты, 120-я секунда | ||||
| Развиваемое давление, мм рт. ст. | 208±4 | 270±10* | 161±7* | 135±8** |
| ЧСС в минуту | 272±14 | 272±16 | 284±29 | 257±18 |
| ИФС, мм рт. ст. • мг—1 • мин—1 | 87±7 | 114±9* | 66±8* | 45±5** |
| Скорость сокращения, мм рт. ст./с | 7900±400 | 12 700±700* | 6600±400* | 4700±500** |
| Скорость расслабления, мм рт. ст./с | 3500±300 | 4800±400* | 2500±200* | 2600±200 |
| Примечание. Цифры в скобках — число животных. * Отличия от варианта «контроль» достоверны. ** Отличия от варианта «инфаркт» достоверны. |
ции сердца. Из данных табл. 21 следует, что адаптация к интенсивной нагрузке в отличие от рассмотренной выше адаптации к умеренной нагрузке не повлияла на порог фибрилляции сердца и величину вагусной брадикардии; на фоне брадикардии у адаптированных и контрольных животных экстрасистол не наблюдалось. Как и в предыдущей серии, инфаркт миокарда почти в 3 раза снизил порог фибрилляции желудочков, увеличил порог отрицательного хронотропного эффекта раздражения блуждающего нерва и брадикардию, возникающую при таком раздражении. На фоне брадикардии у инфарктных животных закономерно возникали экстрасистолы. Предварительная адаптация к интенсивным нагрузкам не предотвратила снижение порога фибрилляции и экстрасистолию при инфаркте миокарда. В табл. 22 представлены данные по влиянию адаптации к интенсивным нагрузкам на сократительную функцию сердца. Показано, что адаптация к интенсивным нагрузкам достоверно на 30% увеличивает развиваемое левым желудочком давление при пережатии аорты, не оказывает при этом закономерного влияния на частоту сердечных
сокращений и соответственно ИФС на этом этапе эксперимента возрастает примерно на 30%. Одновременно такая адаптация увеличивает скорость сокращения и расслабления в условиях изометрического режима в среднем на 60%, т. е. дает эффект, которым не обладает адаптация к умеренным нагрузкам. Далее из табл. 22 следует, что на фоне сформировавшейся адаптации к интенсивным нагрузкам инфаркт миокарда приводит к такой же или большей депрессии всех определявшихся параметров сократительной функции по сравнению с неадаптированными животными.
Действительно, величины ИФС в условиях изометрической нагрузки у адаптированных животных, перенесших инфаркт миокарда, оказались на 37%, а скорость сокращения на 29% меньше, чем у неадаптированных животных с инфарктом.
Таким образом, результаты этого этапа экспериментов показывают, что адаптация к интенсивным физическим нагрузкам совершенно не защищает сердце от ишемического повреждения, как по показателям электрической стабильности, так и по параметрам сократительной функции; такая адаптация не может рассматриваться как фактор, предупреждающий фибрилляцию или недостаточность сердца при инфаркте. Этот результат соответствует упомянутым выше данным о влиянии больших тренировочных нагрузок на состояние сердца у людей и дает основание полагать, что в диапазоне высоких уровней тренированности, когда сократительная функция сердца заведомо велика, его электрическая стабильность уже не возрастает, а, напротив, относительно легко может быть нарушена при возникновении эпизодов стресса и ишемии, что объясняет многочисленные случаи внезапной смерти у спортсменов высокого класса и дает основание предостеречь против большой интенсивности тренировок к физическим нагрузкам при использовании адаптации с целью профилактики и реабилитации.
Поскольку большие физические нагрузки у спортсменов сочетаются обычно с многочисленными соревновательными, т. е. по существу стрессорными ситуациями, можно полагать, что в этих условиях происходит перегрузка и своеобразное «изнашивание» стресс-лимитирующих регуляторных систем. Иными словами, цена адаптации оказывается слишком высокой и вместо защитного эффекта реализуется эффект противоположный — потенцирующий нарушения нервной регуляции и нарушения электрической стабильности сердца. Изучение стресс-лимитирующих систем в подобной ситуации и коррекция возникающих там нарушений представляются важной задачей дальнейших исследований. Несомненно, что главный итог этих и цитированных выше исследований по адаптации к физической нагрузке заключается в том, что при рациональной дозировке такая адаптация представляет собой важный фактор профилактики заболеваний системы кровообращения. Представленные данные говорят о том, что развитие адаптации к физическим нагрузкам и ее профилактические эффекты в
высокой степени детерминированы изменениями, развивающимися на уровне нейрогуморальной регуляции. Так, было показано, что. при адаптации к физическим нагрузкам наряду с важными изменениями в аппарате движения, системах дыхания и кровообращения развивается увеличение мощности и эффективности стресслимитирующих систем, а именно: системы опиоидных пептидов, антиоксидантной системы и т. д. Следует полагать, что эти важные регуляторные сдвиги наряду с изменениями метаболизма и структуры миокарда играют важную роль в профилактическом эффекте адаптации к физическим нагрузкам при стрессорных и ишемических нарушениях сердечного ритма.
Стресс-реакция возникает на первом этапе адаптации к любому фактору среды. Надо полагать, что одновременно всегда наблюдается также сопряженная активация стресс-лимитирующих систем, эффективность которых в процессе адаптации может существенно возрасти. Поэтому ограничение стресс-реакции, предупреждение и подавление нарушений сердечного ритма, по-видимому, могут быть достигнуты не только с помощью адаптации к стрессорным ситуациям или физическим нагрузкам, но и в результате постепенной адаптации к другим факторам окружающей среды. Одним из них является гипоксия, адаптация к которой характеризуется формированием разветвленного системного структурного «следа», охватывающего высшие регуляторные уровни и исполнительные органы. Однако до самого последнего времени возможность использования адаптации к гипоксии для предупреждения аритмий и фибрилляции сердца не изучалась. Между тем известно, что эта адаптация обладает выраженными перекрестными эффектами, т. е. повышает устойчивость организма не только к недостатку кислорода, но и к другим факторам: стрессорным ситуациям окружающей среды, эпилептогенам, галлюциногенам [Меерсон Ф. 3., Майзелис М. Д., 1973], ишемическим повреждениям [Меерсон Ф. 3. и др., 1972], гипертензивному эффекту избытка воды и солей [Меерсон Ф. 3. и др., 1973] и т. д. Также выяснилось, что адаптация к периодическому действию высотной гипоксии, проводимая в условиях барокамеры, предупреждает или ограничивает стрессорные или ишемические повреждения сердечной мышцы. Однако вопрос о том, можно ли при помощи предварительной адаптации предупредить или устранить аритмии и фибрилляцию сердца, играющие главную роль в патогенезе внезапной сердечной смерти, до последнего времени оставался открытым. Поэтому нами совместно с Е. Е. Устиновой и М. Е. Евсевьевой (1986) была выполнена работа, цель которой заключалась в том, чтобы оценить воздействие предварительной адаптации к гипоксии на устойчивость сердца к аритмогенному действию стресса и острой ишемии и определить, как влияет такая адаптация на стойкие нарушения электрической стабильности сердца, наблюдаемые обычно при постинфарктном кардиосклерозе, а также выяснить некоторые механизмы обнаруженных защитных эффектов.
Исследования выполнены на крысах-самцах линии Вистар; первый их этап предусматривал 3 серии экспериментов: в 1-й серии изучали влияние предварительной адаптации к гипоксии на нарушения параметров электрической стабильности сердца, наблюдаемые обычно при длительном иммобилизационном стрессе. Во 2-й серии оценивали влияние такой же адаптации на аритмии, сопровождавшие острую ишемию миокарда, вызывавшуюся в условиях бодрствования и закрытой грудной клетки. В обеих этих сериях адаптация использовалась как фактор экспериментальной профилактики. В 3-й серии адаптацию использовали как фактор экспериментальной терапии; для этого к гипоксии адаптировали животных, у которых за 2 нед до начала гипоксических воздействий воспроизводили экспериментальный инфаркт, и, таким образом, адаптация протекала на фоне постинфарктного кардиосклероза и могла влиять на его формирование. Методы воспроизведения иммобилизационного стресса, острой ишемии у ненаркотизированных животных по I. Lepran и экспериментального инфаркта миокарда по Н. Selye, на основе которого формировался постинфарктный кардиосклероз, были такими же, как описано выше.
Адаптацию к гипоксии проводили в барокамере; 1—2-й дни на «высоте» 1000 м в течение 2 ч, в дальнейшем каждые 2 дня высоту подъема увеличивали на 1000 м, достигая уровня 5000 м. После этого ежедневно увеличивали время пребывания в барокамере на 1 ч и доводили его до 6 ч. Всего крысы получили 45 гипоксических воздействий.
Так же как в описанных выше опытах, у контрольных животных порог фибрилляции колебался в пределах 6,8—8,1 мА, брадикардия при раздражении блуждающего нерва током, равным 4 порогам, выражалась снижением частоты сердечных сокращений с 330 до 120 в минуту, т. е. более чем на 60% и сопровождалась лишь одиночными экстрасистолами. После перенесенного иммобилизационного стресса порог электрической фибрилляции сердца составил 3,4—3,7 мА, т. е. оказался сниженным более чем в 2 раза. Степень брадикардии увеличилась, однако число экстрасистол возросло недостоверно. Каких-либо нарушений сократительной функции сердца не наблюдалось.
У животных, предварительно адаптированных к гипоксии, порог фибрилляции был таким же, как у интактных животных, а брадикардия, вызывавшаяся раздражением блуждающего нерва, оказалась на 40% меньше, чем в контроле, и не сопровождалась экстрасистолами. После иммобилизационного стресса у адаптированных животных не наблюдалось снижения порога фибрилляции сердца или нарушения его сократительной функции. Таким образом, хорошо известный в литературе и подробно описанный выше феномен постстрессорного снижения порога фибрилляции, воспроизводившийся в наших экспериментах, был полностью предупрежден предварительной адаптацией к высотной гипоксии.
Данные, полученные во второй серии опытов при изучении влияния предварительной адаптации к гипоксии на развитие фибрилляции сердца, обусловленной острой ишемией, свидетельствуют, что предварительная адаптация в 2 раза уменьшала число животных, у которых в ответ на острую ишемию возникали аритмии. Так, из 20 адаптированных животных аритмии в ответ на ишемию возникали у 10, в то время как в контроле аритмии возникали у всех 20 животных. При этом одновременно увеличи-
вался латентный период от возникновения ишемии до начала аритмий: у адаптированных животных он составлял 216±38 с при 176 ±33 с в контроле. Кроме того, у них в 2 раза сократилась суммарная длительность экстр асистолии (72 с при 158 с в контроле) и почти в 3 раза—суммарная длительность фибрилляции сердца, рассчитанная для всей группы животных (366 с при 998 с в контроле). В итоге смертность адаптированных животных от фибрилляции и остановки сердца оказалась в 2 раза меньше, чем у неадаптированных. Таким образом, предварительная адаптация в значительной степени предупреждает фибрилляцию и другие нарушения ритма сердца, вызванные острым прекращением кровотока в коронарной артерии у ненаркотизированных животных.
Таким образом, адаптация к гипоксии влияет на нервную регуляцию сердца, увеличивает его резистентность к стрессорным повреждениям, она избирательно активирует рост коронарного русла, увеличивает концентрацию миоглобина в миокарде и соответственно повышает резистентность сердца к ишемическим повреждениям. Поэтому профилактическое антиаритмическое действие адаптации к гипоксии может быть оценено как простое следствие антистрессорного и антиишемического эффекта такой адаптации.
Очевидно, что при постинфарктном кардиосклерозе — через 2 мес после воспроизведения инфаркта — стресс и ишемия отсутствуют, и, следовательно, изучение влияния адаптации на этой модели создает определенные предпосылки для того, чтобы отдифференцировать собственно антиаритмический эффект от антистрессорного и антиишемического.
Данные, представленные в табл. 23, отражают суммарные результаты для каждой из сравнивавшихся 4 групп животных и позволяют подчеркнуть, что при постинфарктном кардиосклерозе
Таблица 23. Электрическая стабильность сердца при постинфарктном
Кардиосклерозе
| Вариант опытов | Порог фибрилляции, мА | Число экстрасистол за 30 с вагусной брадикардии при раздражении вагуса силой тока в 3 порога |
| Контроль (10) | 8,1±0,3 | |
| Постинфарктный кардиосклероз (11) | 3,7±0,7* | |
| Адаптация к гипоксии (10) | 7,9±0,4 | |
| Постинфарктный кардиосклероз + адаптация к гипоксии (10) | 6,4±0,4** | |
| Примечание. Цифры в скобках — число животных. * Отличия от варианта «контроль» достоверны. ** Отличия от варианта «постинфарктный кардиосклероз» достоверны. |
через 2 мес после воспроизведения инфаркта порог фибрилляции у животных снижен более чем в 2 раза, а на фоне вагусной брадикардии имеется значительное число экстрасистол, которые отсутствуют в контроле. Таким образом, в соответствии с опытом клиники и результатами ранее выполненных экспериментов постинфарктный кардиосклероз увеличивает эктопическую активность сердца и вероятность возникновения его фибрилляции. Из табл. 23 также следует, что адаптация, примененная на фоне существующего постинфарктного кардиосклероза, приводит к восстановлению порога фибрилляции практически до контрольного уровня и исчезновению экстрасистол, возникающих на фоне вагусной брадикардии, т. е. адаптация к гипоксии приводит к подавлению эктопической активности сердца и снижает до контрольного уровня вероятность фибрилляции сердца при постинфарктном кардиосклерозе.
Данные, представленные в табл. 24, характеризуют сократительную функцию сердца при постинфарктном кардиосклерозе и
Таблица 24. Сократительная функция левого желудочка при постинфарктном кардиосклерозе
| Вариант опытов | Развиваемое давление, мм рт. ст. | ||
| пережатие аорты | |||
| в покое | 5-я секунда | 30-я секунда | |
| Контроль (10) | 95±4 | 150±7 | 159±7 |
| Постинфарктный кардиосклероз (11) | 65±9* | 137±18 | 62±10* |
| Адаптация к гипоксии (10) | 113±4* | 181±9* | 181±10* |
| Постинфарктный кардиосклероз + адаптация к гипоксии (10) | 88±8** | 163±12 | 149±14** |
| Примечание. Цифры в скобках — число животных. * Отличия от варианта «контроль» достоверны. ** Отличия от варианта «постинфарктный кардиосклероз» достоверны; р<0,05. |
адаптации к гипоксии. Наиболее яркий факт, представленный в таблице, заключается в том, что на 30-й секунде пережатия аорты максимальное развиваемое давление, по существу отражающее развиваемую силу сокращений левого желудочка сердца, остается таким же, как на 5-й секунде пережатия. Таким образом, адаптация к гипоксии, использованная как фактор экспериментальной профилактики, устраняет нарушения электрической стабильности и сократительной функции сердца, характерные для постинфарктного кардиосклероза.
Можно предположить, что наблюдавшееся в наших экспериментах под влиянием адаптации к гипоксии устранение этих явлений и уменьшение вероятности аритмий определяется действием
адаптации как на уровне нервной регуляции, так и на уровне сердца, что заслуживает специального изучения.
Осуществляющийся на уровне нейрогуморальной регуляции эффект адаптации к гипоксии проявляется, как было упомянуто выше, стационарной активацией синтеза РНК и белка в головном мозге, увеличением мощности адренергической регуляции, т. е. гипертрофией симпатических нейронов и надпочечников и увеличением содержания катехоламинов в последних, при одновременной частичной атрофии супраоптических ядер гипоталамуса и клубочковой зоны надпочечников, т. е. структур, ответственных за секрецию вазопрессина и альдостерона. Этот комплекс изменений объясняет противогипертензивный эффект адаптации к гипоксии, но не дает ответ на вопрос, почему адаптированные животные более резистентны к стрессу, более устойчивы к эпилептогенам, галлюциногенам.
Неясным остается механизм эффективного поведения адаптированных животных в конфликтных ситуациях, где у них проявляется замечательная способность успешно реализовать жизненно важный питьевой рефлекс вопреки действию сильного болевого раздражителя [Меерсон Ф. 3., 1973]. Непонятно также, как связаны эти изменения нейрогуморальной регуляции с наблюдавшимся нами антиаритмическим эффектом адаптации.
В соответствии с развиваемым представлением мы предположили, что антистрессорный, поведенческий и, наконец, антиаритмический защитные эффекты адаптации к гипоксии могут быть связаны с активацией стресс-лимитирующих систем головного мозга. Исходя из этого, в совместных исследованиях с А. Д. Дмитриевым и Э. X. Орловой мы оценили состояние одной из этих систем — системы опиоидных пептидов при адаптации к гипоксии.
Для этого радиоиммунологическим методом определяли содержание наиболее активного пептида этой группы — β-эндорфина — в различных структурах головного мозга и надпочечниках у адаптированных к гипоксии и неадаптированных животных в контроле и после тяжелого эмоционально-болевого стресса. Адаптация к гипоксии проводилась в условиях барокамеры на высоте 5000 м в течение 8 нед по 6 ч в день 5 раз в нед.
В табл. 25 представлены данные о содержании β-эндорфина— опиоидного пептида, обладающего анальгетическим действием и подавляющего возбуждение адренергической регуляции в трех различных структурах головного мозга и надпочечниках. Из табл. 25 видно, что сама по себе адаптация к гипоксии порождает лишь некоторую тенденцию к увеличению содержания β-эндорфинов. Эмоционально-болевой стресс, напротив, вызывает у неадаптированных животных значительное, в 1,5—4 раза снижение концентрации β-эндорфинов в коре, стриатуме, мозжечке. У адаптированных животных такой же стресс, напротив, никакого существенного изменения концентрации β-эндорфинов в структурах головного мозга не вызывает. Для понимания этой замечательной способности мозга адаптированных животных сохранять нормаль-
Таблица 25. Содержание β-эндорфина в мозге и надпочечниках при эмоционально-болевом стрессе (M+m)
| Концентрация β-эндорфина, фмоль/мг | ||||
| Вариант опытов | кора | стриатум | мозжечок | надпочечники |
| Контроль | 2,44±0,69 | 5,67±1,75 | 2,14±0,44 | 1,22±0,31 |
| (9) | (9) | (10) | (10) | |
| Стресс | 0,63±0,11 | 1,30±0,29 | 1,38±0,69 | 0,78±0,28 |
| (9) —74,3%* | (8) —77%* | (8) | (6) —36,6%* | |
| Адаптация | 2,81±0,65 | 6,99±2,15 | 2,94±0,53 | 5,07±1,70 |
| (7) | (9) | (8) | (5) | |
| +314%* | ||||
| Адаптация + стресс | 2,03±0,76 | 5,45±2,07 | 3,04±1,10 | 0,58±0,15 |
| (8) | (8) | (9) | (8) | |
| —89%** | ||||
| Примечание. Цифры в скобках — число животных. * Отличия от варианта «контроль» достоверны. ** Отличия от варианта «адаптация» достоверны. |
ную концентрацию β-эндорфинов, несмотря на стресс, следует обратить внимание на последнюю графу таблицы, где представлены данные о концентрации β-эндорфина в надпочечниках. Видно, что адаптация к периодической высотной гипоксии, продолжающаяся в наших опытах 1,5 мес, приводит к увеличению концентрации β-эндорфинов в надпочечниках более чем в 4 раза. При стрессе мобилизация этого большого дополнительного резерва β-эндорфина оказывается еще более полной, чем у неадаптированных животных. В итоге не трудно подсчитать, что стрессорный выброс β-эндорфинов из надпочечников адаптированных животных более чем на порядок выше, чем в контроле. Поскольку известно, что β-эндорфины ограничивают возбуждение адренергических структур головного мозга, играющих важную роль в механизме аритмий и фибрилляции сердца, а также действуют подобно морфию, как анальгетики, то не трудно предположить, что показанное нами при адаптации к гипоксии увеличение мощности опиоидной системы является одним из факторов, играющих роль в предупреждении фибрилляции сердца при острой ишемии.
Представляет интерес сопоставление данных об увеличении резерва β-эндорфина в надпочечниках при адаптации к гипоксии с результатами наших ранее выполненных работ [Меерсон Ф. 3., Пшенникова М. Г., Матлина Э. Ш., 1977; Пшенникова М. Г., 1980], в которых было показано, что при адаптации к этому фактору в надпочечниках закономерно увеличивается концентрация норадреналина и адреналина, а при стрессе на фоне такой адаптации многократно возрастает выброс этих катехоламинов из надпочечников. Эта корреляция между опиоидным пептидом и норадреналином является не только качественной, но и количественной. Так, адаптация увеличивает стрессорный выброс р-эндорфина
с 0,44 до 4,49 фмоль/мг, а стрессорный выброс норадреналина с 40 мкг до 400 мкг/г надпочечника, таким образом, выброс норадреналина и ограничивающего его эффекты опиоидного пептида оказался увеличенным у адаптированных животных в одинаковой степени — на один порядок. Это наблюдение соответствует известному факту, что в надпочечниках катехоламины и опиоидные пептиды синтезируются в одних и тех же гранулах, и нашему представлению о прочном сопряжении стресс-реализующих и стресслимитирующих систем.
В целом изложенное свидетельствует, что тормозные регуляторные системы могут играть существенную роль в антиаритмическом эффекте адаптации к гипоксии.
Вместе с тем очевидно, что в этом эффекте играют роль адаптационные изменения структуры и функции сердца: увеличение васкуляризации миокарда и эффективности систем его энергообеспечения. Нами совместно с М. Е. Евсевьевой и Е. Е. Устиновой было проведено морфометрическое исследование, направленное на определение относительного объема рубца при постинфарктном кардиосклерозе, соотношения форменных элементов в рубце и васкуляризации прилегающей к рубцу зоны миокарда.
Для этого гистологические препараты окрашивали гематоксилин-эозином и по Ван-Гизону. Интенсивность васкуляризации пограничной зоны инфаркта миокарда и количественное соотношение форменных элементов в нем определяли с помощью стереометрических сеток [Автандилов Г. Г., Салбиев К. Д., 1974; Семенова Л. А. и др., 1985]. Для определения размеров рубца были использованы серийные гистотопографические срезы сердца, сделанные через каждые 2 мм ткани начиная от верхушки. В основу определения относительного объема рубцовой ткани был положен принцип Delesse, согласно которому поверхности структур относятся как их объемы [Непомнящих Л. М., 1981].
Результаты этих исследований представлены в табл. 26 и свидетельствуют, что рассмотренный выше антиаритмический эффект адаптации к гипоксии у животных с постинфарктным кардиосклерозом сопровождается уменьшением относительного объема рубцовой ткани в миокарде примерно на 1/3; при этом рубец оказался более плотным, удельный объем коллагеновых волокон в нем был увеличен, а удельный объем отечной стромы и всех без исключения форменных элементов уменьшен, т. е. под влиянием адаптации постинфарктный рубец уменьшился и стал более плотным.
Одновременно наблюдалось увеличение васкуляризации прилегающей к рубцу зоны миокарда: объемная плотность сосудов в этой зоне оказалась увеличенной на 1/3. Таким образом, прямой кардиопротекторный эффект адаптации к гипоксии несомненно может играть роль в ее терапевтическом действии при постинфарктном кардиосклерозе.
Другим выражением прямого кардиопротекторного действия адаптации является установленное в последнее время в нашей лаборатории повышение резистентности изолированного предсер-
Таблица 26. Соотношение гистологических структур в постинфарктном рубце и прилегающей к нему зоне миокарда (в %)
| Вариант опытов | ||
| Гистологические структуры | контроль | адаптация к гипоксии |
| Объемная доля рубцовой ткани | 25,2±0,17 | 18,7±0,09 |
| Объемная плотность сосудов пограничной зоны | 16,5±0,07 | 21,7±0,06 |
| Отечная строма | 1,5±0,03 | 0,5+0,05 |
| Коллагеновые и аргирофильные волокна | 56,0±0,26 | 65,2+0,31 |
| Фибробласты | 5,1+0,01 | 4,2+0,04 |
| Фиброциты | 5,2±0,04 | 8,0±0,03 |
| Полиморфно-ядерные лейкоциты | 0,5±0,01 | — |
| Лимфоциты | 11,2+0,19 | 8,1±0,09 |
| Плазматические клетки | 8,6±0,07 | 5,2±0,07 |
| Эозинофилы | 0,7+0,05 | 0,3±0,03 |
| Макрофаги | 10,2+0,28 | 7,5±0,2 |
дня к аритмогенному действию такого индуктора ПОЛ, как Н2О2. В этих экспериментах, выполненных В. А. Салтыковой и Е. Е. Устиновой, Н2О2 вводили в рабочую камеру, где спонтанно сокращались изолированные правые предсердия крыс.
В контроле реакция предсердия на действие Н2О2 проходит через 3 фазы. В 1-й фазе наблюдается выраженный хроно- и инотропный эффект, а также снижение напряжения покоя, т. е. расслабляющий эффект. Во 2-й фазе развивается выраженная брадикардия; наконец, 3-я фаза характеризуется брадиаритмией и остановкой сердца. Реакция предсердия адаптированных к гипоксии животных осуществлялась через те же фазы, однако брадикардия и брадиаритмия во 2-й и 3-й фазах была выражена меньше, и во многих случаях остановка сердца не возникала.
Кривые на рис. 22 количественно характеризуют результат эксперимента, в котором была сопоставлена реакция предсердий 20 контрольных и 20 адаптированных к гипоксии крыс на добавление Н2О2. Видно, что в контроле отдельные предсердия остановились ужена 1—2-й минуте, у адаптированных это произошло на 3—4-й минуте; в дальнейшем почти все предсердия контрольных животных прекратили сокращение, а более половины предсердий адаптированных животных продолжали сокращаться. В итоге на 20-й минуте после начала индукции ПОЛ сокращалось только 2 предсердия контрольных и 12 предсердий адаптированных животных. Эти данные свидетельствуют, что адаптация к гипоксии повышает резистентность автоматизма сердца к аритмогенному действию индукторов ПОЛ. Значимость этого факта определяется тем, что катехоламины, повреждающие сердце при стрессе и острой ишемии, также являются индукторами ПОЛ и вместе с тем обладают выраженным аритмогенным эффектом. Также существенно, что выполненные ранее биохимические ис-
| Рис. 22. Устойчивость спонтанно сокращающихся изолированных предсердий к Н202. Ордината — число сокращающихся предсердий; абсцисса — время от введения Н2О2 в инкубационную среду, мин. 1 — контроль; 2 — адаптация к высотной гипоксии. | 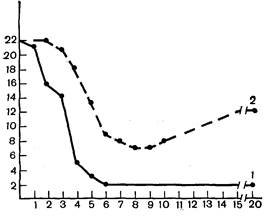
|
следования показали отсутствие при гипоксии какой-либо активации антиоксидантных ферментных систем или увеличения содержания витамина Е [Меерсон Ф. 3., Абдикалиев Н. А. и др., 1981]. Таким образом, антиаритмический эффект адаптации к гипоксии, реализующейся на уровне сердца, должен зависеть от каких-то иных факторов, например от изменения жирно-кислотного, фосфолипидного состава или структурной перестройки на уровне липидного бислоя мембран.
В целом полученные результаты свидетельствуют, что кардиопротекторный и, в частности, антиаритмический эффект адаптации к гипоксии может реализоваться как на уровне нейрогуморальной регуляции, так и на уровне самого сердца.
* * *
Рассмотренные выше данные о защитном эффекте адаптации к стрессорным ситуациям и другим факторам при аритмиях и фибрилляции сердца являются одним из наиболее важных в настоящее время доказательств перспективности адаптации к стрессорным ситуациям как фактора терапии и профилактики. В комплексе с данными, представленными в предудущих главах, это позволяет кратко резюмировать современные представления о развитии и механизме адаптации к стрессорным ситуациям, подобно тому, как это было сделано для адаптации к физическим нагрузкам и гипоксии. Прежде всего следует констатировать, что эта адаптация может реализоваться в двух формах: 1) она может развиваться как адаптация, которая является звеном или компонентом более широкого явления, а именно адаптации к физическим факторам или сложным биологическим и социальным ситуациям окружающей среды. Например, к большим физическим нагрузкам, значительной высоте, холоду, соревновательным или опасным для жизни ситуациям, в которых многократная стрессреакция составляет необходимое звено образования специальных
навыков или специфической устойчивости к совершенно конкретным факторам окружающей среды; в этом варианте процесса описанное выше увеличение мощности стресс-реализующих и стресс-лимитирующих систем сочетается с формированием системного структурного следа, на который опирается специфическая устойчивость к определенному физическому фактору или навык к специальной деятельности; 2) адаптация к стрессорным ситуациям, из которых нет реального выхода, т. е. процесс, обеспечивающий только выживание или «незаболевание» в течение определенного времени, процесс, детерминированный экспериментальными, природными или социальными условиями, который мы так же, как многие другие исследователи, воспроизводили в своих экспериментах в форме иммобилизационного или эмоционально-болевого стресса. Эта адаптация обеспечивается формированием достаточно своеобразного системного структурного следа, составляющего основу устойчивости к стрессорным, т. е. до поры до времени безвыходным ситуациям.
Содержание предыдущих глав и данные литературы позволяют констатировать, что формирование такой адаптации характеризуется теми же общими закономерностями что и формирование адаптации к другим факторам среды, и вместе с тем имеет важные отличительные черты. Общей закономерностью, по-видимому, является то, что адаптация к собственно стрессорным ситуациям проходит через те же характерные стадии, что и адаптация к любому другому фактору окружающей среды.
Действительно здесь можно наблюдать «аварийную» стадию, характеризующуюся большой стресс-реакцией, наличием повреждений внутренних органов и т. д., переходную стадию, когда координированное увеличение мощности стресс-реализующей и стресслимитирующих систем, обусловленное активацией биосинтеза нуклеиновых кислот и белков-ферментов в клетках этих регуляторных систем, ограничивает стресс, стрессорные повреждения и восстанавливает резерв стресс-реализующей системы. Далее развивается стадия устойчивой адаптации, когда высокая мощность стресс-лимитирующих модуляторных систем подавляет стресс-реакцию и устраняет повреждения. Наконец, необходимо постулировать четвертую стадию — стадию «изнашивания», которая характеризуется истощением стресс-лимитирующих систем, возобновлением стрессорных повреждений и развитием болезней, которые хорошо известны из литературы, рассматривающей повреждающие эффекты так называемого хронического стресса.
Вторая черта адаптации к стрессорным ситуациям заключается в том, что основой ее является разветвленный структурный «след», т. е. комплекс структурных изменений в стресс-реализующей и стресс-лимитирующих системах, которые были рассмотрены выше. Разумеется, структурная основа этой адаптации, т. е. молекулярные и морфологические изменения в указанных системах, еще недостаточно ясны и являются предметом дальнейших исследований.
Наконец, третьей общей закономерностью, присущей адаптации к стрессорным ситуациям, являются ее перекрестные эффекты, как положительные, составляющие основу экспериментальной профилактики и терапии, так и отрицательные, выражением которых является «цена» адаптации.
Главной отличительной чертой адаптации к стрессорным ситуациям является то, что она обеспечивается преимущественно интенсивной деятельностью определенных регуляторных механизмов при ограниченном включении в реакцию исполнительных эффекторных органов. Соответственно системный структурный «след» этой адаптации охватывает главным образом стресс-реализующие и стресс-лимитирующие центральные и периферические системы, т. е. локализован на регуляторном уровне. Поскольку регуляторные системы организма тесно связаны между собой, такой конструкции системного структурного «следа» данной адаптации соответствует необычайно широкий спектр ее перекрестных эффектов — от цитопротекторного на уровне желудка, антиаритмического на уровне сердца до антидепрессивного на уровне поведения.
Вместе с тем такой спектр перекрестных эффектов, в высокой степени предопределяющий способность к выживанию в реальных условиях окружающей среды, не предусматривает при данной адаптации формирования каких-либо специальных навыков, присущих другим, более специализированным реакциям приспособления и обладает отрицательными перекрестными эффектами (например, подавление функции половых желез, стрессорные заболевания и т. д.).
Это означает, что на современном этапе развития проблемы при планировании и организации адаптации к определенным факторам окружающей среды целесообразно первоначальное освоение сложных видов деятельности и лишь затем дальнейшая адаптация к дозированным стрессорным ситуациям постепенно нарастающей интенсивности.
В плане нашего изложения существенным является важный для медицины аспект адаптации к стрессорным ситуациям — возможность получить защитные эффекты этой адаптации, не применяя ее самой, а используя естественные метаболиты стресс-лимитирующих систем, их синтетические аналоги и, наконец, активаторы этих систем.
В следующей главе будут рассмотрены результаты исследований, в которых реализован такой подход применительно к аритмиям и фибрилляции сердца. Это связано с тем, что, несмотря на большие достижения в области создания антиаритмических препаратов [Каверина Н. В. и др., 1978; Самвелян В. М. и др., 1978; Розенштраух Л. В. и др., 1980] и тактики их применения (Дощицин В. Л., Меркулова И. Н., 1976; Янушкевичус 3. И. и др., 1976; Сметнев А. С., 1985], проблема терапии аритмий и профилактики внезапной смерти продолжает оставаться одной из важных в современной кардиологии.
Date: 2016-06-07; view: 429; Нарушение авторских прав