
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Второй закон термодинамики
|
|
Первый закон термодинамики не позволяет определить направление протекания процесса. То есть возможен процесс самопроизвольной передачи тепла от холодного тела к горячему.
Второй закон термодинамики утверждает, что невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от холодного тела к горячему. Из этого следует, что переход от неупорядоченного движения частиц к упорядоченному возможен лишь при условии, что он сопровождается каким-либо компенсирующим процессом.
Отношение теплоты Q, полученной телом в изотермическом процессе, к температуре T процесса, называется приведенным количеством теплоты Q*.
На малом участке процесса 1-2:
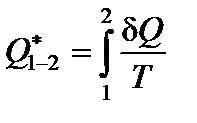 ;
;
Найдем приведенное количество теплоты, сообщаемое телу в обратимом цикле Карно.
 ;
;
Второй и четвертый интегралы равны нулю, так как  (адиабатные процессы)
(адиабатные процессы)
 (с учетом формулы (*)).
(с учетом формулы (*)).
Это справедливо для любого обратимого цикла.
 ;
;
В этом случае стоящее под интегралом выражение является полным дифференциалом некоторой функции S, т.е.

Функция S называется энтропией. dS и dQ имеют один и тот же знак. Значит, по характеру изменения энтропии можно судить о направлении процесса теплообмена.
Энтропия тела, подобно внутренней энергии, является однозначной функцией его состояния.
Энтропия изолированной системы при любых происходящих в ней процессах не может убывать
 .
.
Из определения энтропии следует, что
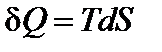
Запишем первый закон термодинамики
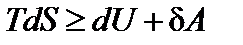
Здесь знак равенства относится к обратимым процессам, а знак неравенства – к необратимым.
Сделаем преобразования


 ;
;
Введем обозначение: 

 .
.
Таким образом, внутренняя энергия тела состоит из двух частей: F – называется свободной энергией. Это та энергия, которая может быть обращена в работу; TS – связанная энергия, которая не может быть передана в изотермическом процессе в форме работы. Энтропия является мерой связанности энергии.
Реальные газы
В отличие от идеального газа, молекулы реальных газов взаимодействуют между собой и имеют размер.
Уравнение состояния реальных газов впервые было получено Я. Ван-дер-Ваальсом и носит его имя.
 – для одного моля.
– для одного моля.
 – для произвольной массы газа.
– для произвольной массы газа.
 Рис. 34
Рис. 34
|
Рассмотрим изотерму с температурой T. Выделим на ней три участка AB, BC, CT:
Участок CT – процесс изотермического сжатия газа;
Участок BC – в точке С газ начинает конденсироваться в жидкость и в точке В газ полностью переходит в жидкое состояние.
Участок АВ – процесс сжатия жидкости.
 Рис. 35
Рис. 35
|
III – газ находится в газообразном состоянии. Приведенный (рис. 35) называется фазовой диаграммой, а различные формы существования газа называются фазами.
Жидкости
По своим свойствам жидкости сходны как с газами, так и с твердыми телами. Подобно газам они принимают форму любого сосуда, в котором находятся.
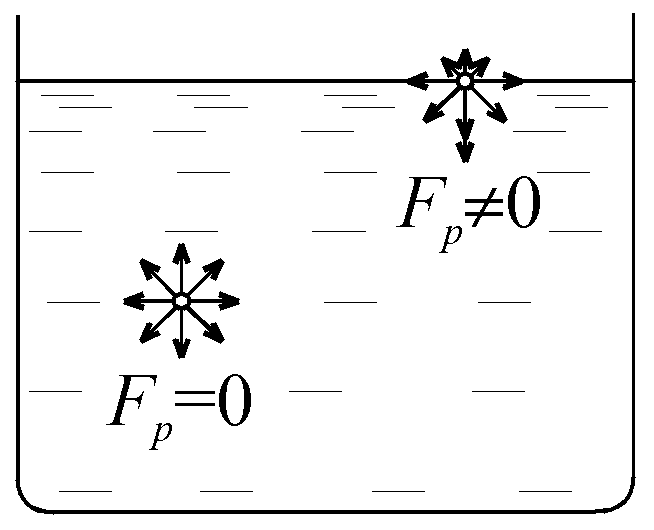 Рис. 36
Рис. 36
|
Рассмотрим молекулы внутри жидкости (рис. 36). Равнодействующая всех сил, действующих на молекулу, равна нулю. В поверхностном слое жидкости молекулы испытывают направленную внутрь силу притяжения.
При переходе молекул из внутренней части жидкости на поверхность они должны совершить работу против сил, направленных внутрь. Эта работа идет на увеличение потенциальной энергии молекул, перешедших в поверхностный слой. Таким образом поверхностный слой имеет повышенную энергию – поверхностную энергию. Поверхностный слой подобен растянутой упругой плёнке.
а) Рассмотрим горизонтально расположенную прямоугольную рамку с перекладиной ab (рис. 37), затянутую мыльной плёнкой. Если в одной части плёнку разорвать, то оставшаяся плёнка в другой части рамки сократит свои размеры и переместит перекладину на величину dx. Для возврата перекладины на прежнее место необходимо приложить силу
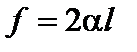

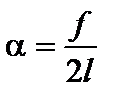 ;
;
α – называют коэффициентом поверхностного натяжения; 2α – так как плёнка имеет две поверхности. Сила f совершает работу
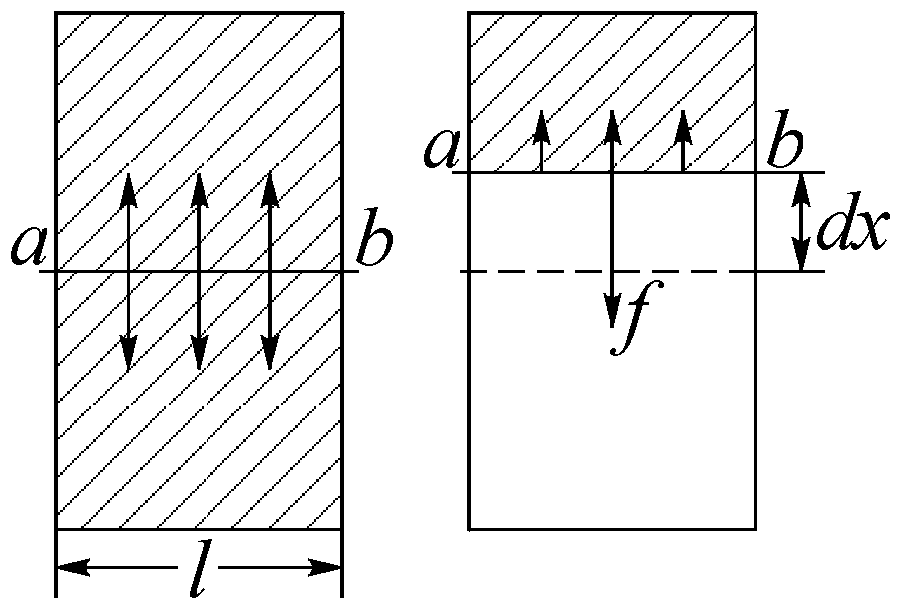 Рис. 37
Рис. 37
|
 ;
;
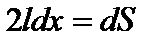

 .
.
Совершенная работа идет на увеличение энергии системы
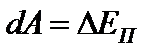 ;
; 
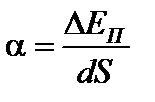 ;
;
Таким образом, коэффициент  – численно равен свободной энергии поверхностного слоя, площадь которого равна единице.
– численно равен свободной энергии поверхностного слоя, площадь которого равна единице.
Date: 2016-05-25; view: 547; Нарушение авторских прав