
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глубинное, или осаждающее, раскисление
|
|
Этот метод заключается в переводе растворенного в стали кислорода в нерастворимый оксид путем введения в металл определенного элемента-раскислителя. Элемент-раскислитель должен иметь большее химическое сродство к кислороду, чем железо. В результате реакции образуется малорастворимый в металле оксид, плотность которого меньше плотности стали. Поученный таким образом «осадок» всплывает в шлак (отсюда название метода «осаждающий»). Этот метод раскисления часто также называют «глубинным», так как раскис-лители вводят в глубину металла. В качестве раскислителей (табл. 14.1) обычно применяют марганец (в виде ферромарганца), кремний (в виде ферросилиция), алюминий, сплавы РЗМ (цезия, лантана и др.) и ЩЗМ.
Раскисление осуществляется по следующим реакциям:
[Мп] + [О] = (МпО),
[Si] + 2[0] =(Si02),
2[А1] + 3[0]=А1203(ТВ),
2[Се] + 3[О] = Се2Оз(Тв) и т.д.
Все эти реакции идут с выделением тепла. Равновесие реакции осаждающего раскисления сдвигается влево при повышении и вправо при понижении температуры. Практически это означает, что по мере понижения температуры стали (при ее кристаллизации в изложнице или в литейной форме) реакции раскисления продолжают идти и образуются все новые и новые количества оксидов, которые не успевают всплыть и удалиться из металла. В связи с этим при данном методе раскисления невозможно получить сталь, совершенно чистую от неметаллических включений, что является его недостатком. Однако этот метод получил широкое распространение как наиболее простой и дешевый.
При введении в металл элемента-раскислителя активность растворенного в металле кислорода уменьшается. Активность кислорода, соответ ствующая определенной концентрации
Таблица 14.1. Состав ферросплавов некоторых марок
| Наименование, марка | Содержание элемента, мас.% | ГОСТ | ||||||
| Si | С | Мп | А1 | Сг | Р | S | ||
| не более | ||||||||
| Ферросилиций ФС45 | 41-47 | — | <0,6 | <2,0 | <0,5 | 0,05 | 0,03 | 1415-78 |
| Ферросилиций ФС75 | 74-80 | — | <0,4 | <2,5 | <0,4 | '0,05 | 0,03 | 1415-78 |
| Ферромарганец низко- | <2,0 | <0,5 | >85,0 | — | — | 0,30 | 0,03 | 4755-80 |
| углеродистый ФМнО,5 | ||||||||
| Ферромарганец средне- | <2,0 | < 1,0 | >85,0 | — | — | 0,20 | 0,03 | 4755-80 |
| углеродистый ФМн1,0 | ||||||||
| Ферромарганец высоко- | <2,0 | <7,0 | >75,0 | — | — | 0,45 | 0,03 | 4755-80 |
| углеродистый ФМн75 | ||||||||
| Марганец металлический | — | <0,10 | >99,7 | — | — | 0,01 | 0,10 | 6008-75 |
| МрО | ||||||||
| Силикомарганец СМнЮ | 10-13,9 | <3,5 | >60,0 | — | — | 0,20 | 0,03 | 4756-77 |
| Феррохром | <1,5 | <0,06 | — | — | >65,0 | 0,03 | 0,03 | 4757-79 |
| безуглеродистый ФХ006 | ||||||||
| Феррохром низкоугле- | <2,0 | <0,25 | — | — | >65,0 | 0,03 | 0,03 | 4057-79 |
| родистый ФХ025 | ||||||||
| Феррохром среднеугле- | <2,0 | <2,0 | — | — | >65,0 | 0,04 | 0,04 | 4757-79 |
| родистый ФХ200 | ||||||||
| Феррохром высоко- | <2,0 | <8,0 | — | — | >65,0 | 0,04 | 0,06 | 4757-79 |
| углеродистый ФХ800 | ||||||||
| Феррохром азотиро- | <1,0 | <0,06 | — | — | >65,0 | 0,02 | 0,03*' | 4757-79 |
| Ванный ФХ40ОН | ||||||||
| Ферромолибден ФМЗ | <2,0 | <0,20 | — | — | — | 0,20 | 0,20 | 4759-79 |
| Ферротитан ФТи68 | 0,5 | 0,2 | - | <5 | — | 0,05 | 0,05 | 4761-80 |
| Ферротитан ФТиЗО | 0,8 | 0,2 | — | < 14 | — | 0,07 | 0,07 | 4761-80 |
| Силикокальций СК-25 | Основа | <0,50 | — | 2,0 | — | 0,04 | ___ *2 | 4762-71 |
| *'> 4,0 % N. *2 25-30 %Са. |
элемента-раскислителя, при которой он находится в равновесии с кислородом при данной температуре, называется раскислительной способностью элемента-раскислителя. При изменении температуры раскислитель-ная способность изменяется, иногда очень существенно. Обычно сравнение элементов-раскислителей по их раскислительным способностям проводят при 1600 °С.
В общем случае реакция глубинного, или осаждающего, раскисления имеет вид
m[R] + п[0] = (RmOn),
K=a(RmOn)/(a[R ] т a [ 0]n
где R — условное обозначение элемента-раскислителя.
При раскислении обычно имеют дело с очень малыми значениями концентраций элемента-раскислителя [R] и кислорода [О], поэтому
a[R]  [R], а [0]
[R], а [0]  [О], Rа(Rт0п)/[R]т-[0]п.
[О], Rа(Rт0п)/[R]т-[0]п.
Если в результате реакции образуется чистый оксид RmOn, то a[RmOn] =1
и К= l/[R]m • [О]" или К'= [R] т- [О]n. Значения произведения равновесных концентраций раскислителя и кислорода удобны для сравнения раскислительной способности используемых элементов. Графически эти соотношения часто представляют в логарифмических или полулогарифмических координатах (рис. 14.3). Если К'= = [R]m • [О]n, то
lgK'=mlg[R] + nlg[0],
откуда
nlg[0]=lgK'-mlg[K],

Рис. 14.3. Раскислительная способность элементов R в чистом железе (а) и влияние растворенных элементов на активность кислорода (б)
т. е. в логарифмических координатах зависимость [О] от [R]должна быть выражена прямой линией. Если эта линия криволинейна или на ней имеется перелом, значит, изменяется состав продуктов раскисления. Так, например, при низких концентрациях углерода продуктами реакции раскисления являются СО и СО2; при раскислении кремнием состав продуктов раскисления по мере повышения концентрации кремния изменяется:
(FeO)2 • Si02 → (FеО)n • (SiO2) → SiO2→ SiO
(n «2);
при взаимодействии кислорода с хромом состав образующихся продуктов по мере повышения концентрации хрома также изменяется:
FeO • Сг2О3→ Сг2О3 → Сr и т. д.
Значения раскислительной способности отдельных раскислителей, по разным данным, часто существенно расходятся. Это объясняется тем, что практически при любом способе производства стали существует какой-то внешний источник поступления кислорода и этот кислород оказывает определенное влияние на протекание реакции раскисления. Например, реакцию раскисления алюминием записывают обычно в виде
2 [О] + 3[А1] = = А12О3. Однако, если в газовой среде присутствует кислород, необходимо учитывать и возможность образования соединений типа FеА12О4 (герцинит):
Fеж+1/202(г) + 2А1203 = FеА12О4 + 2[А1] + 3[О].
Полученные при этом численные значения раскислительной способности алюминия зависят от парциального давления кислорода Ро2 • В большинстве случаев образующиеся при раскислении оксиды для упрощения обозначают MnO, SiO2, A12O3 и т. д.
14.1.1. Раскисление марганцем. Марганец — сравнительно слабый раскислитель и не обеспечивает снижения окисленное™ металла до требуемых пределов, однако большее или меньшее его количество вводится в металл при выплавке стали многих ма-pок. Это объясняется рядом достоинств марганца: 1) положительная роль в борьбе с вредным действием серы; 2) положительное влияние на прокаливаемость стали и ее прочность; 3) малое значение межфазного натяжения на границе металл—образующееся включение МпО, в результате чего облегчаются условия выделения включений и возрастает скорость раскисления. При введении марганца в чистое, но содержащее кислород железо образуется оксид марганца МпО, который создает с FeO непрерывный ряд растворов mFeO • nМпО (рис. 14.4). В сталях наряду с марганцем всегда содержится углерод; при этом окисленность металла определяется или марганцем (при низких содержаниях углерода), или углеродом (при высоких содержаниях углерода), или марганцем и углеродом одновременно. Марганец вводят в металл в конце плавки (часто в ковш) в виде сплава марганца с железом (ферромарганца). В ферромарганце разных марок содержится неодинаковое количество углерода (1-7 %), ~ 75 % Мп и некоторое (<2%) количество кремния. При необходимости выплавить сталь с очень низким содержанием углерода используется металлический марганец. Применение его ограничено высокой стоимостью. В некоторых случаях для повышения содержания марганца в сталь вводят выплавляемый в доменных печах так называемый зеркальный чугун (~5 % С, 10-25% Мп, <2%Si).
14.1.2. Раскисление кремнием. При введении в жидкий металл кремния образуются или жидкие силикаты железа, или кремнезем. Диаграмма состояния FeO-SiO2 как бы разделена на две диаграммы дополнительной вертикальной осью, соответствующей образованию файялита (FeO)2 • SiO2. При малых значениях SiO2 образуются легкоплавкие включения, состоящие из вюстита и файялита. Из рис. 14.3 видно, что кремний гораздо более сильный раскислитель, чем марганец.
По разным данным, произведение [Si] -[О]2 = (1+10)- 10 -5, т.е. уже при 0,2 % [Si] в металле содержится < 0,01 % [О]. При наличии в агрегате основного шлака образующийся при введении кремния кремнезем взаимодействует с основными оксидами шлака и a SiC2 становится очень малой; соответственно растет раскислительная способность кремния.
Однако необходимо учитывать, что образующиеся силикаты хорошо смачивают железо, поэтому удаление силикатных включений из металла связано с определенными трудностями.
Если металл, раскисляемый кремнием, содержит некоторое количество марганца, то в составе образующихся силикатов будут также и оксиды марганца. Из диаграммы состояния файялит-тефроит (рис. 14.5) видно, что температура плавления образующихся включений может быть сравнительно небольшой. Кремний в металл вводится в виде сплава кремния с железом (ферросилиция). Чаще используют ферросилиций ФС45 (- 45 % Si). В некоторых случаях применяют доменный ферросилиций, содержащий -2,0% Си 9—13% Si. Совместно с марганцем кремний вводят в сталь в виде силикомарганца СМнЮ (10— 13 % Si и > 60% Мп).
14.1.3. Раскисление алюминием. Алюминий — более сильный раскислитель, чем кремний (см. рис. 14.3). При введении алюминия в металле остается ничтожно малое количество растворенного кислорода. Алюминий, введенный в избытке, может взаимодействовать не только с растворенным в металле кислородом, но и с оксидами более слабых раскислителей (МпО, SiO2). При введении алюминия в железо, содержащее

Рис. 14.4. Диаграмма состояния FeO-MnO

Рис. 14.5. Диаграмма состояния файялит-тефроит 2FeO • SiO2-2MnO • SiO2
диаграмме FeO—А12О3 может образоваться либо чистый глинозем (при большом содержании А12О3), либо шпинель FeO • А12О3 (герценит). Температура плавления чистого глинозема составляет ~ 2050 °С. Высокие значения межфазного натяжения на границе металл—включение глинозема 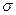 м_вкл, т. е. малая смачиваемость таких включений, металлом, облегчают процесс их отделения от металла. Образование в стали при раскислении алюминием мелких включений глинозема и нитрида алюминия влияет на протекание процесса кристаллизации, в частности на размер зерна. Обычно размер зерна регулируют, изменяя расход алюминия: чем больше введено алюминия, тем мельче зерно. Введенный в металл алюминий взаимодействует с серой (при большом расходе алюминия) и азотом. Образование в процессе кристаллизации нитрида алюминия A1N способствует снижению вредного влияния азота и уменьшению эффекта старения стали. Раскисление металла алюминием широко распространено. Алюминий вводят в металл в виде брусков (чушек) алюминия или в виде проволоки (см. далее на рис. 14.7).
м_вкл, т. е. малая смачиваемость таких включений, металлом, облегчают процесс их отделения от металла. Образование в стали при раскислении алюминием мелких включений глинозема и нитрида алюминия влияет на протекание процесса кристаллизации, в частности на размер зерна. Обычно размер зерна регулируют, изменяя расход алюминия: чем больше введено алюминия, тем мельче зерно. Введенный в металл алюминий взаимодействует с серой (при большом расходе алюминия) и азотом. Образование в процессе кристаллизации нитрида алюминия A1N способствует снижению вредного влияния азота и уменьшению эффекта старения стали. Раскисление металла алюминием широко распространено. Алюминий вводят в металл в виде брусков (чушек) алюминия или в виде проволоки (см. далее на рис. 14.7).
14.2. ОСОБЕННОСТИ ИСПОЛЬЗОВАНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ И РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Современная техника позволяет использовать в металлургической технологии ЩЗМ и РЗМ. ЩЗМ (кальций и др.) образуют очень прочные оксиды, более прочные, чем кремнезем и даже глинозем. Изменение энергии Гиббса ΔG º при 1900 К для реакции образования оксидов из чистых элементов составляет:
Si + О2 → SiO2, ΔG º = -540 Дж,
4/ЗАl + О2 → 2/ЗА12О3, ΔG º = -712 кДж,
2Са + О2 2СаО, ΔG ° = -846 кДж,
поэтому кальций, введенный в металл, взаимодействует не только с FeO и МпО, но и с SiO2 и даже с А12О3, восстанавливая кремний и алюминий не только из образовавшихся ранее оксидных включений, но и из футеровки ковша. Из ЩЗМ в качестве раскисли-теля чаще других используют кальций. При введении кальция в металл необходимо учитывать давление испарения кальция и его малую растворимость в жидком железе (< 0,032 %). Эффективность раскисления кальцием возрастает при сплавлении его с другими металлами. Обычно кальций используют в виде сплава с кремнием (~ 30 % Са, ~ 60 % Si), с кремнием и алюминием (~ 20 % Са, - 50 % Si, - 20 % А1) или в виде соединений (карбид кальция СаС2). Кальций при введении в расплавленную сталь испаряется и взаимодействует с металлом в парообразном состоянии.
При раскислении металла кальцием возрастает скорость удаления включений и уменьшается время, необходимое для получения стали с очень малым числом невсплывших включений. Поднимающиеся пузыри кальция взаимодействуют с находящимися в жидкой стали включениями глинозема. Образующиеся при этом алюминаты кальция имеют низкую температуру плавления, поэтому данные оксиды находятся в стали в жидком виде, что облегчает процесс их всплывания и удаления. Та небольшая часть этих включений, которая остается в стали, имеет вид равномерно распределенных мелких включений СаО-А12О3 округлой формы. Очень важно, что форма этих включений при обработке полученного слитка давлением (при прокатке или ковке) не изменяется, что, в свою очередь, положительно влияет на свойства стали.
Очень сильными раскислителями являются РЗМ (лантан, церий, празеодим, неодим, иттрий и др.). Эти элементы имеют значительные атомные массы, плотность, сравнимую с плотностью стали, высокие температуры кипения при относительно невысоком давлении пара. Таким образом, РЗМ можно вводить в сталь без опасения интенсивного их испарения в отличие от ЩЗМ.
Современная технология обеспечивает получение и поставку на металлургические заводы лигатуры, содержащей до 30—50 % РЗМ. Химическое сродство РЗМ к кислороду очень высокое. Так, например, теплота образования оксида церия Се2О3
ΔH0298 =2240кДж (для FеО= ΔH0298 = 268, для А12О3 ΔH0298=1680кДж), поэтому, будучи введенным в металл в составе лигатуры, церий взаимодействует со всеми включениями, находящимися в жидкой стали, в том числе и с твердыми включениями глинозема:
2Се + А1203 (тв) = Се203 (тв) + 2А1,
ΔG º= 193858 + 86, 54Т.
РЗМ интенсивно взаимодействуют с футеровкой агрегата или ковша, восстанавливая, например, кремний и алюминий из шамота.
Активность кислорода при введении в металл РЗМ резко снижается, однако содержание кислорода (в виде включений) изменяется незначительно. Это объясняется тем, что образующиеся оксиды РЗМ представляют собой мелкие, тугоплавкие и очень плотные включения. Плотность образующихся включений сравнима с плотностью жидкой стали, поэтому они не всплывают (иногда в нижней части слитка обнаруживаются скопления тяжелых оксидов РЗМ). Наблюдаются случаи, когда содержание кислорода при введении РЗМ в больших количествах не только не уменьшается, но и возрастает за счет взаимодействия избыточных РЗМ с оксидами, входящими в состав футеровки. Важным моментом является то, что мелкие тугоплавкие включения оксидов РЗМ, более или менее равномерно «плавающие» в жидком металле, становятся при затвердевании слитка или отливки центрами кристаллизации; в результате получается плотный металл с мелкокристаллической структурой и с почти одинаковыми свойствами во всех направлениях относительно направления прокатки слитка. Лигатура, содержащая РЗМ, относительно дорогая, поэтому РЗМ применяют тогда, когда безрезультатными оказались более дешевые методы.
ЩЗМ и РЗМ очень активно взаимодействуют со всеми примесями металла, в том числе с углеродом, серой и растворенными в металле газами (кислородом, азотом, водородом). При использовании ЩЗМ и РЗМ учитывают их высокое химическое сродство к кислороду и сере, в частности то, что химическое сродство к кислороду ЩЗМ и РЗМ выше, чем к сере. Однако даже в недостаточно раскисленном металле часть РЗМ и ЩЗМ взаимодействует с серой и вводимые РЗМ и ЩЗМ частично взаимодействуют с кислородом, находящимся в составе ранее образовавшихся включений, а частично с серой, образуя сульфиды CaS, LaS, La2S3, CeS, Ce2S3 и т. д. Температура плавления сульфидов РЗМ около 2000 0С, и они, так же как оксиды РЗМ, располагаются при кристаллизации не по краям зерна, а сами являются центрами кристаллизации и располагаются в центре зерна. Тем самым их отрицательное влияние на свойства стали сводится к минимуму. Возможно также образование ок-сисульфидов РЗМ типа La2O2S, Ce2O2S, Y2O2S и т. д.
Date: 2016-05-25; view: 413; Нарушение авторских прав