
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Окисление и восстановление кремния
|
|
Кремний растворяется в железе в любых соотношениях. При растворении выделяется заметное количество тепла. Изменение энергии Гиббса при растворении кремния (в области температур сталеплавильных процессов) составляет ΔGo = -131 800-17,32 Т. Для раствора кремния в железе характерно отрицательное отклонение от закона Рауля, что свидетельствует о наличии определенных связей между кремнием и железом. На диаграмме Fe-Si при 33 мас.% Si (50 ат.%) на линии ликвидуса наблюдается максимум. На кривых изменения вязкости и поверхностного натяжения о также наблюдается перелом при этих соотношениях содержания кремния и железа в сплаве. На основании этого можно заключить, что кремний присутствует в сплавах с железом в форме группировок, близких по составу к FeSi. Растворенный в железе кремний принято обозначать [Si].
11.3.1. Влияние температуры. Кремний—легко окисляющийся элемент. Окисление кремния, растворенного в металле, может происходить в результате его взаимодействия с кислородом:
а) растворенным в металле:
[Si] + 2[0] = (Si02),
ΔGo = -542 000 + 202,83 Т;
б) содержащимся в газовой фазе:
[Si] + 02(г) = (Si02),
ΔGo = -775 000 + 198,04Т;
в) содержащимся в оксидах железа шлака:
[Si] + 2(FeO) = (Si02) +2Fe;
ΔGo =-29 900+98,04T
Во всех случаях при окислении кремния выделяется значительное количество тепла. При точных термодинамических расчетах необходимо учитывать также изменение энергии Гиббса растворения образующейся при окислении кремния SiO2 в шлаке конкретного состава. Из приведенных значений ΔGo следует, что окисление кремния может протекать интенсивно при наличии окислителя во всем интервале температур, характерном для сталеплавильных процессов.
11.3.2. Влияние состава шлака. В агрегатах с основными шлаками реакция окисления кремния протекает практически до конца, так как образующийся кремнезем взаимодействует с основными оксидами и активность SiO2 в основных шлаках ничтожно мала. Кислые шлаки, по крайней мере в конце плавки, насыщены кремнеземом. Активность кремнезема в кислых шлаках близка к единице (а SiО2~l). Если при работе под кислыми шлаками отсутствует интенсивный подвод окислителей (кислорода, воздуха, железной руды), то между насыщенным кремнеземом шлаком и компонентами расплава возможно взаимодействие:
(SiO2) + 2[Mn] = 2(MnO) + [Si],
ΔGo = 32 200 -132,807;
(SiO2) + 2[C] = 2COr+[Si],
ΔGo = 611300 -336,47 Т.
Реакции эти идут с поглощением тепла. Значения ΔGoсвидетельствуют о том, что протеканию реакций восстановления кремния способствуют высокие температуры. Кроме температуры на процесс восстановления кремния влияют составы металла и шлака. Влияние температуры для расплава,, тем
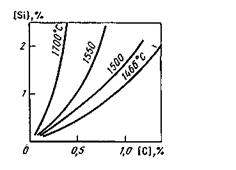
Рис. 11.5. Кривые равновесия реакции SiO2 + 2C ↔ Si + 2CO в расплавах Fe-C
шлака. Влияние температуры для расплава, содержащего кремний и углерод, показано на рис. 11.5. Константа равновесия реакции (SiO2) + 2Fеж = 2(FeO) + [Si] K = а2 (FeO) a [Si]/ a (SiQ2); B насыщенных SiO2 шлаках a (SiQ2);=1 и К= а (FeO) * а [Si], откуда а [Si] = К/ а (FeO)
Чем ниже активность оксидов железа в шкале, тем дальше пойдет процесс восстановления кремния. Такие компоненты расплава, как углерод или марганец, понижают окисленность и металла, и шлака, повышая степень восстановления кремния. Основной оксид железа FeO в кислых шлаках связан с кремнеземом в силикаты железа, и его активность мала. Если в шлак ввести более сильный основный оксид, например СаО, то он разрушит силикаты железа, образуя силикаты кальция, и активность оксидов железа в шлаке возрастет, соответственно затормозится процесс восстановления кремния. Таким образом, можно считать, что процесс восстановления кремния из кислых шлаков идет по схеме
(SiO2) + 2Fex = 2(FeO) + [Si],
K = а2 (FeO) a [Si]/ a (SiQ2)
а компоненты металла или шлака влияют на а (FeO) смещая равновесие в сторону восстановления или окисления кремния. Если в ванну интенсивно подают окислитель, то имеет место окисление железа, значение а (FeO) возрастает и в металле остаются лишь следы кремния.
11.4. ОКИСЛЕНИЕ И
Date: 2016-05-25; view: 493; Нарушение авторских прав