
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

САША:К чему приводит гормональный дисбаланс?
Саша обращается к Наташе
К гормональному лечению у большинства обывателей давно сложилось, мягко говоря, негативное отношение. Заслуженно ли? Ведь существуют так называемые «системные» заболевания, где без гормональных препаратов уже не обойтись. Так стоит ли бояться гормонов?
Наташа - Это предубеждение сформировалось 25-30 лет назад, когда и сами гормональные препараты были несовершенны, и врачи нередко назначали их при отсутствии показаний или завышая дозировки.
Сегодня тяжелые формы ревматоидного артрита, гипотиреоз, инсулинозависимый диабет лечат исключительно гормональными препаратами. Если у человека запущенная бронхиальная астма или тяжелый хронический гломерулонефрит, без гормонов тоже не обойтись.
Важно знать: побочные эффекты появляются только при очень длительном применении либо при высокой дозировке. В любом случае вред побочных эффектов гораздо меньше, чем опасность отказа от лечения.
САША
Зачем применять гормоны, если у человека нет видимых проблем со здоровьем? Пример такой бесконтрольности – когда, начав посещать спортивный клуб, человек начинает самостоятельно употреблять анаболические стероиды. Некоторые люди с годами превращаются в ходячие «образцы» побочного действия гормонов.
НАТАША - Конечно, любое бесконтрольное, тем более самостоятельное применение гормонов идет во вред. Антивозрастная гормонозаместительная терапия – особая история. Во-первых, это не лечение, а коррекция, восполнение нарастающего с возрастом дефицита определенных гормонов, которые с годами организм перестает вырабатывать в достаточном количестве. Во-вторых, она проводится только врачом и лишь после завершения многочисленных исследований. В-третьих, врач постоянно контролирует и корректирует уровень гормонов.
САША:К чему приводит гормональный дисбаланс?
После 35 лет в организме любого человека снижается уровень половых гормонов. Более того, происходит ускоренное их «превращение» в другие гормональные формы, которые влияют на состояние организма. Например, возрастное снижение уровня тестостерона сопровождается ростом его биологической «разновидности» – дигидротестостерона.
НАТАША - Дигидротестостерон может вызывать аденому предстательной железы. Не исключена его способность провоцировать развитие рака предстательной железы. Возрастные изменения в мужском организме ведут и к высокому росту женских половых гормонов, эстрогенов. Увы, в сочетании с высоким уровнем дигидротестостерона это тоже способствует развитию рака предстательной железы.
Вывод: терапевтически поддерживая уровень тестостерона на нормальном уровне и предотвращая «превращение» его в опасные производные, мужчина, помимо улучшения своего самочувствия, осуществляет профилактику онкологических заболеваний.
У женщин – похожий процесс. Возрастные изменения метаболизма самого активного женского эстрогенного гормона, эстрадиола, повышают риск возникновения рака молочной железы, миомы матки, рака эндометрия и других гормонозависимых органов. От уровня эстрогенов напрямую зависит состояние волос, кожи, подкожной жировой клетчатки, костной системы. С его дефицитом связывают и риск развития болезни Альцгеймера. Не случайно чаще ею страдают женщины. Особенно старше 60 лет – в самый «пик» дефицита эстрадиола. Ведь этот гормон участвует и в работе головного мозга.
Антивозрастная гормональная терапия призвана, с одной стороны, восполнять дефицит основных половых гормонов, с другой – позволяет поддерживать этот баланс на более «молодом» уровне – 30-летнего организма.
САША
Помимо «бастующих» после сорокалетнего возраста половых гормонов на наше самочувствие, обмен веществ, на работу эндокринной и сердечно-сосудистой системы влияют и другие гормоны. Поддержание их на «докризисном» уровне тоже способствует сохранению молодости.
НАТАША –ДА, например мелатонин, гормон шишковидной железы, регулирует выработку гормона роста. Уровень некоторых других гормонов тоже зависит от этого своеобразного «диспетчера». Кстати, мелатонин – это еще и гормон сна. Недаром из-за его дефицита многие люди страдают бессонницей.
САША
Важно, чтобы при антивозрастной терапии уровень гормонов в крови не превышал верхнюю границу нормы. Тогда не будет ни осложнений, ни побочных эффектов. Как не переборщить с дозировкой гормонов?
НАТАША - Подчеркну: антивозрастная гормональнозаместительная терапия – это не лечение, а профилактика негативных процессов, восстановление эндокринной системы. Те гормоны, которые у человека в пределах нормы, врачи не трогают. Устраняют лишь выраженный дисбаланс, поддерживая гормональный уровень, характерный для молодого возраста. При антивозрастной терапии за ним требуется особый контроль (регулярный лабораторный контроль проводят 1 раз в 3 месяца). Плюс контроль за основными показателями обмена веществ – углеводным, жировым, белковым. Только тогда можно избежать побочных эффектов и осложнений.
Если же человек по каким-либо причинам решил отказаться от антивозрастной терапии и прекратил прием препаратов, то гормональные показатели в течение 2-3 месяцев приходят в норму самостоятельно. Другое дело, что положительный эффект наступает уже после первого месяца подобной терапии и длится не менее полугода после ее завершения.
САША
Особых ограничений в образе жизни и питании, говорят врачи, нет,так ли это?
Наташа - Если пациент хочет добиться от антивозрастной терапии максимального эффекта, он должен уделить внимание и своему образу жизни. Так, в питании предпочтение следует отдавать низкоуглеводной диете, тогда меньше проявится склонность к ожирению. Желательно также начать прием витаминов: ведь они тоже участвуют во всех биохимических и обменных процессах. Нужна физическая нагрузка, чтобы не только укреплять мышцы, но и тренировать сердечно-сосудистую и дыхательную систему.
Важно понять главное: некоторые лекарства можно и нужно применять в профилактических целях, особенно если они компенсируют возможные негативные возрастные изменения. Антивозрастная биоидентичная гормоно-заместительная терапия – это профилактическая медицина. И хотя пока это направление успешнее развивается на Западе, где люди традиционно следят за своим здоровьем, для нашего российского менталитета она вполне применима.
ANTI-AGE ТЕРАПИЯ! (анти-возрастная терапия)
КОМПОНЕНТЫ ANTI-AGE ТЕРАПИИ
 | |||||
 | |||||
 | |||||
|
|
|

Начнем с основного компонента Anti-age терапии.
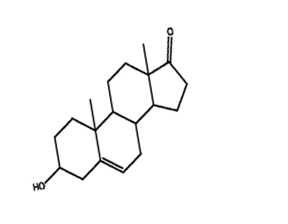
ДГЭА(дигидроэпиандростерон)
ВВЕДЕНИЕ
В процессе старения секреция многих гормонов драматически падает, люди постепенно теряют свою красоту.
Современная эндокринология преподносит нам способ быть молодыми и здоровыми,когда сам организм не справляется с этой задачей. На помощь приходит основной компонентом Anti-age терапии - дгэа и дгэа-с.
ОСНОВНАЯ ИНФОРМАЦИЯ!
Дигидроэпиандростерон и Дигидроэпиандростерон-сульфат- гормоны, синтез которых происходит в надпочечниках, и только небольшая часть (около 8–10 %) образуется гонадами. Как и другие стероиды, он образуется из холестерина или de novo из ацетата. Первым продутом ферментативной реакции является прегненолон (прегненолон-сульфат для сульфатной формы стероида). Последующее гидроксилирование прегненолона в положении С17 обеспечивает образование 17α-гидроксипрегненолона,который и является непосредственным предшественником ДГЭА.
Изучено поведение циркулирующих надпочечниковых андрогенов в различные периоды жизни: высокая секреция в первые 2 мес после рождения, «выключение» их продукции до начала пубертата, стремительное нарастание уровня в крови к 30 годам, а затем неуклонное его падение с возрастом со скоростью 60 нг/мл/год.Такая возрастная динамика ДГЭА была и во многом остается интригующей биологической загадкой для исследователей. Вторая загадка состоит в том, что мы не можем объяснить, почему ДГЭА и его сульфатнаяформа (ДГЭА-сульфат, ДГЭАС) продуцируются надпочечниками к 30 годам в таких огромных количествах(до 40 мг/сут), намного превышая продукцию кортизола.
На протяжении 50 лет с момента открытия ДГЭА его рассматривали исключительно в качестве предшественника в системе синтеза тестостерона и эстрогенов. И только 15–20 лет тому назад возник настоящий бум вокруг ДГЭА, после того как были опубликованы результаты клинических наблюдений с назначением физиологических (50 мг/сут) и фармакологических доз (200–400 мг/сут) этого гормона людям после 60 лет с принципиальным улучшением их качества жизни. За эти годы опубликованы тысячи работ, посвященных изучению ДГЭА, результаты которых пока однозначноне ответили на главный вопрос о его биологическом значении. Продукция ДГЭА и андростендиона с возрастом неуклонно снижается, достигая минимальных значений к 100 годам. Важно отметить, что уровень общего тестостерона с возрастом сущест-венно не изменяется. Исключение составляют пожилые мужчины, страдающие хроническими заболеваниями. У них продукция тестостерона была резко снижена. Уровень кортизола в крови с возрастом также не изменяется, что приводит к дисбалансу в соотношении кортизол/ДГЭА. Доминирование кортизола способствует супрессии иммунной системы, а также нарастанию деструктивных процессов в гиппокампе. Однозначно показано, что заместительная терапияь ДГЭА в физиологических дозах (50 мг/сут) при возрастном или патологическом его дефиците принципиально улучшает качество жизни. ДГЭА обоснованно рассматривается как естественный антагонист кортизола в связи с их разнонаправленным влиянием на иммунную систему и функцию мозга, в частности на гиппокамп. При этом ДГЭА обладает протекторным действием, а кортизол оказывает деструктивное воздействие. ДГЭА рассматривается как буферный стероид.В отличие от всех других стероидов, специфические рецепторы к ДГЭА не идентифицированы. Его биоло-гическое действие имеет широкий диапазон и определяется характером нарушения гомеостаза в ависимости от специфики конкретного воздействия на организм.По своему биологическому действию ДГЭА и ДГЭАС рассматриваются как естественные антиглюкокортикоиды.
Давайте поговорим о внутриклеточном метаболизме дегидроэпиандростерона в тканях органов-мишеней. Важным этапом в изучении биохимии надпочечниковых андрогенов явились работы, в которых была доказана способность надпочечников человека и отдельных видов обезьян секретировать ДГЭА и андростендион. В связи с этим всегда возникал ключевой вопрос: зачем в организме приматов синтезируется ДГЭАв огромном количестве? Еще более интригующим моментом является динамика изменения уровня ДГЭА в крови в различные периоды жизни человека: он очень низкий до начала пубертата, заметно повышается с 6–8 лет и постепенно нарастает по мере полового созревания с выходом на максимальную продукцию к 30 годам, а затем постепенно снижается со средней скоростью 60 нг/год. К 75 годам содержание ДГЭА не превышает 20–25 % от уровня максимальной продукции. Целенаправленными исследованиями группы проф. Fernand Labrie была доказана определяющая роль ДГЭА как источника (предшественника) образования биологически активных половых стероидов – тестостерона, эстрадиола и эстрона в периферических тканях. В 1988 г. он предложил ввести понятие «интракринология» с принципом интракринной регуляции нарядус существующими эндокринным, паракринным и аутокринным механизмами гуморальной регуляции. При интракринной регуляции ДГЭА, образующийся в надпочечниках, попадая в кровь общей циркуляции, достигает периферических тканей, где внутри самих клеток с помощью соответствующих ферментных систем происходит его трансформация в биологически активные стероидные гормоны эстрадиол и/или тестостерон, которые, не покидая клетки, осуществляют присущее им биологическое действие. Иными словами, они не проникают во внеклеточное пространство и общий кровоток. В дальнейшем методами молекулярной биологии и генетики были найдены гены, кодирующие функцию ферментных систем, ответственных за трансформацию ДГЭА в андрогены и/или эстрогены в периферических тканях. Поэтому, естественно, количество образующихся половых стероидов в тканях-мишенях будет определяться уровнем активности соответствующих ферментативных систем в клетках тканей-мишеней. По современным представлениям, снижение с возрастом продукции ДГЭА и особенно ДГЭАС сопровождается существенным уменьшением внутриклеточного образования андрогенов и эстрогенов в периферических тканях-мишенях.В ряде работ показано наличие прямой корреляции низкого уровня ДГЭА с дисгормональным раком предстательной железы и молочной железы,а в экспериментах на животных выявлен протекторный эффект ДГЭА на развитие опухолевого процесса. В отличие от кортизола, ДГЭА оказывает активирующее действие на иммунную систему, что было обнаружено у женщин, получавших его в постменопаузальный период. Прием ДГЭА в пожилом возрасте приводит к улучшению качества жизни как у мужчин, так и у женщин, что было зарегистрировано в целом ряде исследований. Внутриклеточное образование половых стероидов из ДГЭА имеет важное биологическое значение как автономный источник их продукции, независимый от половых желез. По данным ряда авторов, до 35 % активных андрогенов у мужчин образуется внутриклеточно в периферических тканях из ДГЭА и андростендиона надпочечников. У женщин процент образования эстрогенов еще выше – 75 % до менопаузы и 100 % после менопаузы. Степень такой компенсации индивидуальна и определяется механизмами, изложенными выше. К ним можно добавить и такой механизм, как гормон-рецепторное взаимодействие. Наиболее наглядная клиническая ситуация – состояние менопаузы у женщин, которая протекает с индивидуальной вариабельностью. А она, в свою очередь, определяется величиной насыщенности организма женщин эстрогенами. Основными ферментативными системами, обеспечивающими внутриклеточное образование 17р-эстрадиола, являются: 3β-гидроксистероиддегидрогеназа/Δ5-Δ4-изомераза, 17р-гидроксистероиддегидрогеназа,5α-редуктаза и ароматаза. Если учесть то обстоятельство, что примерно в 40 % случаев рак молочной железы, предстательной железы, яичников и шейки матки является гормонозависимым, то становятся понятными усилия многих групп ученых по поиску фармакологических препаратов, с помощью которых можно было бы контролировать активность этих ключевых ферментов, включая и внутриклеточный уровень. К этой группе препаратов относятся антиэстрогены и антиандрогены. Необходимо также отметить важное биологическое значение баланса в соотношении эстрадиол/эстрон, который поддерживается ферментативной системой 17р-гидроксистероиддегидрогеназы 1-го типа. Эти гормоны играют важную роль в функции клеток и их пролиферации. А ген, кодирующий функцию 17р-гидроксистероиддегидрогеназы, экспрессируется в стероидсекретирующей и периферических тканях. Рентгеноструктурный анализ позволил определить структуру данного фермента, а позже был выделен в кристаллическом виде комплекс 17р-гидроксистероиддегидрогеназы 1-го типа с эстрадиолом, что открывает возможность целенаправленного синтеза препаратов, ингибирующих активность фермента, и имеет большое значение для эндокринологии и терапии гормонозависимого рака. Сотрудниками проф. Fernand Labrie было выполнено большое исследование по анализу метаболизма стероидов С19 (включая ДГЭА и ДГЭАС) и С21 у мужчин и женщин в зависимости от их возраста. Ими был выбран возраст 20–30 лет (максимальная продукция надпочечниковых андрогенов) и 70–80 лет, когда продукция ДГЭА резко падает. Содержание ДГЭА, ДГЭАС,17β-диола, 17β-диол-сульфата, эфиров жирных кислот андростендиона драматически падает с возрастом. Однако особо необходимо подчеркнуть наиболее интенсивное снижение ДГЭА (до 74 %), которое происходит к 50–60 годам. Конъюгированные метаболиты 5α-ДГТ, включая андростеронглюкуронид, андростан-3α,17βр-диол-глюкуронид, андростан-3β,17β-диолглюкуронид и андростеронсульфат, являются основными стероидами, которые отражают общий пул андрогенов как у мужчин, так и у женщин. Уровни тестостерона и 5α-ДГТ в плазме крови могут быть использованы в качестве основных маркеров оценки их продукции семенниками у мужчин и овариальной секреции у женщин. Плазменное содержание всех вышеперечисленных метаболитов уменьшается на 41–73 % в возрастном интервале между 20–30 и 70–80 годами как у мужчин, так и у женщин, т. е. общий пул всех андрогенов снижается с возрастом. У женщин продукция всех андрогенов составляет не более 66 % от их образования в мужском организме. При этом у женщин доминирует интракринный путь образования тестостерона и 5α-ДГТ из ДГЭА, тогда как у мужчин в возрасте 50–60 лет 50 % андрогенов образуется клетками Лейдига, а 50 % – интракринным путем. Необходимо особо отметить, что в начальный период постменопаузы концентрация тестостерона в крови относительно нормальная, что, очевидно, объясняется тем, что яичник в этот период продолжает продуцировать достаточное количество андростендиона в результате повышенной секреции гонадотропинов аденогипофиза при менопаузе. А андростендион является одним из предшественников в синтезе тестостерона. Изложенные результаты работы Fernand Labrie свидетельствуют о том, что повышение внутриклеточного образования тестостерона и 5α-ДГТ не отражается на их показателях в крови, но их конъюгированные метаболиты, перечисленные выше, являются оптимальными маркерами для оценки уровня андрогенов и их биологического действия у человека. В экспериментах на животных была показана более высокая биодоступность ДГЭА при трансдермальном применении по сравнению с его приемом per os,так как в этом случае не происходит быстрая инактивация стероида в печени при его первом пассаже. Основываясь на этих данных, группа проф. Fernand Labrie провела клиническое исследование, в ходе которого мужчинам и женщинам в постменопаузе в возрасте60–70 лет ежедневно в течение 2 нед наносили на область живота раствор 2 г ДГЭА в 10 мл смеси спиртаи пропиленгликоля (1:1). Это сопровождалось увеличением на 175 % уровня ДГЭА в крови, на 90 % – его сульфатной формы, на 200 % – сложных эфиров ДГЭА с жирными кислотами и на 80 % – андростендиона. Их содержание возвращалось к исходному уровню через
1 нед после прекращения экзогенного введения ДГЭА. Необходимо особо отметить отсутствие изменений концентрации циркулирующих тестостерона и 5α-ДГТ. Параллельно с нарастанием уровня ДГЭА и его конъ-югированных форм происходит и повышение концентрации вышеназванных метаболитов 5α-ДГТ на 50–75 %. Однако свободные эстрон и эстрадиол практически не изменялись, а их сульфатные формы увеличивались на 20 %. Содержание циркулирующих С21-стероидов (кортизола и альдостерона) не изменялось. В отличие от мужчин, введение ДГЭА женщинам сопровождалось более выраженным увеличением циркулирующих метаболитов 5α-ДГТ: андростерон-глюкуронида – на 125 %, 3α-диол-глюкуронида – на 140 % и 3β-диол-глюкуронида – на 120 % [53]. Авторы исследования пришли к выводу о низкой информативности определения эстрадиола, эстрона, тестостерона и 5α-ДГТ для оценки эстрогенного статуса у женщин и андрогенного у мужчин и женщин. По мнению авторов,только метаболиты 5α-ДГТ являются надежными маркерами андрогенной достаточности, так как они прямо отражают интракринную продукцию 5α-ДГТ из ДГЭА и ДГЭАС. Такой механизм локального образования биологически активных стероидов позволяет избежать нежелательных побочных эффектов андрогенов в других тканях организма, например уменьшить эффект маскулинизации.
Date: 2016-05-25; view: 325; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |