
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Анализдің фотометриялық әдістері
|
|
Молекулалардың энергетикалық құрылысы атомдармен салыстырғанда әлде қайда күрделі. Электрондарың қозғалысымен қатар атомдардың тербеліс қозғалысы және молекуланың айналу қозғалысы болады. (айналу қозғалысы тек газ тәрізді жүйелерде болады.)
Сондықтан стационар күйде молекула энергиясы электрондық, тербеліс және айналу энергияларының қосындысынан тұрады: Е= Еэл.+Етерб.+Еайн.
Атом сияқты молекулада белгілі бір энергетикалық күйде ғана өмір сүре алады. Әр электрондық деңгейдің өзінің тербеліс деңгейі болады, ал әр тербеліс деңгейінің өзінің айналу деңгейі болады.
Сәйкесінше спектрлерді электронды, тербелмелі, айналмалы деп атайды.
Таза электронды спектрлер болмайды, себебі электронды ауысу тербелмеліні туғызады, ал тербелмелі айналмалыны туғызады.
Спектроскопияда молекулаларды қоздыруға электромагнитті өрістерді пайдаланады. Және молекула фотондарды сіңіреді, барлық сіңірілген жиіліктер жиыны – молекулалық абсорбциялық спектрдеп аталады. Басқа энергия түрлерімен қоздырған қолданылмайды, себебі, молекула ыдырауға ұшырайды.
Толқын жиіліктері ν жақын спектр сызықтары қосылып сіңіружолақтарын түзеді.
Молекуланың қозған күйден негізгі күйге қайтып келуі атомдармен салыстырғанда анағұрлым күрделірек өтеді.
Кез-келген зат жарық сіңіреді немесе шағылыстырады. Егер зат көрінетін жарықты сіңірсе, ол белгілі бір түске боялады. Кейбір заттар ультракүлгін жарықты сіңіред, ал кейбір заттар инфрақызыл жарықты сіңіреді. Заттың жарықты сіңіруі оның табиғатына және концентрацияға тәуелді. Жарық сіңірудің негізгі заңдары [38,47].
1) Бугер – Ламберт – Бердің біріккен заңы: Егер қабат қалындығы бірдел болса, әр түрлі заттар түскен жарықтың бірдей бөлігін сіңіреді.
Математикалық µрнегі: 
J0 – түскен жарық интенсивтілігі; J - өткен жарық интенсивтілігі; ε – сіңірудің молярлы коэффиценті – заттың табиғатына, толқын ұзындығына тәуелді. Т=const ал концентрацияға тәуелсіз; С – молярлы концентрация (моль/л); l – қабат қолындығы (см).
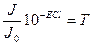
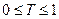

Егер l=1см болса, онда Т өткізу коэффициенті деп аталады.
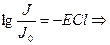

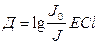
Д – оптикалық тыѓыздық
Д=-lgT
Егер жарық сіңіру Бугер – Ламберт-Бер заңына бағынса, оптикалық тығыздық ерітінді концентрациясына тура пропорционал болады. Бірақ заң барлық жағдайда орындала бермейді. Заңның орындалу шарттары:
А)Жарық монохроматты болу керек.
Б)Ортаның сыну көрсеткіші тұрақты болу керек.
В)Коцентрация өзгергенде заттың құрамы өзгермеу керек.
2) Оптикалық тығыздықтың аддитивтілік заңы:
2. Жарық сіңірудің аддитивтілік заңы: Егер ерітіндіде бірнеше жарық сіңіретін зат болса, онда ерітінді тығыздығы барлық компоненттердің тығыздықтарының қосындысына тең болады.
Д=Д1+Д2+Д3... Д=E1C1l + E2C2l + E3C3l…
Фотометриялық анализдің метрологиялық сипаттамалары
. Молекулалық абсорбциялық спектроскопияның екі әдісі бар:
1) фотоколориметрия
2) спектрофотометрия
Фотоколориметрия көрінетін жарықтың монохроматты сәулені сіңіруді өлшеуге негізделген әдіс. Бұл әдіспен түсті ерітінділерді анализдеуге болады.
| Ерітіндінің түсі | Сіңіру максимумы (λ/нм) | Жарық фильтрінің түсі |
| Сары Қызыл-сары Қызыл Күлгін Көк Жасылтым көк Көкшіл жасыл | 450-480 480-490 490-500 560-575 575-590 590-625 625-640 | Көк Жасылтым көк Көкшіл жасыл Сарғыш жасыл Сары Қызыл сары Қызыл |
Спектрофотометрия көрінетін, ультракүлгін және инфрақызыл жарықтың монохроматты сәулесін сіңіруге негізделген.
Артықшылықтары: 1) λ=210-1100 нм аралығында жарық сіңіруді жүргізуге болады, яғни түссіз ерітіндіде оптикалық тығыздығын өлшеуге болады; 2) жарықтың монохроматы; 3) Ерітіндінің ғана емес мөлдір қатты заттардың да оптикалық тығыздығын өлшеуге болады; 4) Сіңіру спектрі бойынша сапалық анализ жүргізуге болады.
Сіңіру спектрі деп жарық сіңірудің толқын ұзындығына тәуелділігін атайды.
Сіңіру спектрі заттың сапалы сипаттамасы, өзіне ғана тән.
Фотоколориметриялық және спектрофотометриялық анализ әдiстерi периодтық жүйедегi көптеген элементтердi, соның iшiнде негiзiнен металлдарды анықтауда қолданылады. Бұл әдiстер өндiрiстiң металлургиялық, элекрондық, химиялық салаларында, медицинада, биология т.б. салаларда кеңiнен қолданылуда. Олардың қоршаған ортаның ластануын аналитикалық бақылауда және экологиялық мәселелрдi шешуде маңызы зор.
Абсорбциялық спектроскопия әдiстерiнiң сезiмталдығы өте жоғары, олар таңдамалы, әрi дәл әдiстер болып табылады. Осы әдiстермен аз және көп мөлшердегi заттарды анықтауға және қоспаларды анықтауға болады. Көптеген фотометриялық әдiстердiң талғамдығыжоғары болғандықтан, олардың көмегiмен күрделi қоспалардағы элементтердi химиялық компоненттерге бөлмей-ақ анықтауға болады. Фотометриялық, әдiстiң қателiгi 3-5% құрайды, қолайлы жағдайларда 1-2%, кейде 0,5-1 %-ке дейiн азаяды.
Қарапайым, тез әрi дәл фотометриялық анализ әдiстер өндiрiстi бақылау үшiн, қоспаларды анықтау үшiн және өндiрiс орындары мен ғылыми-зерттеу лабораторияларындағы көптеген сүрақтарды шешуде қолданылады. Бұл әдiстердiң көмегiмен құрамды анықтауға, алынған қосылыстардың тұрақтылығын және басқа да реакцияларды зерттеуге болады.
Абсолютті фотометриялық анықтау әдістері
Фотометриялық әдісте зат концентрациясын бес әдіспен анықтайды:
1) салыстырмалы әдіс – анықталатын заттың оптикалық тығыздығы Дх және сом заттың стандартты тығыздығы Дст. Қабат қалындығы бірдей.
Дх - Сх
Дст - Сст 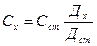
2) калибровкалық график әдісі – стандартты ерітінділер сериясын оптикалық тығыздығын өлшеп, калибровкалық график салу.
3) Қоспа – анықталатын заттың оптикалық тығыздығын өлшеп, сосын оған белгілі көлем стандартты ерітінді қосып, тағы оптикалық тығыздығын өлшейді.
Дх+ст Дх=ε·Схl Дх+ст=ε·Сх+стl
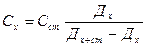
4)Қоспа қосу графикалық әдісі - концентрацияны Сх графикпен табады. Ал графикті Дх+ст=f(Сст) арасында салады.
5) Молярлық сіңіру әдісі – Егер ε белгілі болса, онда Сх=Дх/εl ал егер ε белгісіз болса, онда стандартты ерітіндіні фотометрияның ε табуға болады.
ε=Дст/Сстl
Date: 2016-05-15; view: 1078; Нарушение авторских прав